
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Состояние ТС. Процесс изменения состояния
Состояние ТС характеризуется следующими параметрами: абсолютным давлением р, Па; абсолютной температурой Т, К; удельным объемом v, м3/кг (или плотностью r, кг/м3). Состояние ТС называется равновесным, если каждый из параметров имеет одинаковые численные значения во всех точках системы; в противном случае состояние ТС неравновесное. В равновесном состоянии может находиться только замкнутая ТС. Если ТС к моменту изоляции находилась в неравновесном состоянии, то через некоторое время она придет к равновесному состоянию. Время перехода от неравновесного к равновесному состоянию называется временем релаксации. Изменение состояния ТС в результате взаимодействия ее с ОС называется термодинамическим процессом. Процесс, в котором система проходит через равновесные состояния, называется равновесным. При равновесном процессе, протекающем в обратном направлении, ТС проходит через те же равновесные состояния в обратной последовательности и приходит в исходное состояние. Все равновесные процессы являются обратимыми. Основные условия обратимости процесса: · бесконечно медленное его прохождение при бесконечно малой разности давлений ТС и ОС (время перехода от одного равновесного состояния к другому больше времени релаксации, параметры успевают выравниваться по всему объему); · обмен теплотой между ТС и ОС при бесконечно малой разности температур. В термодинамике рассматриваются обратимые процессы. Все реальные процессы необратимы, они протекают с конечной скоростью (при наличии трения и диффузии) и при значительной разности температур РТ и источников теплоты (в двигателях подвод теплоты при сгорании топлива). Состояние термодинамической системы, параметры и уравнения состояния. Давление р – сила газа (пара), действующая на единицу площади стенки сосуда, в котором он находится.
m – средняя масса молекул;
Соотношения между единицами измерения давления приведены в табл. 1.1. Таблица 1.1 Соотношения между единицами измерения давления Величина |
Единица измерения | ||||||||
| Па(Н/м2) | бар | техн. атм. | физ. атм. | мм рт. ст. | мм вод. ст. | |||||
| 1 Па | 1 | 10-5 | 1,02×10-5 | 0,987×10-5 | 7,5×10-3 | 0,102 | ||||
| 1 бар | 105 | 1 | 1,02 | 0,987 | 750 | 1,02×104 | ||||
| 1техн. атм. | 9,81×104 | 0,981 | 1 | 0,968 | 735,6 | 104 | ||||
| 1физ. атм. | 1,013×105 | 1,013 | 1,0332 | 1 | 760 | 1,033×104 | ||||
| 1мм рт. ст. | 133,32 | 133,3×10-5 | 1,36×10-3 | 1,31×10-3 | 1 | 13,6 | ||||
| 1мм вод. ст. | 9,81 | 9,81×10-5 | 10-4 | 0,968×10-4 | 7,356×10-2 | 1 | ||||
Абсолютное давление:
|
|
· в атмосфере рабс = рбар; измеряется барометром Bt, мм рт. ст.; показания барометра приводятся к 0°С: B0 = Bt(1- at),
где a – постоянная барометра, учитывающая тепловое расширение ртути и шкалы, a=0,000163-0,000173 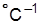 ;
;
· в закрытом сосуде при давлении больше атмосферного
рабс = рбар+ризб; избыточное давление измеряется манометром
ризб = рман;
· в закрытом сосуде при давлении меньше атмосферного
рабс = рбар – рразр; разрежение измеряется вакуумметром, рразр=рвак
Температура Т – параметр, характеризующий среднюю кинетическую энергию теплового движения частиц.
 , где КВ – постоянная Больцмана, КВ » 1,38 ×10-23 Дж/К.
, где КВ – постоянная Больцмана, КВ » 1,38 ×10-23 Дж/К.
Температурные шкалы: Кельвина (кельвин К); Цельсия (° С);
Фаренгейта (° F); Ренкина (° R).
Т К = t °С+273,15; t °С = 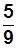 (t0 F-32); T K=1,8 0 R.
(t0 F-32); T K=1,8 0 R.
Удельный объем v, м3/кг – объем единицы массы вещества.
Плотность r, кг/м3 – масса единицы объема;  ,
,
где М – масса, кг; V – объем, м3.
Уравнения состояния системы
Уравнения Клапейрона: для 1 кг pv=RT; (1.1)
для М кг pV=RMT, (1.2)
где R – индивидуальная газовая постоянная, Дж/(кг×К).
Уравнения Клапейрона –Менделеева:
для 1 киломоля pv m = R mT; (1.3)
для N киломолей pV=R mNT, (1.4),
где R m – универсальная газовая постоянная,
R m= КВNА = 8314 Дж/(кмоль × К);
NА»6,022 ×1026 кмоль-1 – число Авогадро.
Из закона Авогадро:  .
.
С учетом этого 
где po=101325 Па; Тo = 273,15 К – нормальные физические условия (НФУ); 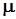 - молярная масса.
- молярная масса.
Из (1.3) при нормальных условиях
R m 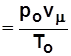
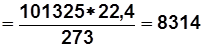 Дж/(кмоль×К).
Дж/(кмоль×К).
Физический смысл R и R m - работа, совершаемая соответственно 1 кг и 1 киломолем газа при нагревании его на 1 К при p=const.
Уравнение связи R и R m: 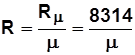 ; (1.5)
; (1.5)
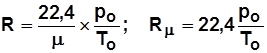 .
.
1.3. Газовые смеси: понятие о газовой смеси; способы задания состава газовых смесей; закон Дальтона; закон Амага; закон сохранения массы и количества вещества; кажущаяся молекулярная масса и газовая постоянная смеси; определение параметров смеси и ее компонентов.
|
|
Закон Дальтона. Каждый компонент смеси ведет себя независимо от других, т.е. занимает весь объем, в котором заключена смесь, и оказывает на стенки сосуда свое, так называемое парциальное давление. Температура всех компонентов в равновесном состоянии одинакова и равна температуре смеси.
Давление смеси pсм равно сумме парциальных давлений pi ее компонентов,
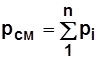 , где n – число компонентов смеси. (1.6)
, где n – число компонентов смеси. (1.6)
Объем, который занимал бы компонент смеси при температуре и давлении смеси, называется парциальным (приведенным) объемом.
Закон Амага: сумма парциальных объемов Vi компонентов равна объему смеси Vсм.
 . (1.7)
. (1.7)
По закону сохранения массы и количества вещества:
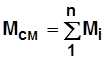 ; (1.8)
; (1.8)
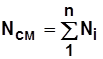 . (1.9)
. (1.9)
 , где n – концентрация молекул (число молекул в единице объема);
, где n – концентрация молекул (число молекул в единице объема); – среднеквадратическая скорость молекул.
– среднеквадратическая скорость молекул.


