
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнения состояния смеси и ее компонентов
Отсюда Задание состава смеси Массовые доли: Объемные доли: Молярные доли: Из уравнений получим Уравнения связи М,V,N смеси и компонентов
Формулы соотношения между gi и ri (ni)
Кажущаяся (средняя) молярная масса и газовая постоянная смеси Кажущаяся молярная масса и газовая постоянная смеси определяются из условия равенства массы и числа молекул реальной смеси и заменяющего ее газа. В соответствии с (1.8) и (1.15) получим
В соответствии с (1.9) и (1.15) получим
Плотность и удельный объем смеси
Парциальное давление компонентов
1.4. Теплоемкость газов: понятие о теплоемкости; факторы, оказывающие влияние на теплоемкость; способы задания теплоемкостей; закон Майера; теплоемкость газовой смеси. Удельная теплоемкость – количество теплоты, необходимое для изменения температуры единицы количества газа в данном процессе на 1 кельвин. В зависимости от единицы количества газа используется теплоемкость:
молярная mc, Дж/(кмоль×K); объемная Факторы, влияющие на теплоемкость: · природа газа (атомность): чем больше атомов в молекуле (не более трех), тем больше теплоемкость; · характер процесса подвода (отвода) теплоты. В общем случае теплота затрачивается на изменение внутренней энергии газа и на совершение им работы; чем больше доля подводимой теплоты, которая идет на совершение работы, тем больше теплоемкость.
изохорная cv(mcv) при v=const; изобарная cp(mcp) при p=const.
Рис. 1.2 Уравнения Майера: Показатель адиабаты К:
· температура: теплоемкость двух- и многоатомных газов с ростом температуры увеличивается, а показатель адиабаты уменьшается. Теплоемкость и показатель адиабаты одноатомного газа от температуры не зависят. Теплоемкость реального газа зависит также от давления. Истинная и средняя теплоемкости Истинная теплоемкость – отношение бесконечно малого количества теплоты, сообщаемой единице количества газа, к вызываемому при этом бесконечно малому повышению его температуры.
Средняя теплоемкость – количество теплоты, необходимое для нагревания единицы количества газа на 1 кельвин в среднем за рассматриваемый интервал изменения температуры (от T1 до T2).
На рис. 1.3 пл.1¢342¢1¢= пл.1¢122¢1¢ - теплота q, подведенная к 1 кг газа в интервале температур T1…T2.
Рис. 1.3 Определение средней теплоемкости
Из сопоставления (1.32) и (1.33) следует
аналогично По зависимости истинной теплоемкости
Рис. 1.4. Проточный калориметр: 1,2 – термометры; 3 – электронагреватель Теплоемкость газовых смесей
Термодинамические функции. Первый закон термодинамики
|
||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 47; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.86.155 (0.011 с.) |

 и
и  (1.10)
(1.10) . (1.11)
. (1.11) . (1.12)
. (1.12) . (1.13)
. (1.13)
 , т.е.
, т.е.  . (1.14)
. (1.14) . (1.15)
. (1.15) ,
,  , (1.16)
, (1.16)
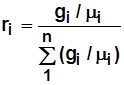 . (1.17)
. (1.17) , (1.18)
, (1.18) и
и 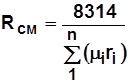 . (1.19)
. (1.19)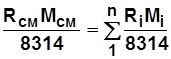 ;
;  ; (1.20)
; (1.20)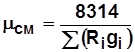 . (1.21)
. (1.21) ;
;  ;
;  ; 1.22)
; 1.22) ;
;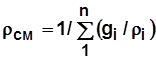 ;
; 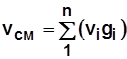 . 1.23)
. 1.23) ;
;  ; (1.24)
; (1.24) . (1.25)
. (1.25) массовая c, Дж/(кг×K); Соотношение между ними:
массовая c, Дж/(кг×K); Соотношение между ними: ;
;  . (1.26)
. (1.26) , Дж/(м3×K)
, Дж/(м3×K)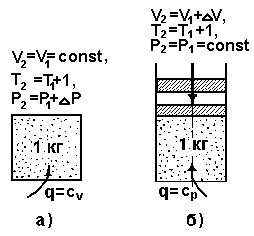 Характерные теплоемкости (рис.1.2.):
Характерные теплоемкости (рис.1.2.):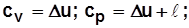
 где
где 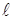 - работа 1 кг газа при нагревании на 1 K в условиях, когда p=const, т. е.
- работа 1 кг газа при нагревании на 1 K в условиях, когда p=const, т. е.  .
. ; (1.27)
; (1.27) . (1.28)
. (1.28) ; (1.29)
; (1.29) ;
;  ;
;  ;
; 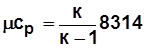 ; (1.30)
; (1.30) ;
; 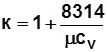 ; (1.31)
; (1.31) ;
;  , где с зависит от T.
, где с зависит от T. представляют графически, таблично, аппроксимирующим выражением вида
представляют графически, таблично, аппроксимирующим выражением вида , или линейным уравнением
, или линейным уравнением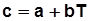 , где
, где 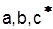 - постоянные коэффициенты.
- постоянные коэффициенты. ;
;  ;
; ;
; 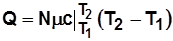 .
.
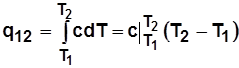 . (1.32)
. (1.32) определяют с использованием таблиц или графических зависимостей средней теплоемкости в интервале температур от 0 до данной температуры Т:
определяют с использованием таблиц или графических зависимостей средней теплоемкости в интервале температур от 0 до данной температуры Т: 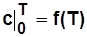 . При известной зависимости
. При известной зависимости  . (1.33)
. (1.33)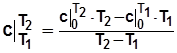 ; (1.34)
; (1.34) . (1.35)
. (1.35)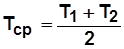 ,
,  . Например,при линейной зависимости
. Например,при линейной зависимости . (1.36)
. (1.36)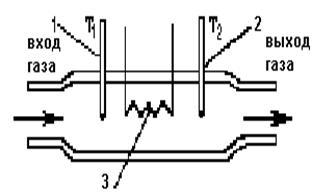 Экспериментально теплоемкость в заданном интервале температур определяют в проточном калориметре (рис.1.4.) при p=const,
Экспериментально теплоемкость в заданном интервале температур определяют в проточном калориметре (рис.1.4.) при p=const,  .
.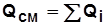 ;
;  ;
; 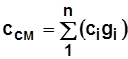 ; (1.37)
; (1.37) ;
; 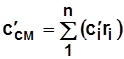 . (1.38)
. (1.38)


