
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рассчитать концентрацию ионов водорода в буферном растворе, составленном из 0,1 М селенида натрия и 0,01 М гидроселенида натрия.
Равновесие между формами [Se2-] и [HSe-] описывается Ка,2 = 10-11, концентрация сопряженной кислоты в десять раз меньше, чем соли. Воспользуемся полным уравнением с учетом гидролиза соли. . После преобразований приходим к квадратному уравнению:
Приблизительный расчет без учета гидролиза дает:
На этой же смеси рассмотрим влияние такого фактора, как разбавление буферного раствора. Пример. Рассчитать концентрацию ионов водорода в буферном растворе, составленном из 0,01 М селенида натрия и 0,001 М гидроселенида натрия. ,
Для селенидного буферного раствора с содержанием компонентов 0,1: 0,1 разбавление раствора в 10 раз привело к незначительному изменению рН в пределах одной десятой
Рассчитать концентрацию ионов водорода в буферном растворе, составленном следующим образом: 1) 100 мл 1 М аммиака + 5 мл 37% соляной кислоты (плотность 1,185) 2) 100 мл 2 М муравьиной кислоты + 5 г гидроксида натрия, 3) 100 мл 0,5 М щавелевой кислоты + 40 мл 10% раствора NaOH (плотность 1,11), 4) 10 мл 0,2 М сернистой кислоты + 5 мл 2% раствора NaOH (плотность 1,02), 5) 100мл 0,6 М гидрокарбоната натрия + 1 г гидроксида натрия, 6) 10 мл 25,6% фосфорной кислоты (плотность 1,15) + 8 мл 13% раствора гидроксида калия (плотность 1,12) 7) 13,6 г дигидрофосфата калия растворили в 100 мл 1% раствора гидроксида натрия, 8) 25 мл 1 М раствора фосфата натрия + 1 мл 94% раствора серной кислоты (плотность 1,83), 9) 10 мл концентрированной уксусной кислоты (плотность 1,050) + 10 мл 30% гидроксида натрия (плотность 1,33), 10) 10 мл 86% фосфорной кислоты (плотность 1,70) + 30 г фосфата калия + 100 мл воды. 7. ПРИГОТОВЛЕНИЕ БУФЕРНЫХ РАСТВОРОВ С ЗАДАННЫМ ЗНАЧЕНИЕМ рН. Пример. Сколько гидроксида натрия нужно добавить к 1 л 1 М муравьиной кислоты (Ка = 1,8·10-4), чтобы получить буферный раствор с рН = 4,0? Обозначим Х необходимое количество молей NaOH. Количество молей образовавшегося формиата натрия будет равно Х, а оставшейся муравьиной кислоты (1 – Х) Для расчетов воспользуемся формулой:
Молекулярная масса NaOH = 40. 0,643 х 40 = 25,7 г гидроксида натрия. Пример. Имеется 100 мл 0,5 М раствора лимонной кислоты H3 Cit (Kа,1= 8,0·10-4, Kа,2= 1,7·10-5, Kа,3= 4·10-7). Сколько гидроксида натрия нужно добавить, чтобы получить буферный раствор с рН 6? Чтобы раствор можно было использовать как буферный, соотношение в нем сопряженных кислоты и основания должно лежать в интервале 0,1 – 10, то есть
Обозначим Х количество молей NaOH, необходимое для частичной нейтрализации кислой соли по третьей ступени.
(0,1 + 0,0143) моля х 40 = 4,572 г NaOH. Пример.
|
|||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 96; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.95.38 (0.004 с.) |

 , pH = 11,77.
, pH = 11,77. , pH = 12,00.
, pH = 12,00.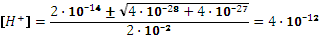 , pH = 11,40.
, pH = 11,40.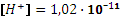 , pH = 11,01.
, pH = 11,01. , pH = 10,93.
, pH = 10,93.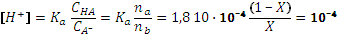 . X = 0,643 моля.
. X = 0,643 моля. . Нужное нам значение рН обеспечит Kа,3, которая описывает равновесие между формами [HCit2-] и [Cit3-]. Для нейтрализации 100 мл 0,5 М раствора лимонной кислоты до двузамещенной соли HCit2- необходимо добавить 2 х 0,1л х 0,5 моля = 0,1 моля NaOH, то есть 4 г.
. Нужное нам значение рН обеспечит Kа,3, которая описывает равновесие между формами [HCit2-] и [Cit3-]. Для нейтрализации 100 мл 0,5 М раствора лимонной кислоты до двузамещенной соли HCit2- необходимо добавить 2 х 0,1л х 0,5 моля = 0,1 моля NaOH, то есть 4 г. .
. , откуда Х = 0,0143 моля. Молекулярная масса NaOH – 40.
, откуда Х = 0,0143 моля. Молекулярная масса NaOH – 40.


