
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
К решению расчетных задач по темеСтр 1 из 4Следующая ⇒
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Рассчитать концентрацию ионов водорода в смеси 0,01 М соляной кислоты и 0,1 М муравьиной кислоты.
При более строгом подходе можно учесть влияние ионной силы раствора. В нашем случае смеси одноосновных кислот ионная сила составит 1,2·10-2. Если раствор содержит смесь двух слабых кислот НА1 и НА2 различных концентраций С1 и С2, то условие электронейтральности для этой смеси можно записать:, а уравнения материального баланса Равновесную концентрацию аниона можно выразить Подставляя эти значения в уравнение электронейтральности, придем к выражению:
Поскольку речь идет о растворах слабых кислот, мы можем принять без большой ошибки, что
Для случая очень разбавленных растворов, где Ка и С соизмеримы, мы придем к уравнению третьей степени относительно Аналогично, если речь идет о смеси двух слабых оснований:
Пример. Рассчитать концентрацию ионов водорода в буферном растворе, составленном из 0,1 М селенида натрия и 0,01 М гидроселенида натрия. Равновесие между формами [Se2-] и [HSe-] описывается Ка,2 = 10-11, концентрация сопряженной кислоты в десять раз меньше, чем соли. Воспользуемся полным уравнением с учетом гидролиза соли. . После преобразований приходим к квадратному уравнению:
Приблизительный расчет без учета гидролиза дает:
На этой же смеси рассмотрим влияние такого фактора, как разбавление буферного раствора. Пример. Имеется 100 мл 0,5 М раствора лимонной кислоты. Сколько г гидроксида натрия необходимо добавить, чтобы получить буферный раствор с рН 5? Константы диссоциации лимонной кислоты по первой и второй ступени различаются меньше, чем на два порядка, при рН 5 возможно сосуществование всех форм соли в соизмеримых количествах. Рассчитаем доли форм лимонной кислоты для этой концентрации ионов водорода.
Равновесие между преобладающими формами преобладающими формами описывается константой диссоциации по второй ступени. Для нейтрализации лимонной кислоты по первой ступени потребуется 0,5 х 0,1 моля NaOH, то есть 2 г. Обозначим за Х количество молей NaOH, которое необходимо добавить, чтобы осталось 36% дигидроцитрата.
Пример. Сколько г сухого NaOH необходимо добавить к 100 мл 0,2 М раствора щавелевой кислоты, чтобы получить буферный раствор с рН 4,3? 6) Сколько мл 11% раствора NaOH (плотность 1,12) нужно добавит к 1 л 0,1 М раствора сернистой кислоты, чтобы получить буферный раствор с рН 8,0? Задачи. 1) Вычислить рН раствора, содержащего смесь: 10-3 моль/л соляной кислоты, 10-2 моль/л муравьиной кислоты и 10-1 моль/л уксусной кислоты. 2) Рассчитать концентрацию ионов водорода в смеси 10-2моль/л угольной кислоты и 10-1 моль/л хлористого аммония. 3) Рассчитать концентрацию ионов водорода в растворе: 5·10-2 моль/л гидрокарбоната натрия + 10-1 моль/л ацетата натрия. 4) Вычислить рН в растворе ацетата натрия 5·10-2 моль/л, насыщенного углекислотой до концентрации 2·10-2 моль/л. 5) Вычислить рН в 10-2М растворе сероводорода после добавления к нему ацетата натрия в количестве 10-2 моль/л. 6) Как изменится рН, если к 20 мл 0,1 М раствора NH4 HS добавить 10 мл 0,1 М раствора HCl? 7) Сколько г гидроксида натрия необходимо добавить к 100 мл смеси кислот (0.1 моль/л соляной + 0,1 моль/л уксусной), чтобы получить буферный раствор с рН 4,7. К 20 мл смеси уксусной и муравьиной кислот, суммарной концентрации 0,1 моль/л добавили 20 мл 0,05 М раствора гидроксида натрия. рН раствора установилось 4,3. Найти концентрации кислот в исходном растворе. МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РЕШЕНИЮ РАСЧЕТНЫХ ЗАДАЧ ПО ТЕМЕ «КИСЛОТНО – ОСНОВНЫЕ РАВНОВЕСИЯ»
к курсу и практикуму «Аналитическая химия 1» для студентов химического факультета
Санкт-Петербург 2017 Рекомендовано Ученым советом института химии СПбГУ Утверждено на заседании кафедры аналитической химии химического факультета в качестве учебно-методического пособия УДК 546
Рецензенты: доцент кафедры неорганической химии к.х.н. М. Ю. Скрипкин доцент кафедры аналитической химии к.х.н. Т.Г. Никитина
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РЕШЕНИЮ РАСЧЕТНЫХ ЗАДАЧ ПО ТЕМЕ «КИСЛОТНО-ОСНОВНЫЕ РАВНОВЕСИЯ» к курсу и практикуму «Аналитическая химия 1» для студентов института химии / А.Е. Зеймаль, В.В. Никоноров, И.Д. Кучумова. СПб, 2017.
Методические указания по решению расчетных задач написаны преподавателями кафедры аналитической химии в соответствии с программой лекционного курса, семинарских и лабораторных занятий для студентов 2 курса института химии СПбГУ. В указаниях представлены основные типы задач, которые студентам полезно решить при изучении этой темы, приведены теоретические предпосылки и примеры решения подобных задач, предложены задачи для самостоятельной работы.
1. ОСНОВНЫЕ ПОНЯТИЯ. Все расчеты кислотно-основных равновесий в водных растворах базируются на использовании следующих основных понятий: 1. Константа диссоциации. Для одноосновных кислот НА: для однопротонных оснований ВОН:
для двухосновных кислот Н2А:
2. Условие материального баланса (неизменность числа атомов данного сорта при протекании реакции в изолированной системе). Например, для двухосновных кислот Н2А:
3. Условие электронейтральности (раствор в целом электронейтрален):
Например, при диссоциации трехосновной кислоты Н3А:
4. Степень диссоциации Вычисляется в соответствии с законом разведения Оствальда: Для расчетов ионных равновесий полезно уметь рассчитывать равновесные концентрации всех возможных форм слабой кислоты или основания, присутствующих в растворе, при фиксированном значении рН, а также доли этих форм Для одноосновной кислоты обозначим: Запишем уравнение материального баланса для слабой одноосновной кислоты: . Выразим Подставим в уравнение материального баланса: Приведем слагаемые к общему знаменателю и вынесем за скобки Отсюда: Аналогично можно вывести уравнение и для второй формы: Сумма долей форм всегда равна единице, это следует из уравнения материального баланса. Для двухосновной кислоты запишем уравнение материального баланса по аниону:
и выражения для констант диссоциации:
Выразим
приведем к общему знаменателю и вынесем общий множитель
Перевернув дробь, получим:
Аналогично выводятся выражения для других форм:
Для трехосновной кислоты:
Сумма всех форм равна единице. Рассчитать степени диссоциации слабых кислот и равновесные концентрации их форм в растворах при фиксированных значениях рН: 1) 10-1М раствор фторида натрия при рН 4, 2) 10-3М раствор муравьиной кислоты при рН 6, 3) 10-2М раствор цианида калия при рН 5, 4) 10-1М раствор аммиака при рН 9, 5) 10-2М раствор серной кислоты при рН 3, 6) 10-1М раствор фосфорной кислоты при рН 4, 7) 10-3М раствор карбоната натрия при рН 9, 8) 10-1М раствор щавелевой кислоты при рН 4, 9) 10-2М раствор фосфорной кислоты при рН 10, 10) 10-2М раствор сульфосалицилата натрия при рН 12.
Общее содержание электролита в растворе иногда следует учитывать при расчете ионных равновесий. Общая ионная сила раствора:
Коэффициенты активности (
Где: А и В – коэффициенты, зависящие от температуры и диэлектрической проницаемости растворителя (для водных растворов при температуре 25оС А =0,51, В =0,33); а - параметр Кьелланда, зависящий от эффективного ионного радиуса (принимает значения от 3 до 11). Уравнение справедливо для значений ионной силы не превышающих 0,1. Для приблизительных расчетов используют уравнение Дэвиса:
Для растворов с ионной силой 0,1 – 1,0 используют расширенное уравнение Дэвиса:
При ионной силе менее 10-3 моль/л значения коэффициентов активности близки к единице. При значениях ионной силы около 1, коэффициенты активности для однозарядных и двухзарядных ионов также близки к единице. Минимальное значение коэффициент активности иона водорода (0,8) принимает при ионной силе 0,2 – 0,3. В большинстве случаев при расчете кислотно-основных равновесий влиянием ионной силы раствора пренебрегают, и иногда это приводит к существенным искажениям результатов. 2. РАСЧЕТЫ В РАСТВОРАХ ОДНОПРОТОННЫХ КИСЛОТ И ОСНОВАНИЙ Пример 1: Рассчитать степень диссоциации и [ H+] в а) 1·10-2М и б) 5·10-7М растворах азотной кислоты. Для растворов сильных кислот и оснований степень диссоциации практически равна 1. а) Запишем уравнение электронейтральности:
В присутствии ионов водорода диссоциация воды практически подавлена. Вклад гидроксил-ионов в уравнении электронейтральности считают значимым лишь в разбавленных растворах, при концентрациях 10-6М и менее.
Расчеты по уравнениям Дебая-Хюккеля или Дэвиса для ионной силы 10-2 дают значение коэффициента активности ионов водорода 0,914. Поэтому б) Для случая очень разбавленного раствора:
Решая квадратное уравнение, находим Пример 2. Рассчитать степень диссоциации и рН в растворах уксусной кислоты концентрации: а) 10-2М, б) 10-5М. Уксусную кислоту относят к слабым электролитам, Ка =1,75 · 10-5, степень диссоциации ее будет зависеть от концентрации. Расчет степени диссоциации проведем по формуле, следующей из закона Оствальда:
а) α = 4,095 10-2, или по упрощенной формуле: Запишем выражение для константы диссоциации: Выразим а из уравнения материального баланса выразим и подставим в выражение для константы: Преобразуя полученное выражение, приходим к квадратному уравнению:
Если степень диссоциации составляет менее 5%, то можно пренебречь изменением общей концентрации кислоты за счет диссоциации и принять Получаем упрощенную формулу:
В нашем случае а) степень диссоциации составила 4% и расчеты рН по строгой и по упрощенной формуле практически совпадают.
б) Для 10-5М уксусной кислоты α = 0,454 по квадратному уравнению. По приближенной формуле получается значение α больше 1, что невозможно.
Очевидно, что при степени диссоциации 45% расчет должен проводиться по полному уравнению. Пример 3. Рассчитать рН в 1·10-3М растворе аммиака NH4 OH (NH3· H2 O). Аммиак в водном растворе проявляет свойства слабого основания Из условия электронейтральности следует, что а из уравнения материального баланса: Подставив оба выражения в уравнение для константы диссоциации и проведя необходимые преобразования, приходим к квадратному уравнению относительно [OH-]
и решаем его. [ OH- ] = 1,25·10-4 M, Если степень диссоциации менее 5%, то
Рассчитать степень диссоциации и [ H+]: 1) в 10-3М растворе фенола (карболовой кислоты), 2) в 10-1М растворе борной кислоты, 3) в 10-1М и 10-3М растворах фтористоводородной кислоты, 4) в 10-4М растворе муравьиной кислоты, 5) в 10-8 М растворе соляной кислоты, 6) в 10-1М и в 10-5М растворах аммиака.
3. ГИДРОЛИЗ КАК ЧАСТНЫЙ СЛУЧАЙ КИСЛОТНО-ОСНОВНЫХ РАВНОВЕСИЙ. С позиций протолитической теории Бренстеда и Лоури в качестве слабых оснований мы можем рассматривать анионы слабых кислот (сопряженные основания). В водном растворе происходит протонирование аниона с образованием сопряженной кислоты и гидроксил-иона – реакция гидролиза по аниону: А- + Н2О = НА + ОН- Степенью диссоциации такого слабого основания является степень гидролиза
Константа равновесия реакции имеет вид:
и связана с константой диссоциации сопряженной слабой кислоты ионным произведением растворителя (воды):
Таким образом, все алгоритмы расчетов в растворах слабых кислот и оснований справедливы и для растворов гидролизующихся солей. Например, ион аммония может рассматриваться как слабая кислота с константой диссоциации.
Пример. Рассчитать степень гидролиза и Фтористоводородная (плавиковая) кислота имеет Степень гидролиза
В нашем случае, когда степень гидролиза существенно меньше 5% мы можем пользоваться упрощенными формулами. Ответ:
Рассчитать степень гидролиза и [ H+] в растворах солей: 1) в 10-2М и в 10-4М растворах формиата натрия, 2) в 10-2М и в 10-4М растворах цианида натрия, 3) в 10-1М и в 10-4М растворах нитрата аммония, 4) в 10-2М растворе нитрита натрия, 5) в 10-3М растворе бензоата натрия. 4. РАСЧЕТЫ В РАСТВОРАХ МНОГОПРОТОННЫХ КИСЛОТ И ОСНОВАНИЙ. Запишем уравнение материального баланса и условие электронейтральности для двухосновной кислоты:
Используя выражения для констант диссоциации, оба уравнения представим следующим образом:
После преобразований получим уравнение третьей степени относительно
Если константы различаются на несколько порядков, то вкладом второй ступени диссоциации можно пренебречь:
Или, если степень диссоциации мала:
Пример. Рассчитать концентрацию в 1·10-2М растворе щавелевой кислоты. Щавелевая кислота – двухосновная (Ка,1=5,6·10-2, Ка,2=5,4·10-5). Константы различаются на три порядка. Предположим, что этого достаточно, чтобы не учитывать диссоциацию по второй ступени. Концентрация раствора и численное значение первой константы близки, степень диссоциации по первой ступени значительно больше 5%. Проводим расчет по квадратному уравнению:
По приближенной формуле получим явно ошибочный результат:
Теперь при вычисленном значении Формула для расчета:
Получившееся значение Если мы проведем такие же расчеты для 1·10-4М раствора щавелевой кислоты, то получим Пример. Рассчитать степень гидролиза и Константы гидролиза сульфит-иона:
Константы диссоциации сернистой кислоты (К1=1,6·10-2, К2 = 6,3·10-8) и соответствующие им константы гидролиза различаются на шесть порядков и мы справедливо можем пренебречь гидролизом по второй ступени. Вычислим степень гидролиза:
Степень гидролиза составила менее 5%, поэтому мы можем пользоваться упрощенной формулой: Для полученного значения
Рассчитать [ H+] в растворах многоосновных кислот: 1) в 10-1М и в 10-4М растворах серной кислоты, 2) в 10-2М и в 10-4М растворах угольной кислоты, 3) в 10-1М растворе сульфосалициловой кислоты, 4) в 10-1М и в 10-3М растворах щавелевой кислоты, 5) в 10-4 М растворе сульфосалициловой кислоты, 6) в 10-5М растворе фосфорной кислоты, 7) в 10-3М растворе сернистой кислоты, 8) в 10-2М растворе янтарной кислоты, 9) в 10-2М растворе лимонной кислоты. Рассчитать степень гидролиза и [ H+] в растворах солей: 1) в 10-1М и в 10-3М растворах карбоната натрия, 2) в 10-2М и в 10-4М растворах сульфида натрия, 3) в 10-3М растворе фосфата натрия, 4) в 10-2М и в 10-4М растворах цитрата натрия, 5) в 10-2М растворе сульфосалицилата натрия, 6) в 10-1М и в 10-5М растворах оксалата натрия. 5. РАСЧЕТЫ В СМЕСЯХ КИСЛОТ ИЛИ ОСНОВАНИЙ. При расчете кислотности в растворах смесей сильной и слабой кислот можно использовать тот же подход: рассчитать концентрацию ионов водорода за счет полной диссоциации сильной кислоты, затем при этой кислотности рассчитать степень диссоциации слабой кислоты и получить общую концентрацию ионов водорода в растворе. Пример.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 239; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.80.122 (0.135 с.) |
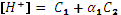 .
.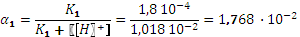 ,
,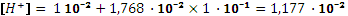 и pH = 1,93.
и pH = 1,93. = 0,89,
= 0,89, 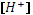 =1,05·10-2, рН = 1,98.
=1,05·10-2, рН = 1,98.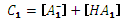 ;
;  .
. .
.
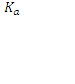 и пренебречь
и пренебречь 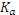 , рассматривая суммы. В результате мы приходим к уравнению:
, рассматривая суммы. В результате мы приходим к уравнению: .
. .
.
 , pH = 11,77.
, pH = 11,77. , pH = 12,00.
, pH = 12,00. ,
,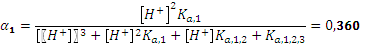 ,
,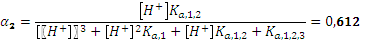 ,
,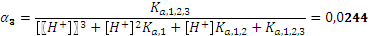 .
. . Х = 3,15 10-2. (0,05 + 0,0315) моля х 40 = 3,26 г NaOH
. Х = 3,15 10-2. (0,05 + 0,0315) моля х 40 = 3,26 г NaOH ,
,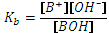 ,
, ,
,

 , где
, где 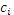 - равновесные концентрации заряженных частиц, несущих заряд
- равновесные концентрации заряженных частиц, несущих заряд  .
.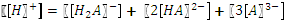
 (доля диссоциированной формы, отношение количества продиссоциировавших частиц данного сорта к общему количеству их в растворе). Для одноосновной кислоты
(доля диссоциированной формы, отношение количества продиссоциировавших частиц данного сорта к общему количеству их в растворе). Для одноосновной кислоты  .
.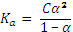 , решая квадратное уравнение, или приблизительно, по упрощенной формуле
, решая квадратное уравнение, или приблизительно, по упрощенной формуле  , если степень диссоциации меньше 5%.
, если степень диссоциации меньше 5%.
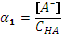 .
. из константы диссоциации:
из константы диссоциации: 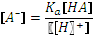 .
.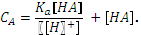
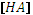 :
: 
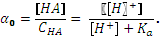


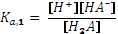 ,
,  ,
,  .
.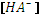 из
из  и
и  из
из  и подставим в уравнение материального баланса:
и подставим в уравнение материального баланса: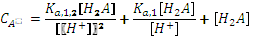 ,
,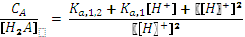 .
.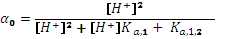 .
.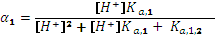 и
и 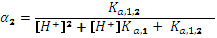 .
. ,
, ,
, ,
, .
. , где: С – концентрации заряженных частиц в растворе (г-ион/л), zi – заряд иона.
, где: С – концентрации заряженных частиц в растворе (г-ион/л), zi – заряд иона. ,
,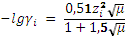 .
.
 .
.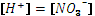 = 10-2М.
= 10-2М.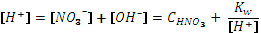
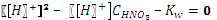 .
.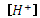 = 5,19 · 10-7М, а не 5,00 · 10-7М, как можно было бы получить из грубых расчетов. Поскольку в растворе отсутствуют другие электролиты, при ионной силе менее 10-4 раствор считают идеальным и коэффициенты активности равны единице.
= 5,19 · 10-7М, а не 5,00 · 10-7М, как можно было бы получить из грубых расчетов. Поскольку в растворе отсутствуют другие электролиты, при ионной силе менее 10-4 раствор считают идеальным и коэффициенты активности равны единице.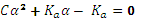 .
.
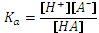 .
.
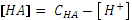
 .
.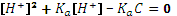 .
. .
. 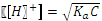 .
. .
. ,
,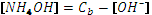 .
.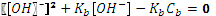 ,
,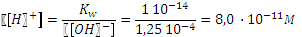 , рН=10.10
, рН=10.10 , а
, а  ,
, 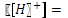 7,5·10 -11М, рН=10.12
7,5·10 -11М, рН=10.12 .
.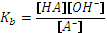
 .
.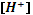 в 1·10-2М растворе фторида натрия.
в 1·10-2М растворе фторида натрия.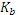 = 1,5·10-11.
= 1,5·10-11.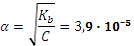 .
.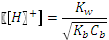 или
или 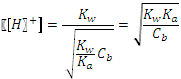 .
.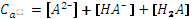
 .
. и
и .
.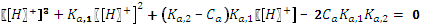 .
.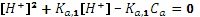 .
. .
.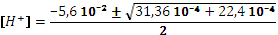 = 8,66·10-3М.
= 8,66·10-3М. М.
М.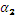 свидетельствует, что допущение вполне справедливо и в данном случае диссоциацию по второй ступени можно не учитывать.
свидетельствует, что допущение вполне справедливо и в данном случае диссоциацию по второй ступени можно не учитывать.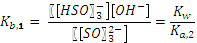 ,
, 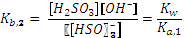 .
.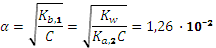 .
.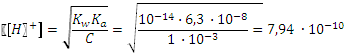 .
. рассчитаем долю формы Н2А, и убедимся, что гидролиз по второй ступени пренебрежимо мал:
рассчитаем долю формы Н2А, и убедимся, что гидролиз по второй ступени пренебрежимо мал: .
. 


