
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Смешали равные объемы 0,1 М аммиака и 0,1 М карбоната натрия. Рассчитать рН получившегося раствора.
С позиций протолитической теории карбонат-ион можно рассматривать как слабое основание с константами основной диссоциации
[H+] = 2,94 10-12, pH = 11,53. Рассчитать [ H+] в растворах: 1) 10-1М соляная и 10-1М уксусная кислоты, 2) 10-1М уксусная и 10-4М соляная кислоты, 3) 10-2М сернистая и 10-3М соляная кислоты, 4) 10-1М соляная и 10-2М щавелевая кислоты, 5) 10-2М сернистая и 10-2М сероводородная кислоты, 6) 10-2М серная и 10-4М соляная кислоты, 7) 10-1М гидроксид натрия и 2 10-2М карбонат натрия, 8) 10-1М сульфит натрия и 10-3М гидроксид натрия. 9) 10-1М аммиак и 10-2М гидроксид натрия. 6. РАСЧЕТЫ В БУФЕРНЫХ РАСТВОРАХ. Если в растворе присутствуют слабая кислота и сопряженное с ней основание, раствор обладает буферными (по иону водорода) свойствами. Из выражения для константы диссоциации слабой кислоты следует:
Присутствие аниона слабой кислоты в растворе существенно подавляет ее диссоциацию, а присутствие недиссоциированной формы слабой кислоты подавляет гидролиз аниона. Пренебрегая соответствующими слагаемыми в уравнениях материального баланса, приходим к простому выражению:
Пример. К одному литру 0,1 М раствора аммиака добавлено 10,7 г хлористого аммония. Рассчитать Молекулярная масса хлористого аммония 53,5. 10,7 г NH4Cl составляют 0,2 моля. Поскольку сопряженные кислота (NH4+) и основание (NH4OH) находятся в одном объеме, можно от концентраций перейти к количеству молей:
В большинстве случаев фактором ионной силы раствора пренебрегают, но при более строгом подходе можно учесть коэффициенты активности. Ионная сила будет определяться концентрацией хлористого аммония и составит величину 0,2 М, Пример. К 1 л 1М раствора аммиака добавлено 50 мл 5 М HNO3. Рассчитать рН. Запишем уравнение реакции: NH4 OH + H+ = NH4+ + H2O. Количество молей образовавшейся сопряженной кислоты эквивалентно количеству молей добавленной азотной кислоты, а количество молей основания уменьшилось соответственно.
Однако, в случаях, когда концентрация соли мала или константа диссоциации кислоты не так уж мала (
Если
Рассмотрим эти два случая на примере буферных растворов на основе селенистоводородной кислоты H2Se (Ка,1= 1,7 10-4, Ка,2= 1,0 10-11) и ее солей. Пример. К 0,2 литра 0,1 М раствора H2 Se добавлено 2 мл 0,25 М раствора NaOH. Рассчитать концентрацию ионов водорода. Запишем реакцию: H2Se + NaOH = NaHSe + H2O. Рассчитаем концентрации участников реакции: [NaHSe] = (0,002 x 0,25) / 0,202 = 2,475 · 10-3 M [H2Se] = (0,2 x 0,1 - 0,002 x 0,25) / 0,202 = 9,653 · 10-2. Концентрации кислоты и соли различаются в 40 раз, такую смесь можно лишь условно считать буферным раствором. По приближенному уравнению:
Проведем расчеты по полному квадратному уравнению:
Разница в расчетах составляет 0,4 единицы рН, это существенное различие.Очевидно, что присутствие столь малых количеств соли недостаточно для подавления диссоциации кислоты. В таких случаях расчеты следует вести по уравнениям, выведенным без допущений. Пример.
|
|||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 86; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.48.135 (0.005 с.) |
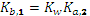 = 2,128 10-4 и
= 2,128 10-4 и 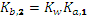 = 2,25 10-8. Гидролизом карбонат-иона по второй ступени пренебрегаем. После смешения растворов концентрации веществ уменьшились вдвое. По сравнению с концентрациями численные значения констант существенно меньше и мы можем использовать для расчета квадратное уравнение.
= 2,25 10-8. Гидролизом карбонат-иона по второй ступени пренебрегаем. После смешения растворов концентрации веществ уменьшились вдвое. По сравнению с концентрациями численные значения констант существенно меньше и мы можем использовать для расчета квадратное уравнение.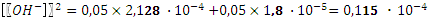 .
.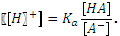
 .
.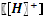 получившегося буферного раствора.
получившегося буферного раствора.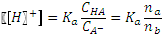 .
.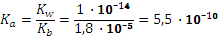 .
.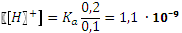 , pH = 8,96.
, pH = 8,96.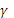 =0,80,
=0,80, 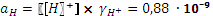 , pH = 9,06.
, pH = 9,06.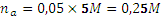 ,
, 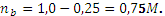
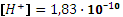 , pH = 9,74.
, pH = 9,74.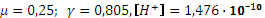 . pH = 9,83.
. pH = 9,83.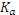 больше 10-3), нельзя пренебрегать диссоциацией кислоты. Концентрация аниона в растворе увеличится настолько же, насколько уменьшится концентрация кислоты:
больше 10-3), нельзя пренебрегать диссоциацией кислоты. Концентрация аниона в растворе увеличится настолько же, насколько уменьшится концентрация кислоты: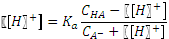 .
.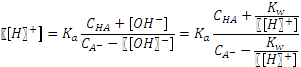 .
.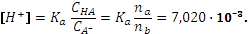 pH = 2,15.
pH = 2,15.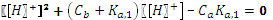 .
.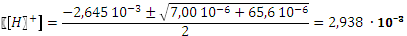 . pH = 2,53.
. pH = 2,53.


