
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гибридизация атомных орбиталей
При образовании химических связей нередко участвуют электроны различных подуровней одного и того же атома, например s- и р-электроны. Однако, возникающие при этом связи обладают близкими значениями энергии. Чем это объяснить? Американский ученый Л. Полинг выдвинул идею о гибридизации атомных орбиталей. Согласно этой идее, если у атома, вступающего в химическую связь, имеются разные АО (s-, p-, d- или f-АО), то в процессе образования химической связи происходит гибридизация (смешение) АО, т.е. из разных АО образуются одинаковые (эквивалентные) АО. Форма гибридных АО отличается от формы исходных АО (рис. 2.5.).
Если в химическую связь вступает атом, у которого на внешней оболочке имеются s- и р-электроны, то у данного атома в процессе образования связи происходит sp -гибридизация АО (рис. 2.6.).
Если у атома, вступающего в химическую связь, на внешней оболочке один s- и два р-электрона, то происходит sp2-гибридизация АО этого атома (рис.2.7.).
У атома, имеющего на внешней оболочке один s- и три р-электрона, при химическом взаимодействии происходит sp3-гибридизация этих АО (рис. 2.8.).
Возможны также более сложные виды гибридизации с участием d- и f-орбиталей атомов. Некоторые наиболее распространенные типы гибридизации и соответствующие им геометрические формы молекул приведены в табл. 2.3.
Таблица 2.3. Некоторые типы гибридизации и геометрия молекул
Ниже рассмотрены примеры различных видов гибридизации s- и p-орбиталей.
Гибридизация одной s- и одной p-орбитали (sp-гибридизация) происходит, например, при образовании галогенидов бериллия, цинка, кадмия и ртути. Атомы этих элементов в нормальном состоянии имеют во внешнем слое два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в p-состояние – появляется два неспаренных электрона, один из которых s-, а другой p-электрон. При образовании химической связи эти две различные орбитали преобразуются в две одинаковые гибридные орбиталиОбщее количество орбиталей при гибридизации не изменяется. (sp-орбитали), направленные под углом 180˚ друг к другу, – две связи имеют противоположное направление (рис. 2.9).
Рис. 2.9. Перекрывание sp-орбиталей бериллия и p-орбиталей хлора в молекуле BeCl2 Экспериментальное определение структуры молекул BeГ2, ZnГ2, CdГ2, HgГ2 (Г–галоген) показало, что эти молекулы являются линейными, и обе связи металла с атомами галогена имеют одинаковую длину. Гибридизация одной s- и двух p-орбиталей (sp2-гибридизация) имеет место, например, при образовании соединений бора. Возбужденный атом бора обладает тремя неспаренными электронами – одним s-электроном и двумя p-электронами. Из трех орбиталей образуются три эквивалентные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120˚ друг к другу (рис. 2.10.). Действительно, как показывают экспериментальные исследования, молекулы таких соединений бора, как BГ3 (Г-галоген), B(CH3)3 – триметилбор, B(OH)3 – борная кислота, имеют плоское строение. При этом три связи бора в указанных молекулах имеют одинаковую длину и расположены под углом 120˚.
Рис. 2.10. Перекрывание sp2-орбиталей бора и p-орбиталей хлора в молекуле BCl3 Гибридизация одной s- и трех p-орбиталей (sp3-гибридизация) характерна, например, для углерода и его аналогов – кремния и германия. В этом случае четыре гибридные sp3-орбитали расположены под углом 109˚28' друг к другу; они направлены к вершинам тетраэдра (в молекулах CH4, CCl4, SiH4, GeBr4 и др.). Валентные углы в молекулах H2O (104˚27') и NH3 (107˚48') не точно соответствуют взаимному расположению “чистых” p-орбиталей (90˚). Это обусловлено некоторым вкладом s-электронов в образование химической связи. Такой вклад есть не что иное, как гибридизация. Валентные электроны в этих молекулах занимают четыре орбитали, которые близки к sp3-гибридным. Незначительное отличие валентных углов от тетраэдрических 109˚28' объясняется тем, что гибридизация в данном случае является неполной.
Во многих молекулах центральный атом не подвергается гибридизации. Так, валентные углы в молекулах H2S, PH3 и др. близки к 90˚, т.е. образование связей происходит с участием “чистых” p-орбиталей, расположенных под прямым углом друг к другу. Ионная химическая связь Ионная химическая связь представляет собой электростатическое взаимодействие положительно и отрицательно заряженных ионов в химическом соединении. Такая связь возникает лишь в случае большой разности значений электроотрицательности атомов, например между катионами s-металлов первой и второй групп периодической системы и анионами неметаллов VI и VII групп (LiF, CsCl, K2O и др.). Например, в молекуле CsF. Здесь происходит почти полный переход электронов от электроположительного атома цезия к электроотицательному атому фтора. В результате атомы становятся ионами Cs+ и F-. Ионы притягиваются друг к другу с образованием молекулы. Ионная связь – предельный случай поляризации ковалентной связи. Ионная связь, в отличие от ковалентной связи, не обладает направленностью и насыщаемостью. Каждый ион может притягивать к себе ионы противоположного знака по любому направлению. Это объясняет отсутствие направленности. Поскольку ионная связь способна возникать в любых направлениях относительно данного иона, она не обладает насыщаемостью. Количество ионов противоположного знака, которые может притягивать к себе данный ион, определяется лишь пространственными факторами (например, площадью поверхности катиона и размерами окружающих его анионов). Вещества с ионной связью обычно обладают не молекулярной, а полимерной (кристаллической) структурой. Так как энергия ионизации больше сродства к электрону, то полного перехода электронов не происходит даже в случае пары атомов с большой разностью значений электроотрицательности. Поэтому чисто ионная связь не существует. Можно лишь говорить о доле ионности связи. Например, в кристалле NaCl эффективный отрицательный заряд атома хлора составляет 0,94 заряда электрона; таким же по абсолютной величине положительным зарядом обладает и атом натрия. Металлическая связь Атомы большинства металлов на внешнем энергетическом уровне содержит небольшое количество электронов.
Для примера рассмотрим кристаллическую решетку натрия.
Валентный электрон (3s1) может занимать одну из девяти свободных орбиталей. При сближении атомов валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую и принадлежат всем атомам. При сближении атомов валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую и принадлежат всем атомам. Согласно теории свободных электронов, в узлах решетки металла находятся положительно заряженные ионы, которые погружены в электронный «газ», распределенный по всему металлу. Таким образом, валентные электроны у металлов не локализованы. Между положительно заряженными ионами металла и нелокализованными электронами существует электростатическое взаимодействие, обеспечивающее устойчивость вещества. Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов. Поэтому элементы с чисто металлической связью (s- и р-металлы) характеризуются относительно невысокими температурами плавления и твердостью.
Наличие электронов, которые могут свободно перемещаться по объему кристалла, обеспечивает высокие электрическую проводимость и теплопроводность, а также ковкость и пластичность металлов. Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. Из-за ненапрвленности связей, сферической формы и одинакового размера ионов металлы кристаллизуются, как правило, в плотноупаованных гексагональных или гранецентрированных структурах. Водородная связь Химическая связь, образованная положительно поляризованным водородом молекулы А-Н (или полярной группы –А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью. Если водородная связь образуется между разными молекулами, она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутимолекулярной. Водородная связь между молекулами А-Н и В-R обозначается тремя точками А-Н + В-R → А-Н…В-R Водород в данном случае образует две химические связи, причем они не равноценны. Образование водородной связи обусловлен тем, что в полярных молекулах А-Н или полярных группах –А-Н поляризованный атом водорода обладает уникальными свойствами: осутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностью и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома. Атомы А и В могут быть одинаковыми, как при взаимодействии HF
но могут быть и разными, как при взаиодействии воды и фтороводорода. Энергия водородной связи возрастает с увеличением электроотрицательности и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, O или N. Несмотря на высокую электроотицательность у хлора, водородная связь –Н…Cl- относительно слабая из-за большого размера атома хлора. Длины водородных связей имеют промежуточное значение. Например, у воды длина связи О-Н – 0,096 нм, а связи О…Н – 0,177 нм.
При возникновении водородных связей образуются димеры, триммеры или полимерные структуры, например зигзагообразные структуры (HF)n или более сложные конфигурации, например у льда:
Образование межмолекулярных вдородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления и парообразования. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления. Под влиянием водородных связей изменяются химические свойства. Например, HF – слабая кислота, в то время ее аналог HCl – сильная кислота. Так как многие соединения содержат ковалентные полярные связи Н-О и H-N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах. Например, практически все соли образуют кристаллогидраты, в которых имеются водородные связи. Важную роль водородные связи играют в белках, у кторых спиральные полимерные стуктуры объединяются связями N-H…O. Двойные спирали нуклеиновых кислот соединяются межмолекулярными водородными связями N-H…N и N-H…O. Строение твердого тела Твердые вещества могут находиться в аморфном или кристаллическом состоянии.
Таблица 2.4. Различия между аморфными и кристаллическими телами
Из аморфных веществ наиболее известно стекло, поэтому аморфное состояние еще называют стеклообразным. В аморфном соотоянии также могут находиться многие полимеры, смолы, простые вещества (Se, Si, Ag и др.), оксиды (SiO2, GeO2, B2O3 и др.), сульфаты, карбонаты, некоторые многокомпонентные неорганические соединения. Аморфные вещества изотропны, т.е. имеют одинаковые свойства во всех направлениях. Подавляющее большинство твердых тел находятся в кристаллическом состоянии, поэтому в дальнейшем будет рассмотрено лишь это состояние.
Кристаллическая решетка. Упорядоченное расположение частиц в твердом теле изображается в виде решетки, в узлах которой находятся те или иные частицы, соединенные воображаемыми линиями. Монокристаллы характеризуются анизотропностью, т.е. зависимостью свойств от напрвления в пространстве. Следует, однако, отметить, что реальные вещества поликристаллические, т.е. состоят из множества кристаллов, ориентированных по разным осям координат, поэтому в поликристаллических телах анизотропия не проявляется. 1. В узлах молекулярных решеток находятся молекулы. 2. В узлах атомных решеток находятся атомы. 3. В узлах ионных решеток находятся, чередуясь положительно и отрицательно заряженные ионы. Они связаны друг с другом силами электростатического притяжения. 4. В узлах металлических решеток находятся атомы металлов, между которыми свободно движутся общие для этих атомов электроны. Характеристики кристаллической решетки: 1. Координационное число – число частиц, непосредственно примыкающих к данной частице в кристалле. Чем больше координационное число, тем плотнее упаковка кристалла. 2. Постоянная решетки характеризует расстояние между центрами частиц, занимающих узлы в кристалле. 3. Энергия кристаллической решетки – энергия, необходимая для разрушения 1 моля кристалла и удаления частиц за пределы их взаимодействия. Если в узлах решетки находятся атомы или молекулы, то энергия решетки называется энергией сублимации. Единицей измерения энергии решетки, как и энергии химических связей, является кДж/моль. 4. Элементарная ячейка – наименьшая часть кристалла, имеющая все особенности структуры данной решетки. При многократном повторении ячейки по трем измерениям получают всю кристаллическую решетку. Имеется семь основных ячеек (рис.2.11.)
Таблица 2.5. Типы кристаллов и свойства веществ
Тип кристаллической системы определяется природой и размерами частиц, видом химических связей между ними, температурой и другими факторами. Частицы размещаются в решетке таким образом, чтобы энергия системы была минимальна. Для частиц сферической формы это достигается при максимальном координационном числе, т.е. при наиболее плотной упаковке (рис.2.12.).
Некоторые вещества близкой химической природы образуют одинаковые кристаллические структуры. Такие вещества называют изоморфными. В таких структурах частицы могут замещать друг друга, например Mg2+ и Ca2+ в Сa2SiO4 и Mg2SiO4 или К+ и Rb+, а также Al3+ и Cr3+ в квасцах KAL(SO4)2 ∙ 12H2O. При замещении даже части ионов могут изменяться свойства вещества. Например, при замещении части Al3+ в корунде Al2O3 на ионы Cr3+ прозрачные кристаллы становятся красными (рубин), а на ионы Ti3+ и Fe3+ - синими (сапфир). Многие соединения могут существовать также в двух или более кристаллических структурах. Такое явление называется полиморфизмом. В качестве примера полиморфизма можно указать существование SiO2 в виде гексагонального кварца, ромбического тридимита и кубического кристобалита. Полиморфные модификации существуют и у большинства простых веществ, в этом случае они называются аллотропными (по форме) модификациями. В качестве примера можно назвать аллотропные модификации углерода: алмаз, графит, карбин и фуллерен. Дефекты в реальных кристаллах. Реальные твердые тела не педставляют собой идеального монокристалла, простирающегося по всему объему вещества, а состоят из отдельных монокристаллов, называемых кристаллитами, сросшихся друг с другом и имеющих межкристаллитную границу раздела. Отдельные кристаллиты в свою очередь имеют несовершенства, называемые дефектами. Различают точечные, линейные и плоские дефекты.
2) Линейные дефекты структуры называются дислокациями. Простейший вид дислокации - краевая дислокация – это обрывающийся край одной из атомных плоскостей внутри кристалла. Дислокации, подобно точечным дефектам, подвижны, особенно в металлических кристаллах. 3) Плоские дефекты представляют собой комбинации большого числа точечных и линейных дефектов. Примесные дефекты обусловлены теми или иными примесями, попадающими в твердое тело при его кристаллизации. Такие примеси могут вызывать полупроводниковые свойства некоторых твердых тел с ковалентными кристаллами. Из-за наличия дефектов некоторые ионные кристаллы имеют ионную проводимость. Такие твердые вещества, обладающие ионной проводимостью, называются твердыми электролитами.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 193; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.157.62 (0.033 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Рис. 2.5. Атомная sp-гибридная орбиталь
Рис. 2.5. Атомная sp-гибридная орбиталь
 Рис. 2.6. Схема sp-гибридизации
Рис. 2.6. Схема sp-гибридизации
 Рис. 2.7. Схема sp2-гибридизации
Рис. 2.7. Схема sp2-гибридизации
 Рис. 2.8. Схема sp3-гибридизации
Рис. 2.8. Схема sp3-гибридизации

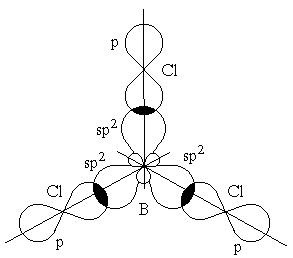






 Рис.2.13. Точечный дефект в ионном кристалле в узле решетки (а) при переходе иона в междоузлие (б)
Рис.2.13. Точечный дефект в ионном кристалле в узле решетки (а) при переходе иона в междоузлие (б)



