
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодические свойства элементов
Так как электронное строение элементов изменяется периодически, то соответственно периодически изменяются и свойства элементов, определяемые их электронным строением, такие как энергия ионизации, размеры атомов, окислительно-восстановительные и другие свойства. Размеры атомов и ионов. Вследствие волновой природы электрона атом не имеет строго определенных границ. Радиусы атомов и ионов являются условными величинами. Их обычно вычисляют из межатомных расстояний, которые зависят не только от природы атомов, но также и от вида химической связи между ними. Зависимость атомных радиусов (r) от заряда ядра (Z) имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атомов. Например, во втором периоде атомные радиусы имеют следующие значения:
Это объясняется увеличением притяжения электронов внешнего слоя к ядру по мере возрастания заряда ядра. В подгруппах сверху вниз атомные радиусы возрастают, т.к. увеличивается число электронных слоев:
Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов – к увеличению. Поэтому радиус положительного иона (катиона) всегда меньше, а радиус отрицательного иона (аниона) всегда больше, чем радиус соответствующего электронейтрального атома. Например:
Радиус иона тем сильнее отличается от радиуса атома, чем больше заряд иона:
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра:
Такая закономерность объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра. Энергия ионизации и сродство к электрону. В химических реакциях ядра атомов не подвергаются изменению, электронная же оболочка перестраивается, причем атомы способны превращаться в положительно и отрицательно заряженные ионы. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации (потенциалом ионизации) I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома с образованием катиона: X – e → X+ Энергия ионизации измеряется в кДж/моль или в электронвольтах X+ – e → X2+ Поэтому второй потенциал ионизации I 2 больше, чем первый (I 2> I 1). Очевидно, что удаление каждого следующего электрона будет требовать больших энергетических затрат, чем удаление предыдущего. Для характеристики свойств элементов обычно принимают во внимание энергию отрыва первого электрона. В группах потенциал ионизации уменьшается с увеличением атомного номера элемента:
Это связано с большей удаленностью валентных электронов от ядра и, следовательно, с их более легким отрывом по мере увеличения количества электронных слоев. Величина потенциала ионизации может служить мерой “металличности” элемента: чем меньше потенциал ионизации, тем легче удалить электрон из атома, тем сильнее выражены металлические свойства. В периодах слева направо заряд ядра возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства ослабевают:
Нарушение тенденции возрастания I наблюдается для атомов с целиком заполненным внешним энергетическим подуровнем, либо для атомов, у которых внешний энергетический подуровень заполнен ровно наполовину:
Это свидетельствует о повышенной энергетической устойчивости электронных конфигураций с полностью или наполовину занятыми подуровнями. Степень притяжения электрона к ядру и, следовательно, потенциал ионизации зависят от ряда факторов, и прежде всего от заряда ядра. Заряд ядра равен порядковому номеру элемента в таблице Менделеева., от расстояния между электроном и ядром, от экранирующего влияния других электронов. Так, у всех атомов, кроме элементов первого периода, влияние ядра на электроны внешнего слоя экранировано электронами внутренних слоев.
Поле ядра атома, удерживающее электроны, притягивает также и свободный электрон, если он окажется вблизи атома. Правда, этот электрон испытывает отталкивание со стороны электронов атома. Для многих атомов энергия притяжения дополнительного электрона к ядру превышает энергию его отталкивания от электронных оболочек. Эти атомы могут присоединять электрон, образуя устойчивый однозарядный анион. Энергию отрыва электрона от отрицательного однозарядного иона в процессе X– – e → X0 называют сродством атома к электрону (A), измеряемым в кДж/моль или 1 эВ (электронвольт) = 1,602.10-19 Дж или 96,485 кДж/моль.. При присоединении двух и более электронов к атому отталкивание преобладает над притяжением – сродство атома к двум и более электронам всегда отрицательно. Поэтому одноатомные многозарядные отрицательные ионы (O2–, S2–, N3– и т.п.) в свободном состоянии существовать не могут. Сродство к электрону известно не для всех атомов. Максимальным сродством к электрону обладают атомы галогенов. Электроотрицательность. Эта величина характеризует способность атома в молекуле притягивать к себе связующие электроны. Электроотрицательность не следует путать со сродством к электрону: первое понятие относится к атому в составе молекулы, а второе – к изолированному атому. Абсолютная электроотрицательность (кДж/моль или 1 эВ электронвольт = 1,602.10-19 Дж или 96,485 кДж/моль.) равна сумме энергии ионизации и сродства к электрону: АЭО= I + A. На практике часто применяется величина относительной электроотрицательности, равная отношению АЭО данного элемента к АЭО лития (535 кДж/моль): Электроотрицательность уменьшается сверху вниз по группе и увеличивается слева направо по периоду. Ниже приведены относительные электроотрицательности некоторых элементов:
Наибольшее значение электроотрицательности имеет фтор, наименьшее – цезий. Водород занимает промежуточное положение, т.е. при взаимодействии с одними элементами (например, с F) он отдает электрон, а при взаимодействии с другими (например, с Rb) – приобретает электрон. Окислительно-восстановительные свойства нейтральных атомов. Эти свойства определяются значениями энергии ионизации и сродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, принимающий электрон. В периоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает. В подгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается. Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями в изменении сродства к электрону. Кислотно-основные свойства соединений. Свойства оксидов и гидроксидов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным:
Сверху вниз в подгруппе при одинаковости заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидроксидов ослабевают, а основные – усиливаются:
Аналогичный пример можно привести для кислородсодержащих кислот элементов VI группы: сила кислот убывает в ряду H2SO4 серная кислота, H2SeO4 селеновая кислота, H2TeO4 теллуровая кислота. Решение типовых задач Пример 1. Определить последовательность заполнения электронами подуровней в атомах элементов, если их суммы п + l соответственно равны 4 и 5. Решение. Напишем для каждого из случаев возможные значения:
Следует иметь в виду, что разница в энергии у орбиталей Пример 2. Написать электронные формулы атомов кальция и титана. К какому семейству элементов они относятся? Решение. Кальций и титан – элементы IV периода и атомы их имеют 4 электронных слоя. У кальция (Z = 20), следующего через один элемент после аргона (Z = 18), заполняется двумя электронами подуровень
После заполнения подуровня
Кальций – s –элемент, а титан Пример 3. Написать электронные формулы атомов хрома, меди и германия. К какому семейству элементов они относятся? Решение. У элементов IV периода хрома (Z = 24) и меди (Z = 29), атомы которых имеют 4 электронных слоя, происходит, начиная от Sc, заполнение подуровня 3
Однако в действительности расположение электронов на внешних уровнях атомов этих элементов выражается соответственно формулами
Электронная формула германия имеет вид
Хром и медь относятся к семейству Пример 4. Написать электронно-графические формулы атомов бериллия и бора в нормальном и в возбужденном состоянии. Решение. Электронные формулы бериллия –
бериллий бор Такие электронные структуры соответствуют нормальному, т.е. невозбужденному, состоянию их атомов. Однако наличие на втором уровне вакантных орбиталей в подуровне
бериллий бор В таком состоянии валентность Ве и В равна соответственно двум и трем. Пример 5. Написать электронно-графические формулы атомов азота и кислорода. Решение. Электронные формулы атомов азота и кислорода:
Возможны два варианта графических формул р -подуровня:
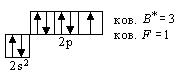
Из них обладают наименьшим запасом энергии, и, следовательно, энергетически более предпочтительны вторые варианты, отвечающие правилу Гунда, согласно которому наименьшим запасом энергии обладают атомы, у которых в пределах данного значения l электроны располагаются так, чтобы число неспаренных электронов с параллельными спинами было максимальным. Пример 6. Написать электронную формулу атома железа. Как распределяются в нем электроны d -подуровня и какова высшая валентность железа? Решение. В зависимости от значения п электроны по отдельным уровням K, L, M и т.д. распределяются в атоме железа (Z = 26) следующим образом: 2, 8, 14, 2, а электронная формула имеет вид
Энергетически наиболее выгодному распределению шести d -электронов отвечает схема
После возбуждения подуровня Пример 7. Написать электронные формулы трех последних квантовых уровней атомов церия и гадолиния. Как распределяются в них электроны подуровней Решение. Электронная формула трех последних квантовых уровней имеет для атома ксенона (Z = 54) следующий вид:
Атомы церия (Z = 58) и гадолиния (Z = 64) обладают сверх этой структуры соответственно четырьмя и десятью электронами, которые распределяются следующим образом:
1.7. Задачи для самостоятельного решения 1. Среди приведенных ниже конфигураций указать возможные и невозможные: а) 3s2; б) 2s3; в) 2d5; г) 5d2; д) 3f12; е) 6f3; ж) 1р3; з) 3р2; и) 4р4; к) 4d4; л) 3f6. Для невозможных конфигураций указать, почему они нереальны. 2. Написать электронные формулы следующих элементов: K, Cr, As, Na, Mn, Fe, Sm, Pu. По электронным конфигурациям подуровней выявить, какие из них достраиваются. Указать, к какому электронному семейству принадлежит каждый из перечисленных выше элементов. Ориентируясь на чисо электронов во внешнм слое, указать каким характером (металлическим или неметаллическим) обладают элементы. 3. Внешний электронный уровень атома некоторого элемента содержит конфигурацию 6р3. Написать полную электронную формулу элемента, подсчитать его порядковый номер, назвать элемент. 4. На примере ванадия показать применимость правила Гунда. 5. Сколько вакантных р-орбиталей содержится в электронной оболочке атома алюминия? Дать схему электронной структуры р-подуровня. 6. Объясните с помощью схем электронной структуры, почему хлор может проявлять различные степени окисления, а фтор не может. 7. Внешние и предпоследние энергетические уровни атомов имеют вид: а) 3d24S2; б) 4d105S1; в) 5S25p6 Укажите p– и d– элементы. 8. Чем объяснить способность S проявлять степени окисления 2, 4, 6? Привести схему электронной структуры атома S в нормальном и возбужденном состоянии. 9. Назовите элементы, положительные ионы которых имеют следующие электронные конфигурации: а)1s0 (Э2+); б) 1s22s0 (Э2+); в) 1s22s02p0 (Э3+); г) 1s22s22p0 (Э2+); д) 1s22s22p63s23p63d04s0 (Э4+). 10. Назовите элементы, отрицательные ионы которых имеют следующие электронные конфигурации: а) 1s22s22p6 (Э1-); б) 1s22s22p6 (Э2-); в) 1s22s22p63s23p6 (Э3-); г) [Ar]3d104s24p6 (Э3-). 11. Дать схему структуры электронных оболочек следующих частиц: а) электронейтрального атома Na и иона Na+; б) атома Al и иона Al3+; атома S и частиц с зарядом S2-; S+4; S+6. 12. Для каждого элемента 3-го периода приведите значение максимальной положительной степени окисления и возможной отрицательной степени окисления. 13. Структура внешних электронных слоев атома: а) 4s24p3; б) 5d56s2; в) 3d34s2. К каким периодам и группам относятся элементы, атомы которых содержат указанные группировки? 14. По следующим данным установить порядковый номер элемента и назвать его: Номер периода 5 6 5 4 Характерная электронная конфигурация d5 f6 p1 p3
15. Руководствуясь положением элементов в периодической системе, сделайте прогноз относительно последовательности изменения восстановительных свойств ионов: Cl-, Br-, I-. 16. Ограничившись только информацией о положении элементов в периодической системе, расположите элементы в порядке возрастания их значений электроотицательности: Cl, P, Mg, Cs, O. 17. Сделайте оценку относительной полярности химических связей Э-Н в соединениях NH3, H2O, HF, где Э = N, O, F.
ТЕМА 2. ХИМИЧЕСКАЯ СВЯЗЬ Под химической связью понимают различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и ионных веществ. К основным чертам химической связи можно отнести: а) снижение общей энергии двух- или многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована; б) перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи. К основным видам связи относится ионная, ковалентная и металлическая. В молекулах типичны следующие виды химической связи: — ковалентная; — донорно-акцепторная; — ионная. При взаимодействии молекул друг с другом возникают химические связи: — донорно-акцепторная; — некоторые разновидности ковалентной связи; — водородная. В твердом веществе возможны следующие виды химической связи: — ковалентная (атомные кристаллы); — ионная; — металлическая. Правило октета. В езультате образования химической связи атомы могут приобретать такую же электронную конфигурацию, как у благородных газов, которые (за исключением гелия) имеют на внешней оболочке восемь (октет) электронов. Стремление к созданию такой устойчивой электронной кофигурации получило название правила октета. Это справедливо как для ионной, так и ковалентной связей. Энергия и длина связи. Количество энергии, выделяющееся при образовании химической связи, называется энергией химической связи Есв. Она имеет единицу измерения кДж/моль. Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Например, энергию связи в метане определяют путем деления энергии образования молекулы СН4 из атомов водорода и углерода на четыре (1640 ׃ 4 = 410 кДж/моль). Чем больше энергия химической связи, тем устойчивее молекулы. Например, молекула HF устойчивее молекулы HBr.
Таблица 2.1. Энергия (Есв) и длины (l св) некоторых химических связей
Важной характеристикой химической связи является ее длина lсв, равная расстоянию между ядрами в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Имеется определенная корреляция между длиной и энергией связи: с уменьшением длины связи обычно растет энергия связи и соответственно устойчивость молекул (табл. 2.1.). Например, в ряду галогеноводородов от HF до HI длина связи растет, а ее энергия уменьшается. Ковалентная связь Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной связью. Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис.2.1.)
Электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы (рис. 2.2.).
Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определённым направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах и твердых телах. Полярность ковалентной связи. Если ковалентная связь образована одинаковыми атомами, например В молекулах состоящих из атомов разных элементов, связующее электронное облако оттягивается к тому из них, у которого больше значение электроотицательности. Это полярная ковалентная связь. Разность электроотицательности атомов характеризует полярность связи. В результате смещения электронной пары первый атом приобретает избыточный отрицательный заряд, а второй избыточный отрицательный заряд. Эти заряды называются эффективными зарядами атомов в молекуле δ- и δ +. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) l д друг от друга. Мерой полярности связи служит электрический момент диполя µсв, равный произведению эффективного заряда σ на длину диполя l д
Электрический момент диполя имеет единицу измерения кулон на метр (Кл · м). В качестве единицы измерения используют также внесистемную единицу измерения дебай D, равную 3,3 · 10-30 Кл · м (табл. 2.1.). Как видно и табл. 2.2, электрический момент диполя растет с увеличением разности ЭО.
Таблица 2.2. Электрический момент диполя химической связи в молекулах
Полярную ковалентную связь с δ, приближающемуся к 1, можно считать ионной связью. Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности. Сигма-связь. Как уже говорилось, ковалентная химическая связь характеризуется направленностью, что обусловлено определенными ориентациями атомных орбиталей (АО) в пространстве. Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ-связью.
Кратные связи. Кроме простых σ-связей существуют кратные (двойные и тройные) связи, которые образуются при наложении σ-, π- и δ-связей. Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью.
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью. Соответственно, s-элементы могут образовывать только σ-связи, р-элементы - σ- и π-связи, d-элементы - σ-, π- и δ-связи, а f-элементы - σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей. При наложении π-связи на σ-связь образуется двойная связь, например в молекулах кислорода, диоксида углерода. Кратная связь изображается двумя черточками: О=О, О=С=О. Хотя энергия π-связи меньше, чем энергия σ-связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи (табл. 2.1.). Число связей между атомами называется кратностью связи. В некоторых молекулах и ионах, содержащих двойные связи, π-связи являются делокализованными, т.е. охватывающими не два атома, а часть или целые молекулы или ионы. Донорно-акцепторный механизм образования ковалентной связи. Донорно-акцепторная связь - разновидность ковалентной связи. Если одна из двух молекул имеет атом со свободными орбиталями, а другая – атом с парой неподеленных электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например у иона аммония Азот молекулы аммиака, имеющий три ковалентные связи с тремя атомами водорода по обменному механизму, имеет неподеленную пару электронов
которая может взаимодействовать со свободной орбиталью иона водорода Н+, образуя четвертую ковалентную связь:
Четвертая ковалентная связь, образованная по донорно-акцепторному механизму, характеризуется теми же параметрами, что и остальные три ковалентные связи, образованные по обменному механизму, т.е. в ионе аммония все четыре связи равноценны. Ковалентная связь по донорно-акцепторному механизму образуется при взаимодействии многих атомов, ионов и молекул. Например,
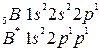 
Атом азота отдает на связь пару электронов, а атом бора – вакантную орбиталь.
В полученном соединении суммарные валентности бора и азота равны 4. Аналогичным путем образуется комплексное соединение Атом, предоставляющий электронную пару, называется донором, а атом, представляющий свободную орбиталь называется акцептором. Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, называются комплексными или координационными соединениями. Донорно-акцепторная связь обладает такими же свойствами, как и ковалентная связь: насыщаемостью и направленностью. Валентность – общее число химических связей, которые образуют один атом элемента в молекуле определенного соединения. Ковалентность – определяют по общему числу ковалентных и донорно-акцепторных связей, которые образует один атом элемента в молекуле.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 67; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.218.230 (0.141 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
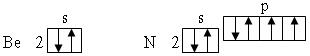
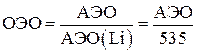
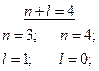



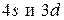 сравнительно невелика, благодаря чему последовательность заполнения
сравнительно невелика, благодаря чему последовательность заполнения  может быть нарушена (см. Cr и Cu). Различие энергетических состояний, по-видимому, еще меньше в случае
может быть нарушена (см. Cr и Cu). Различие энергетических состояний, по-видимому, еще меньше в случае  (см. Nb, Mo, Ru, Rh, Pd, Ag) и особенно
(см. Nb, Mo, Ru, Rh, Pd, Ag) и особенно  (см. лантаноиды).
(см. лантаноиды). . Электронная формула кальция
. Электронная формула кальция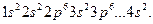
 и поэтому электронная формула титана, атомный номер которого на 2 единицы больше, чем у кальция, имеет вид:
и поэтому электронная формула титана, атомный номер которого на 2 единицы больше, чем у кальция, имеет вид:
 -элемент.
-элемент. и поэтому следовало бы ожидать, что их формулы будут иметь вид
и поэтому следовало бы ожидать, что их формулы будут иметь вид
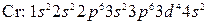

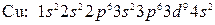
 и
и  , что объясняется провалом одного из электронов подуровня
, что объясняется провалом одного из электронов подуровня  на подуровень
на подуровень  . Атом германия (Z = 32) содержит сверх электронной структуры аргона (Z = 18) 14 электронов, заполнение которыми происходит в такой последовательности:
. Атом германия (Z = 32) содержит сверх электронной структуры аргона (Z = 18) 14 электронов, заполнение которыми происходит в такой последовательности:

 и бора -
и бора -  могут быть представлены структурами:
могут быть представлены структурами:
 делает возможным возбуждение этих электронов до
делает возможным возбуждение этих электронов до  и
и  , а их структуры имеют следующий вид:
, а их структуры имеют следующий вид: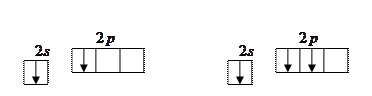
 и
и  .
.
 .
.
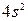 и перехода одного s -электрона на подуровень 4 р общее число непарных электронов равно 6, что и соответствует высшей валентности железа.
и перехода одного s -электрона на подуровень 4 р общее число непарных электронов равно 6, что и соответствует высшей валентности железа. ?
? .
.

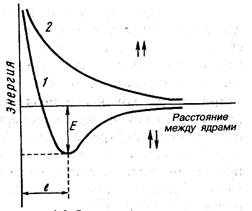 Рис. 2.2. Зависимость энергии систем из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами. Е – энергия связи
Рис. 2.2. Зависимость энергии систем из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами. Е – энергия связи
 , то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью.
, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью.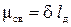
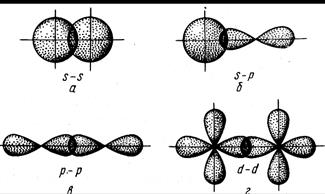 Рис. 2.3. Перекрывание атомных орбиталей при образовании σ-связей
Рис. 2.3. Перекрывание атомных орбиталей при образовании σ-связей
 Рис. 2.4. Перекрывание атомных орбиталей при образовании π-связей
Рис. 2.4. Перекрывание атомных орбиталей при образовании π-связей
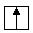
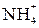 атом азота образует четыре ковалентные связи с водородом, хотя у атома азота всего три неспаренных электрона.
атом азота образует четыре ковалентные связи с водородом, хотя у атома азота всего три неспаренных электрона.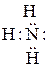 ,
,

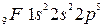




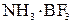 – комплексное соединение
– комплексное соединение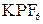 при взаимодействии
при взаимодействии  и
и 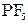 , которое записывается
, которое записывается  .
.


