Окончание табл. 6.3
| 1 | 2 | 3 | 4 | 5 | 6 | |||||||
| Печорский длиннопламенный, ДР, Д, отсев жирный, ЖР, Ж, промпродукт |
16,87
20,77 |
18,20
21,85
|
17,91
21,51 |
17,90
21,55 | 7,73 21,34 | |||||||
| Кузнецкий Угли подземной добычи: длиннопламенный, ДР, ДСШ |
21,90
|
23,10
|
22,85
|
22,95
|
22,76
| |||||||
| слабоспекающийся, СС2СССШ, СС2ССР | 25,33 | 26,34 | 26,04 | 26,20 | 26,00 | |||||||
| Угли открытой добычи: длиннопламенный, ДР слабоспекающийся, СС2ССР | 21,39 26,04 |
22,58 27,07 |
22,34 26,77 |
22,36 27,09 |
22,19 26,86 | |||||||
|
Жидкое топливо | ||||||||||||
| Газогенераторная сланцевая смола | 38,49 | 40,82 | 39,33 | 41,08 | 39,66 | |||||||
| Камерная сланцевая смола | 37,14 | 38,99 | 37,73 | 39,07 | 37,86 | |||||||
| Мазут, Ф5 Ф12 | 41,93 41,57 | 44,59 44,18 | 43,22 42,70 | 45,56 45,24 | 44,20 43,76 | |||||||
| Мазут саратовский, М40 М100 | 40,15 39,60 | 42,85 42,11 | 39,94 39,07 | 44,23 43,08 | 41,37 40,09 | |||||||
| Мазут уфимский, М40 | 40,35 | 42,99 | 39,90 | 43,81 | 40,77 | |||||||
Таким образом, применение химической энергии и эксергии топлив для анализа эффективности использования энергии в энергетических и технологических процессах и установках позволит существенно скорректировать наши представления о достигнутых уровнях КПД различных технических систем.
Глава 7. РАСЧЕТЫ ГОРЕНИЯ ТОПЛИВА.
Материалы для выполнения практических и самостоятельных работ
Целью расчетов является определение показателей, характеризующих условия сжигания топлива заданного состава, теплоты его сгорания, количества и состава образующихся продуктов сгорания, максимальной температуры горения (жаропроизводительность) топлива и др.
Все расчеты по определению перечисленных величин могут быть выполнены по данным элементарного анализа участвующих в процессе горения веществ на основании стехиометрических соотношений соответствующих химических уравнений. Например, уравнение
|
|
С + О2 = СО2 + ∆ Hr
помимо качественного описания процесса горения дает строгую количественную его характеристику.
На основании законов о постоянстве массовых отношений, закона Гесса о независимости теплового эффекта реакции от пути ее реализации и промежуточных процессов, законов сохранения материи и энергии можно утверждать, что образование 1 моля (44 г) двуокиси углерода требует расходования 1 моля (12 г) углерода и 1 моля (32 г) кислорода. При этом процесс сопровождается выделением тепла в количестве 97650 кал.
Подобные уравнения, описывающие процесс окисления отдельных элементов (компонентов) топлива, и являются основой метода расчета названных выше характеристик.


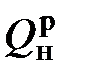
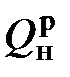 и
и