
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая энергия и эксергия природного газа разных месторождений
Все рассматриваемые ниже методы определения химической энергии и эксергии технических топлив базируются на описании процесса их горения в атмосфере чистого кислорода или воздуха реакцией
Т + O2® CO2 + (H2O)г,ж + SO2 + NOx. (6.9)
В термохимии описание энергетики процесса обычно осуществляется через энтальпии образования участвующих в реакции веществ:
где Энтальпии образования продуктов реакции, входящие в первую сумму уравнения (6.10), в общем случае известны или могут быть установлены. Вторая же сумма неизвестна из-за незнания в большинстве случаев энтальпии образования топлив. На практике это затруднение, как правило, преодолевается, поскольку для основной массы топлив экспериментально устанавливаются величины Используя понятие химической эксергии вещества энергетику процесса горения можно описать выражением
где
Таким образом, в уравнении (6.11) первая сумма неизвестна из-за незнания величины химической энергии топлива, а вторая в общем случае может быть установлена по составу продуктов горения. Причем, если химическая энергия всех продуктов горения равна нулю, то
где j – индекс компонента продуктов горения с ненулевой химической энергией. Аналогичное сопоставление можно сделать, рассматривая, как соотносятся энергия Гиббса и эксергия в процессе горения топлив:
и
где Из анализа выражений (6.12) и (6.13) вытекает важный вывод, что величина Специалистами разных стран предложен целый ряд методик для расчета химической энергии и эксергии с неоднородной структурой. Они, как правило, базируются на одном подходе, в соответствии с которым некоторые устойчивые соотношения, установленные между различными характеристиками однородных органических веществ, затем переносятся на технические топлива с неизвестной структурой. Поскольку каждый из авторов, проводя исследования, опирался на данные о топливах собственной страны, на свою статистическую выборку однородных органических веществ, неудивительно, что полученные ими расчетные выражения, а, следовательно, и рассчитанные на их основе значения существенно различаются. Пользователям этих методик без соответствующих предварительных исследований непросто отдать предпочтение какой-либо из них.В целях облегчения выбора наиболее пригодных расчетных соотношений для определения химической энергии и эксергии технических топлив нами проведено сопоставление нескольких методик.
З.Рант первым предложил использовать для этих целей метод аналогий по отношению к однородным органическим топливам, для которых значения указанных величин могут быть рассчитаны [20]. После вычисления химической эксергии многих однородных органических топлив он рассчитал отношение их эксергии к теплоте сгорания и определил средние значения этого соотношения отдельно для жидких и газообразных топлив. Предположив, что данные соотношения справедливы и для неоднородных технических топлив, З.Рант рекомендовал следующие формулы для определения значений:- химической эксергии жидкого топлива, в молекуле которого содержится более одного атома углерода,
- химической эксергии газообразного топлива, в молекуле которого содержится более одного атома углерода,
Твердое топливо, по мнению Ранта, допустимо рассматривать как смесь горючих элементов C, Sи свободного водорода, который остается избыточным после связывания всего кислорода в виде (H2O)ж. Считая, что химическая эксергия элементов C, H и S незначительно отличается от теплоты их сгорания, и приравнивая нулю эксергию содержащейся в топливе воды, он получает следующую формулу для каменных и бурых углей:
Я.Шаргут и Т.Стырыльска [22] сделали попытку уточнить формулу Ранта путем более полного учета химического состава топлив. Ими были получены корреляционные формулы, выражающие зависимость между отношением нормальной химической эксергии к теплоте сгорания и числами, характеризующими химический состав топлива. В качестве таких чисел приняты массовые соотношения H/C, O/C, N/C и S/C.Полученное корреляционное уравнение может быть использовано при рассмотрении однородных органических веществ, для которых неизвестны значения абсолютных энтропий. Для органической части технических топлив выведены отдельные формулы. При использовании аппроксимирующего уравнения для технического топлива основное значение имеет точность определения свободного члена и коэффициентов при H/C и O/C. Используя разработанную методику для сухого органического вещества топлив с малой степенью окисления (каменный и бурый угли, кокс, торф), авторы получили следующее уравнение:
Эта формула относится к сухому органическому веществу, не содержащему в своем составе серу ( Полученная авторами формула для расчета химической эксергии технического твердого топлива (на рабочую массу) имеет вид:
где Для вычисления эксергии жидких технических топлив авторы предложили следующую формулу:
Химическую энергию технических топлив авторы предлагают рассчитывать по выражению
где Нужно отметить, что уровень отсчета по Шаргуту ниже уровня отсчета по Ранту на величину «остаточной» (нулевой) химической эксергии. Для вычисления ее значения предлагаются достаточно сложные расчетные выражения и не всегда убедительные исходные посылки и допущения. Возможно, одной из главных причин, по которой не все специалисты воспринимают эту составляющую, является то, что ее значение в большинстве случаев лежит в пределах точности определения основных термодинамических констант, используемых для расчета химической энергии и эксергии. Попытки разработать методы для оценки химической энергии и эксергии топлив были предприняты еще целым рядом авторов: Н.Д.Захаровым [3], В.Бойе [17], В. Фратшером и Д.Шмидтом [18]. Интересное исследование по оценке химической энергии и эксергии материалов, имеющих сложное химическое строение, провели американские ученые Ши и Фан [21]. Они предложили эмпирические формулы для определения удельной химической энтальпии b0 и эксергииe0 таких материалов. Авторы предположили, что 1 кг горючей массы топлива, имеющей формулу
где индексы m, n, p, q, r и t - число атомов элементов C, H, N, O, галогенов X и S соответственно в 1 моле горючей массы топлива. В соответствии с материальным и энергетическим балансами процесса горения и принятыми значениями удельной химической энергии участвующих в реакции веществ авторы [21] получили формулы для расчета химической энергии топлива для двух случаев: когда теплота сгорания определена экспериментально и когда она неизвестна. Для второго случая авторы предположили, что все горючие составляющие топлива (углерод, азот, водород, сера и галогены) представлены в своих элементарных состояниях и что их свойства аддитивны. Аналогичные расчетные формулы получены авторами и для эксергии топлив. При этом Ши и Фан использовали известное соотношение
При сопоставительном анализе нами осуществлена корректировка уравнений для расчета химической энергии и эксергии топлив, полученных Ши и Фаном. Эту корректировку необходимо было выполнить, чтобы все методики привести к единой информационной базе. Суть внесенных нами поправок заключается в том, что при выводе расчетных формул мы использовали собственные значения химической энергии и эксергии веществ, содержащихся в топливе и образующихся при его сгорании [8]. По этой причине коэффициенты в полученных нами уравнениях для определения химической энергии и эксергии топлив отличаются от значений, приведенных в [21]. Для случая, когда величина
При проведении расчетов по формулам (6.21) и (6.22) нами так же, как и авторами [21], принималось Для топлив, калориметрические характеристики которых были неизвестны, значения химической энергии и эксергии определялись соответственно по выражениям:
Здесь буквы в квадратных скобках обозначают массовые доли элементов; Следует отметить, что в этой методике расчет энтропии выполняется не совсем корректно. Поэтому нами предложено использовать ее в сочетании с более совершенным методом расчета энтропии, описанным в [19]. В нем для оценки энтропии топлив предложены эмпирические соотношения, также полученные на основе статистической обработки соответствующих характеристик однородных органических веществ. Причем для твердых топлив предложенное соотношение рекомендовано применять только к их органической части, а влияние минеральной части и влаги учитывать дополнительно. Ниже кратко излагается эта методика. На основе статистической обработки энтропий для 80 чистых органических веществ авторами [19] установлены константы и получены следующие выражения для расчета энтропии: - жидких технических топлив
- твердых технических топлив
где Как отмечалось выше, уравнение (6.26) рекомендуется авторами для оценки энтропии только органической части твердых топлив. Выражение для расчета энтропии рабочего топлива с учетом влияния серы
Для оценки
которая может быть определена на основе данных о его химическом составе. Предположив, что молекулы в топливе одинаковы, энтропию смешения можно найти по выражению
где R - универсальная газовая постоянная, равная 8,314 Дж/ (моль × К); Предварительный анализ позволяет сделать следующие выводы. Методика Ши-Фана имеет преимущество перед методиками З.Ранта, Я. Шаргута и Т. Стырыльской, Н.Захарова, которое состоит в том, что она позволяет расчетным путем найти значения химической энергии и эксергии топлив, для которых калориметрические характеристики экспериментально не установлены. Эта методика имеет и другое важное достоинство: она дает возможность более точно учитывать химический состав топлив, в частности наличие в них галогенов. Необходимо отметить еще одно важное преимущество методики Ши-Фана по сравнению с другими, рассмотренными в настоящем разделе. Эта методика позволяет в явном виде находить такую важную характеристику, как энтропия топлива. Наши исследования показывают, что ее значение колеблется в пределах 1,5-3,8 кДж/ (кг×К) для твердых и от 5,2 до 8,3 кДж/ (кг×К) для жидких. Это позволяет сделать вывод о том, что предложение Бэра принимать энтропию технических топлив равной ~1,0 кДж/ (кг×К) [2] может приводить к существенным ошибкам в расчетах. Сопоставление рассмотренных методик и получаемых по ним значений химической энергии и эксергии твердых и жидких топлив позволило нам отдать предпочтение комбинированной методике, в которой расчет химической энергии осуществляется по методике Ши-Фана, а расчет эксергии ведется с использованием значений энтропии топлив, определяемых по методике Икуми-Луо-Вэна. На основе этой комбинированной методики нами проведены массовые расчеты и установлены значения химической энергии и эксергии твердых и жидких топлив, применяемых в стране. В результате этой работы сформирована база таких важнейших характеристик топлив, как их низшая теплота сгорания, энтропия, химическая энергия и эксергия, которые могут широко использоваться при проведении всевозможных энергетических и термодинамических расчетов [10]. В качестве примера в табл. 6.3 приведены результаты расчётов химической энергии и эксергии твёрдых и жидких топлив для случаев, когда для них определены высшая и низшая теплоты сгорания либо эти показатели отсутствуют. Таблица 6.3
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 80; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.111.183 (0.066 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


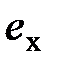
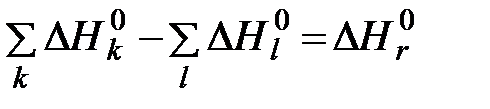 , (6.10)
, (6.10)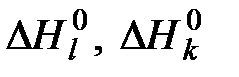 - стандартные энтальпии образования веществ, соответственно вступающих в реакцию (индекс l) и получаемых в результате реакции (индекс k);
- стандартные энтальпии образования веществ, соответственно вступающих в реакцию (индекс l) и получаемых в результате реакции (индекс k); 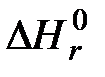 - стандартная теплота реакции горения.
- стандартная теплота реакции горения.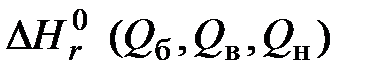 .
. , (6.11)
, (6.11) - химическая энергия веществ, соответственно вступающих в реакцию горения и получаемых в результате нее.
- химическая энергия веществ, соответственно вступающих в реакцию горения и получаемых в результате нее.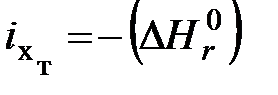 . В остальных случаях, определяя химическую энергию топлива, к теплоте горения необходимо прибавить значение химической энергии продуктов горения, не полностью энергетически обесцененных, т.е.
. В остальных случаях, определяя химическую энергию топлива, к теплоте горения необходимо прибавить значение химической энергии продуктов горения, не полностью энергетически обесцененных, т.е. ,
,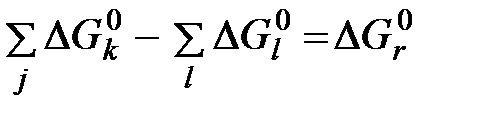
 (6.12)
(6.12)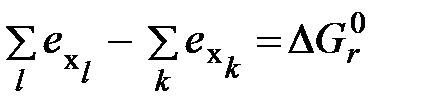 ,
, 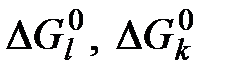 - стандартная энергия Гиббса образования исходных (индекс l) и конечных (индекс k) веществ реакции горения;
- стандартная энергия Гиббса образования исходных (индекс l) и конечных (индекс k) веществ реакции горения;  - соответственно химическая эксергия исходных и конечных веществ реакции;
- соответственно химическая эксергия исходных и конечных веществ реакции; 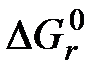 - стандартная энергия Гиббса реакции горения.
- стандартная энергия Гиббса реакции горения.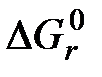 экспериментально для топлив не определяется. Следовательно, определение эксергии технических топлив на основе экспериментально установленного значения энергии Гиббса реакции горения невозможно, поэтому необходимо искать другие способы.
экспериментально для топлив не определяется. Следовательно, определение эксергии технических топлив на основе экспериментально установленного значения энергии Гиббса реакции горения невозможно, поэтому необходимо искать другие способы.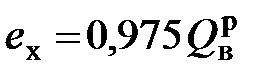 ; (6.14)
; (6.14)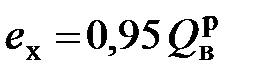 . (6.15)
. (6.15)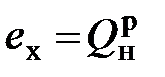 . (6.16)
. (6.16)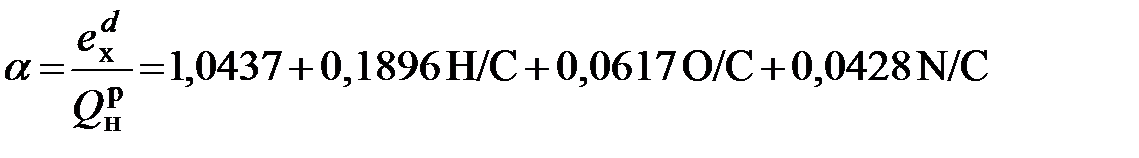 (6.17)
(6.17)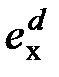 - удельная эксергия этого вещества).
- удельная эксергия этого вещества).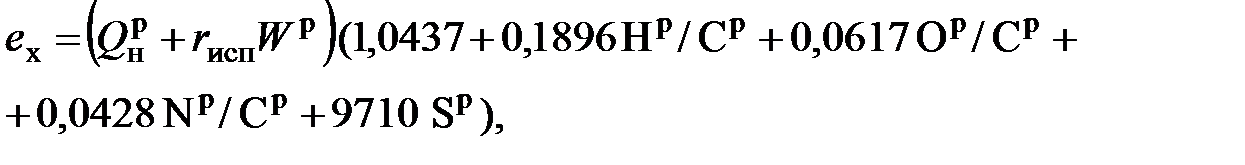 (6.18)
(6.18) - теплота испарения влаги;
- теплота испарения влаги; 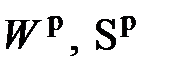 - массовое содержание влаги и серы в топливе;
- массовое содержание влаги и серы в топливе; 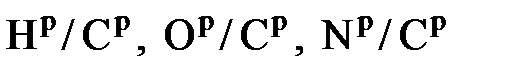 - отношения массовых долей водорода, кислорода и азота к доле углерода.
- отношения массовых долей водорода, кислорода и азота к доле углерода. (6.19)
(6.19) (6.20)
(6.20) - масса диоксида серы, получаемого при сгорании содержащейся в топливе серы;
- масса диоксида серы, получаемого при сгорании содержащейся в топливе серы; 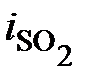 - энтальпия девальвации (химическая энергия) SO2 (введена в формулу, поскольку продукт сгорания серы не является полностью обесцененным).
- энтальпия девальвации (химическая энергия) SO2 (введена в формулу, поскольку продукт сгорания серы не является полностью обесцененным).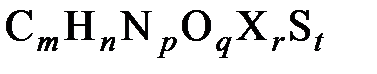 , вступает в реакцию горения и полностью сгорает:
, вступает в реакцию горения и полностью сгорает:
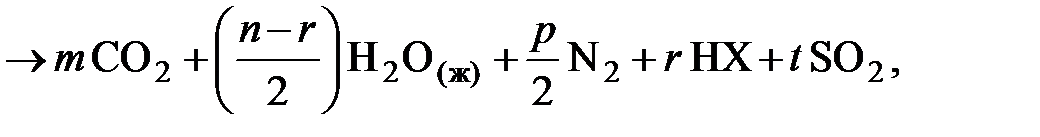
 , а также предположение о том, что энтропия топлива равна сумме энтропий составляющих его элементов и золы. В этом выражении
, а также предположение о том, что энтропия топлива равна сумме энтропий составляющих его элементов и золы. В этом выражении  - изменение энтропии в реакции горения при стандартных условиях (T 0 = 298,15 К, p 0 = 101,325 кПа).
- изменение энтропии в реакции горения при стандартных условиях (T 0 = 298,15 К, p 0 = 101,325 кПа).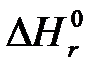 установлена экспериментально, расчеты проводились по выражениям:
установлена экспериментально, расчеты проводились по выражениям: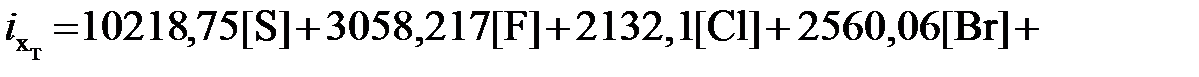
 (6.21)
(6.21) (6.22)
(6.22) .
. (6.23)
(6.23)
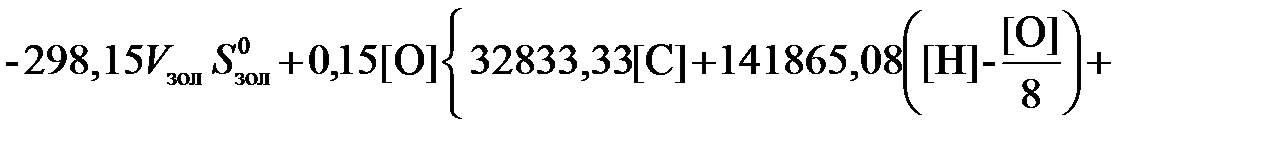 (6.24)
(6.24)
 - масса золы в 1 кг топлива;
- масса золы в 1 кг топлива;  - удельная энтропия золы.
- удельная энтропия золы.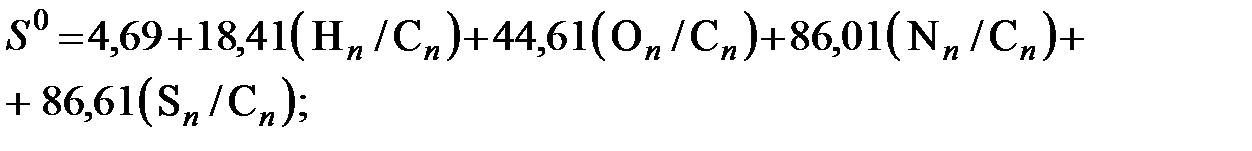 (6.25)
(6.25)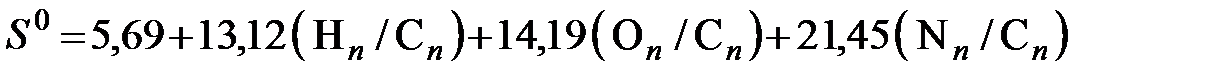 , (6.26)
, (6.26)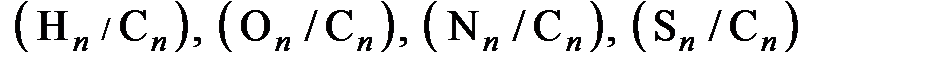 - отношения числа молей водорода, кислорода, азота и серы соответственно к числу молей углерода в органической массе топлива.
- отношения числа молей водорода, кислорода, азота и серы соответственно к числу молей углерода в органической массе топлива.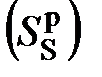 , пирита
, пирита 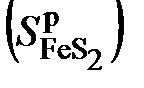 , золы
, золы  , влаги
, влаги 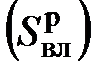 , а также энтропии смешения
, а также энтропии смешения  представлено суммой
представлено суммой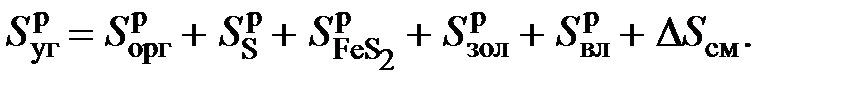 (6.27)
(6.27)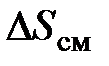 принимается молекулярная формула угля следующего вида:
принимается молекулярная формула угля следующего вида: (6.28)
(6.28)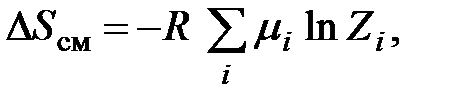 (6.29)
(6.29) - массовый коэффициент групп (типов), составляющих молекулу топлива;
- массовый коэффициент групп (типов), составляющих молекулу топлива; 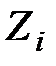 - мольная доля типов.
- мольная доля типов.


