
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эксергия химических элементов
О том, что некоторые вещества являются источниками энергии, известно с давних времен. Это, в первую очередь, различные виды топлива – дрова, каменный и бурый угли, торф, сланцы, нефть, природный газ. Химическая энергия топлива оценивается его теплотой сгорания, что отражает проявление потенциальной химической энергии топлив в процессе горения. Установлено, что многие вещества обладают химической энергией, иногда не меньшей, чем у некоторых топлив, но проявляется и, следовательно, используется она не через горение, а, как правило, в результате осуществления процессов иного рода. Таким образом, очень многие вещества несут в себе некоторый потенциал энергии, но чтобы его рационально использовать, необходимо знать природу данного вида энергии и законы ее преобразования в другие формы при осуществлении всевозможных технологических процессов. С проявлением химической энергии неэнергетического сырья и материалов приходится сталкиваться специалистам разных отраслей промышленности – химической, металлургической и т.д. Очевидно, что этот вид энергии оказывает существенное влияние на принципы построения технологий переработки того или иного природного сырья, на технико-экономические, в том числе энергетические, характеристики рассматриваемого производства, и это обстоятельство должно учитываться как при разработке новых процессов, так и при анализе существующих. Понимая важность учета качества и состава исходного сырья при определении расходных характеристик, энергетических КПД рассматриваемых технологических процессов, специалисты разрабатывают различные новые способы и понятия. К последним относятся понятия химической энергии и эксергии вещества, которые впервые ввел и предложил методы их определения польский ученый Я.Шаргут [14]. Сущность предложенного им метода вычисления химической энергии (энтальпии девальвации) веществ заключается в следующем.
Для каждого элемента нужно установить вещество отсчета (субстанцию отнесения) – энергетически полностью обесцененное вещество, содержащееся при нормальных условиях в окружающей среде (ОС). После этого для каждого элемента составляется уравнение реакции отнесения (реакции девальвации), т.е. реакции для идеализированного процесса приведения рассматриваемого элемента в состояние принятого для него вещества отсчета. В данной реакции кроме рассматриваемого элемента участвуют только вещества отсчета всех присущих ей химических элементов. Те из них, которые участвуют в реакции как исходные, называются дополнительными веществами, а включенные в правую часть уравнения, относящуюся к продуктам, результирующими веществами отсчета. Изменение энтальпии в реакции девальвации Я.Шаргут назвал энтальпией девальвации и отнес к рассматриваемому элементу, т.е. принял ее за величину химической энергии этого элемента
где Аналогично изменение энтропии в ней было названо энтропией девальвации где Подобным же образом Я.Шаргут находит свободную энтальпию девальвации
где Значение последней из названных величин может быть определено и на основании двух первых, поскольку между ними имеется следующая зависимость:
где Аналогичным образом могут быть найдены значения химической энергии, энтропии девальвации и свободной энтальпии девальвации для химического соединения. Реакции девальвации для них можно получить сложением соответствующих реакций для содержащихся в них элементов. Однако суммирование тепловых эффектов при этом недопустимо, так как суммарное значение термодинамических функций химического соединения не является суммой значений соответствующих функций входящих в него элементов. В специальной справочной литературе [1, 4, 5, 11, 12] имеются значения стандартной теплоты (энтальпии), свободной энергии (изобарного потенциала) образования однородных химических веществ, их абсолютной энтропии, которые служат для расчета обсуждаемых величин. Однако процедуру определения значений i, s, и e для химических соединений можно упростить, если предварительно определить указанные характеристики для элементов и простых веществ. В этом случае значения энтальпии девальвации (
где При вычислении значений химической энергии и эксергии сложных веществ заданного состава и структуры предполагается, что не совершив большой ошибки, их можно рассматривать как механические смеси. Тогда располагая удельными значениями химической энергии и эксергии соединений (элементов), входящих в состав рассматриваемого вещества, можно рассчитать аналогичные характеристики для последнего по выражениям:
где В настоящее время существует несколько методик расчета химической энергии и эксергии элементов. В дальнейших расчетах используются величины этих показателей, полученные по методике, описанной в [8]. Она основана на использовании таких термодинамических характеристик, как теплота и энергия Гиббса образования водных растворов, энтальпия и свободная энтальпия образования ионов в водных растворах, а также стандартные электродные потенциалы. Полученные значения химической энергии и эксергии элементов приведены в табл. 6.1. Таблица 6.1
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 89; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.168.16 (0.006 с.) |
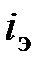 :
: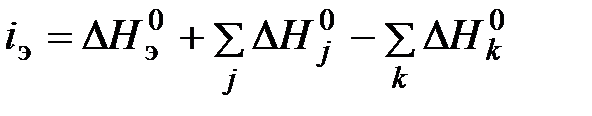 , (6.1)
, (6.1)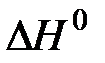 - стандартная теплота образования, т.е. изменение энтальпии при реакции образования соответственно рассматриваемого элемента и вещества отсчета из простых веществ в стандартном состоянии (
- стандартная теплота образования, т.е. изменение энтальпии при реакции образования соответственно рассматриваемого элемента и вещества отсчета из простых веществ в стандартном состоянии (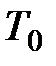 =298,15 К, или 25,15°С;
=298,15 К, или 25,15°С; 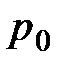 = 101,325 кПа): j, k – индексы соответственно дополнительного и результирующего веществ отсчета.
= 101,325 кПа): j, k – индексы соответственно дополнительного и результирующего веществ отсчета.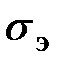 :
: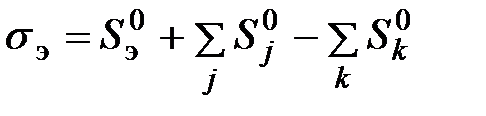 , (6.2)
, (6.2)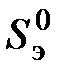 - абсолютная энтропия рассматриваемого элемента в стандартном состоянии;
- абсолютная энтропия рассматриваемого элемента в стандартном состоянии; 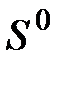 - то же для веществ отсчета.
- то же для веществ отсчета.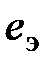 :
: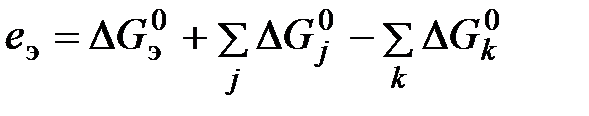 , (6.3)
, (6.3)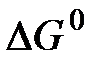 - стандартная свободная энергия образования, т.е. изменение изобарного потенциала при реакции образования вещества отсчета из простых веществ в стандартном состоянии.
- стандартная свободная энергия образования, т.е. изменение изобарного потенциала при реакции образования вещества отсчета из простых веществ в стандартном состоянии.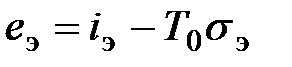 , (6.4)
, (6.4)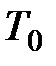 - абсолютная температура, характеризующая стандартное состояние.
- абсолютная температура, характеризующая стандартное состояние.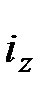 ) и свободной энтальпии девальвации (
) и свободной энтальпии девальвации (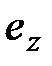 ) какого-либо соединения могут быть найдены по выражениям
) какого-либо соединения могут быть найдены по выражениям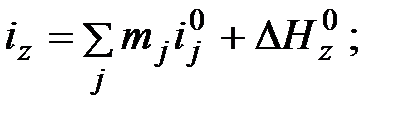 (6.5)
(6.5)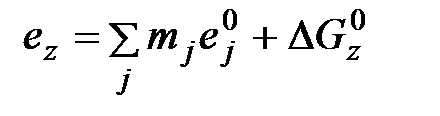 , (6.6)
, (6.6) - соответственно энтальпия девальвации j- го элемента (простого вещества), входящего в состав вещества z;
- соответственно энтальпия девальвации j- го элемента (простого вещества), входящего в состав вещества z; 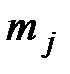 - мольная масса j – го элемента;
- мольная масса j – го элемента; 
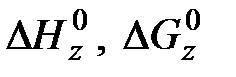 - соответственно стандартная теплота образования и стандартная свободная энергия образования вещества z.
- соответственно стандартная теплота образования и стандартная свободная энергия образования вещества z.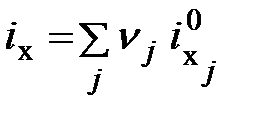 ; (6.7)
; (6.7)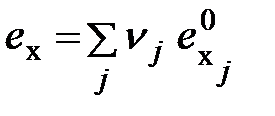 , (6.8)
, (6.8)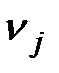 - доля j -го химического элемента или соединения в единице рассматриваемого вещества (газа);
- доля j -го химического элемента или соединения в единице рассматриваемого вещества (газа); 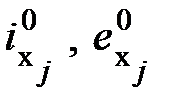 - соответственно удельная химическая энергия и эксергия j -го элемента или соединения.
- соответственно удельная химическая энергия и эксергия j -го элемента или соединения.


