
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энтропийная (тепловая) T - S -диаграммаСодержание книги
Поиск на нашем сайте Сжатие реального газа сопровождается изменением его объема, давления и температуры. Соотношение между этими параметрами при давлении не более 106 н/м 2 ( ~10 am) характеризуется уравнением состояния идеальных газов. При давлениях более 106 н/м2 (p > 10 am) следует пользоваться уравнением Ван-дер-Ваальса или другим уравнением более точно описывающим зависимость между объемом, давлением и температурой газа при повышенных давлениях. Процессы сжатия газа наглядно могут быть изображены на энтропийной, или тепловой, диаграмме Т–S (рис. 7-28). На оси ординат этой диаграммы откладывается абсолютная температура (Т), по оси абсцисс – энтропия (S). Как известно из термодинамики, энтропия представляет собой некоторую функцию состояния тела, которая увеличивается при подводе к нему тепла, причем это увеличение тем меньше, чем выше температура тела. Приращение энтропии при подводе тепла q дж/кг составляет при обратимом процессе
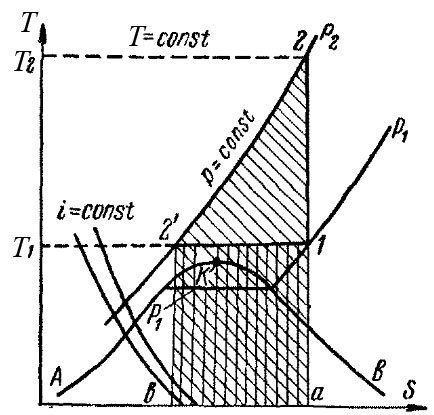
На Т – S диаграмме нанесены линии, соответствующие постоянному давлению (изобары), и линии, соответствующие постоянной температуре (изотермы), которые изображаются горизонтальными прямыми. Линия АКВ является пограничной кривой. Область, лежащая ниже этой кривой, соответствует влажному пару, ветвь АК – жидкости при температуре насыщения, ветвь КВ – сухому насыщенному пару. Точка К является критической точкой. Слева от ветви АК находится область жидкости, справа от ветви КВ – область перегретого пара. Так как испарение и конденсация жидкости протекают при постоянных температурах и давлениях, то в области влажного пара изобары совпадают с изотермами. Конденсация смеси влажных паров протекает при переменной температуре, поэтому в таких случаях изобары в области влажного пара не совпадают с изотермами. Кроме того, на Т–S – диаграмме (рис. 7-28) нанесены линии постоянной энтальпии (i = const). Энтальпия идеальных газов зависит только от температуры, и для таких газов линии i = const совпадают с изотермами. Энтальпия реальных газов зависит также от давления и для них линии i = const не совпадают с изотермами. Процессы сжатия газа в компрессоре изображаются на диаграмме Т–S следующим образом. При адиабатическом сжатии q = 0, следовательно по формуле (7-31) ∆S = 0, т.е. процесс идет без изменения энтропии (S = const). Поэтому процесс изображается вертикальной линией 1–2, причем точка 1 характеризует состояние газа до сжатия и лежит на пересечении изобары p 1 и изотермы T 1; точка 2 отвечает состоянию газа после сжатия и лежит на изобаре, соответствующей давлению p 2.
Рис. 7-28 – Диаграмма T – S процесса сжатия газа
При изотермическом сжатии процесс протекает при T =const и изображается горизонтальной линией 1–2' причем точка 2', характеризующая состояние газа после сжатия, лежит на изобаре p 2. Количество отводимого тепла q, согласно формуле (7-31), составляет T∆S и на рис. 7-28 выражается площадью заштрихованного прямоугольника а–1–2'–b, высота которого равна T 1, а основание – изменению энтропии ∆S. В данном процессе энтропия уменьшается, т.е. величина ∆S отрицательна. Поэтому количество тепла будет также отрицательным, т.е. процесс сопровождается, как указывалось выше, отводом тепла. Та же площадь а–1–2'–b выражает работу изотермического сжатия в тепловых единицах, а площадь а–2–2'–b на рис. 7-28 равна работе адиабатического сжатия.
Уравнения состояния газа
Рассмотрим четыре процесса сжатия - изотермный, адиабатный, политропный и изобарный, наблюдаемые в идеальном компрессоре, в котором процесс всасывания газа и выталкивания его из цилиндра после окончания процесса сжатия протекает при р = const. В основу описаний конкретных процессов сжатия газов положено уравнение состояния идеального газа Клапейрона: где р, v, Т - давление, удельный объем и температура сжимаемого газа; R - газовая постоянная. Уравнение (9.28) с точностью, достаточной для анализа, можно применить для описания параметров процесса сжатия при давлениях не свыше 10 МН/м2, т. е. наиболее распространенных в практике нефтедобычи и нефтехимии. Изотермный процесс сжатия газов характеризуется постоянством температуры в процессе, для которого Т = const, и, следовательно, dT = 0. В этом случае уравнение (9.28) имеет вид т. е. отвечает закону Бойля - Мариотта. Линии 1 - 2 процесса, соответствующие изотермному сжатию газов в координатах р - v и Т- s, приведены на рис. 9.2, а, б.
а - в координатах р - v; б - в координатах Т- а Рисунок - 9.2 Изотермный процесс сжатия газа
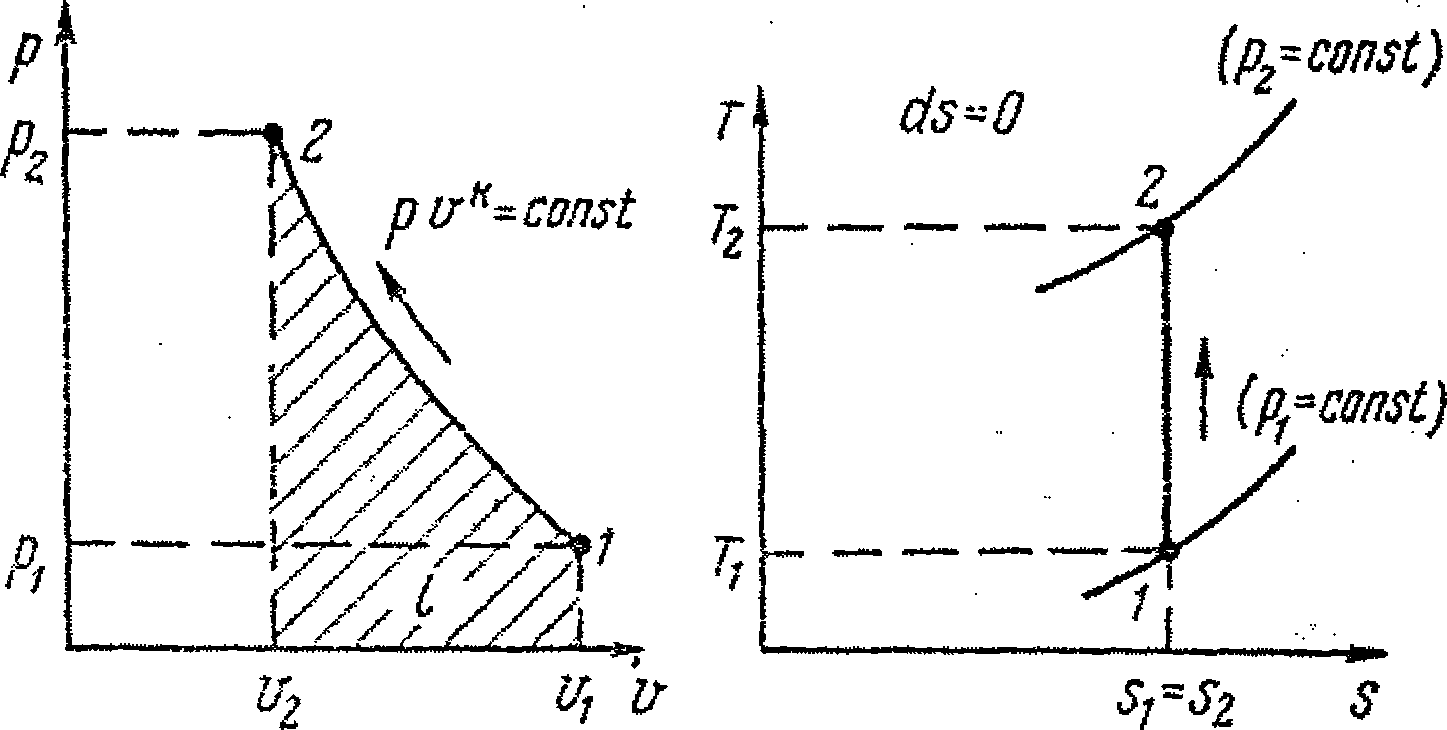
Адиабатным называется процесс сжатия газов, который протекает в теплоизолированной системе. В этом процессе отсутствует отвод тепла, выделяющегося при сжатии газов, т. е. Поскольку энтропия процесса ds = dq / T , то при адиабатном процессе сжатия газов ds = 0, т. е. s = const, т. е. вся механическая энергия сжатия затрачивается на приращение внутренней энергии.
а - в координатах р - v; б - в координатах Т - s Рисунок - 9.3 Адиабатный процесс сжатия газа
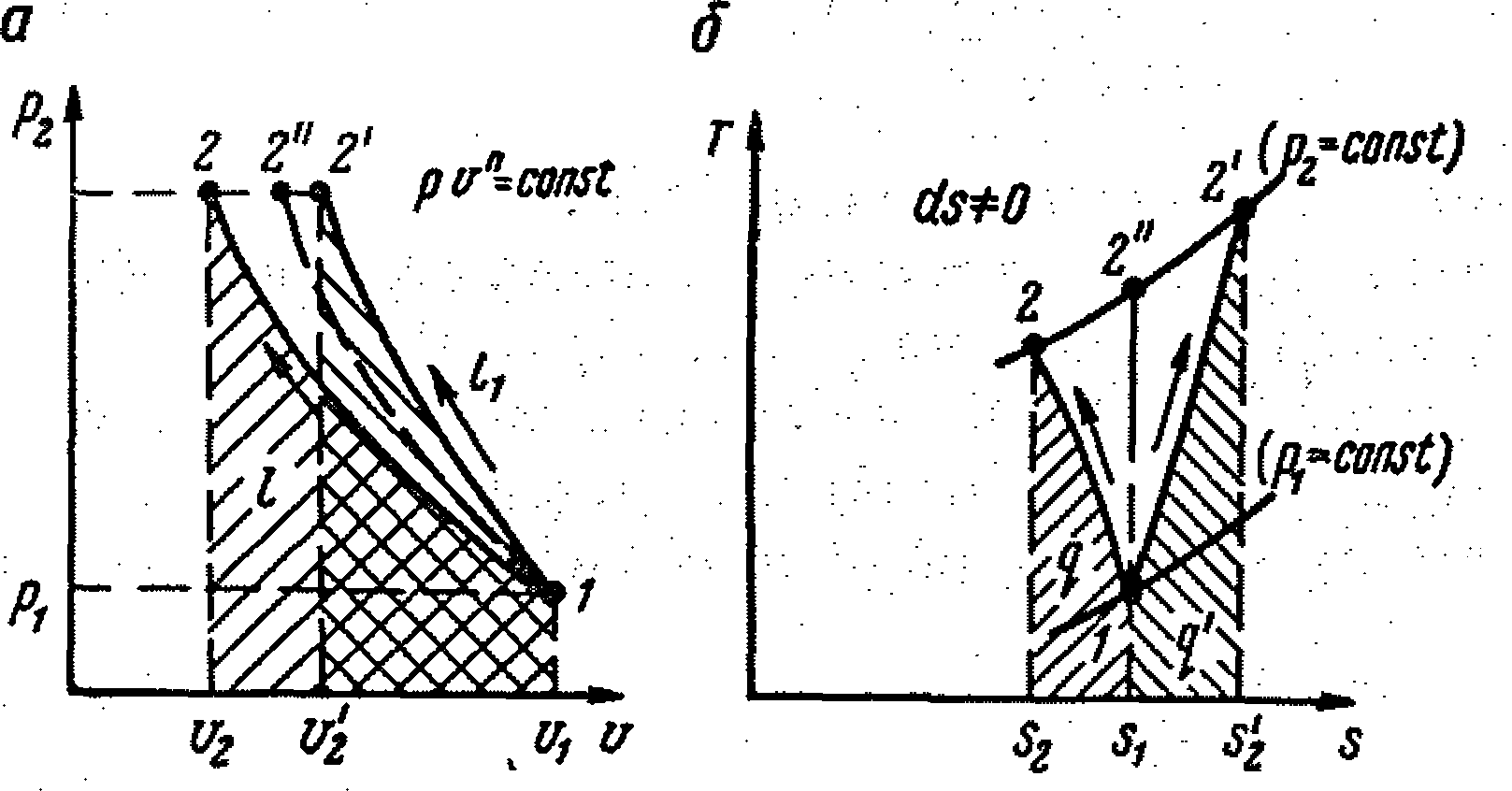
Линии 1-2 адиабатного процесса сжатия газа в координатах р-v и Т-s приведены на рис. 9.3, а, б. Ранее было указано, что термическая работа (выделенное тепло) dq = Td =0, а величина к = cp / cv называется показателем адиабаты. Реальные процессы при работе компрессоров не являются адиабатными, так как в процессе сжатия имеется теплообмен, т. е. dq Подобные процессы сжатия газов называются политропными. По аналогии с адиабатным процессом уравнение состояния политропного процесса pvn = const (9.48) является уравнением политропы, в котором число п называется показателем политропы. Таким образом, чтобы найти показатель политропы, надо определить р и v для каких-либо двух точек процесса. Политропный процесс сжатия газа (рис. 9.4, а, б) может быть осуществим как с отводом тепла (процесс компримирования в обычных компрессорах).
а - в координатах p - v; б - в координатах Т -s; 1-2 - при п < к; 1 - 2' - при п = к Рисунок 9.4 - Политропный процесс сжатия газа
при п < к, так и с подводом тепла (работа холодильных компрессоров на некоторых режимах) при п > к. Как видно из рис. 9.4, политропный процесс сжатия газа при п < к приводит к уменьшению энтропии (q < 0), а при п > к - к росту энтропии (q > 0). В идеальном компрессоре процесс заполнения цилиндра компрессора газом, а также вытеснение из цилиндра газа после окончания процесса сжатия должен производиться при постоянных давлениях р 1 и р 2. Если рассмотреть уравнение состояния (9.28), то изобарный процесс будет соответствовать закону Гей-Люссака: так как R / p = const. На рис. 9.5, а, б в координатах р - v и Т - s проведена линия изобарного процесса. Как видно из рис. 9.5, работа, затрачиваемая на сжатие газа, Собственно сжатия как такового, т. е. повышения давления газа, в этом случае нет. Есть просто процесс вытеснения газа, т. е. приведение объема
а - в координатах p - v; б - в координатах Т - s Рисунок - 9.5. Изобарный процесс сжатия газа
к объему Величина уменьшения энтропии, аналогично (9.51), равна: где ср - средняя изобарная теплоемкость за время процесса. При этом количество тепла
Таким образом, если за общее уравнение состояния принять уравнение политропного процесса (9.48), то уравнения рассмотренных выше процессов будут являться его частными случаями: при n = к для адиабатного процесса; при n = 1 для изотермного процесса; при п = 0 для изобарного процесса. Компрессоры проектируются и выпускаются с определёнными показателями (характеристиками) работы, которые должны удовлетворять условиям их применения. К ним относятся: производительность компрессора Q в м3/с; развиваемый напор (давление) р в Н/м2; потребляемая мощность N в кВт; коэффициент полезного действия
|
||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 1169; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

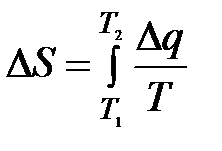 дж/кг∙град
дж/кг∙град
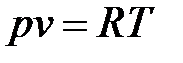
 , (9.28)
, (9.28) , (9.34)
, (9.34)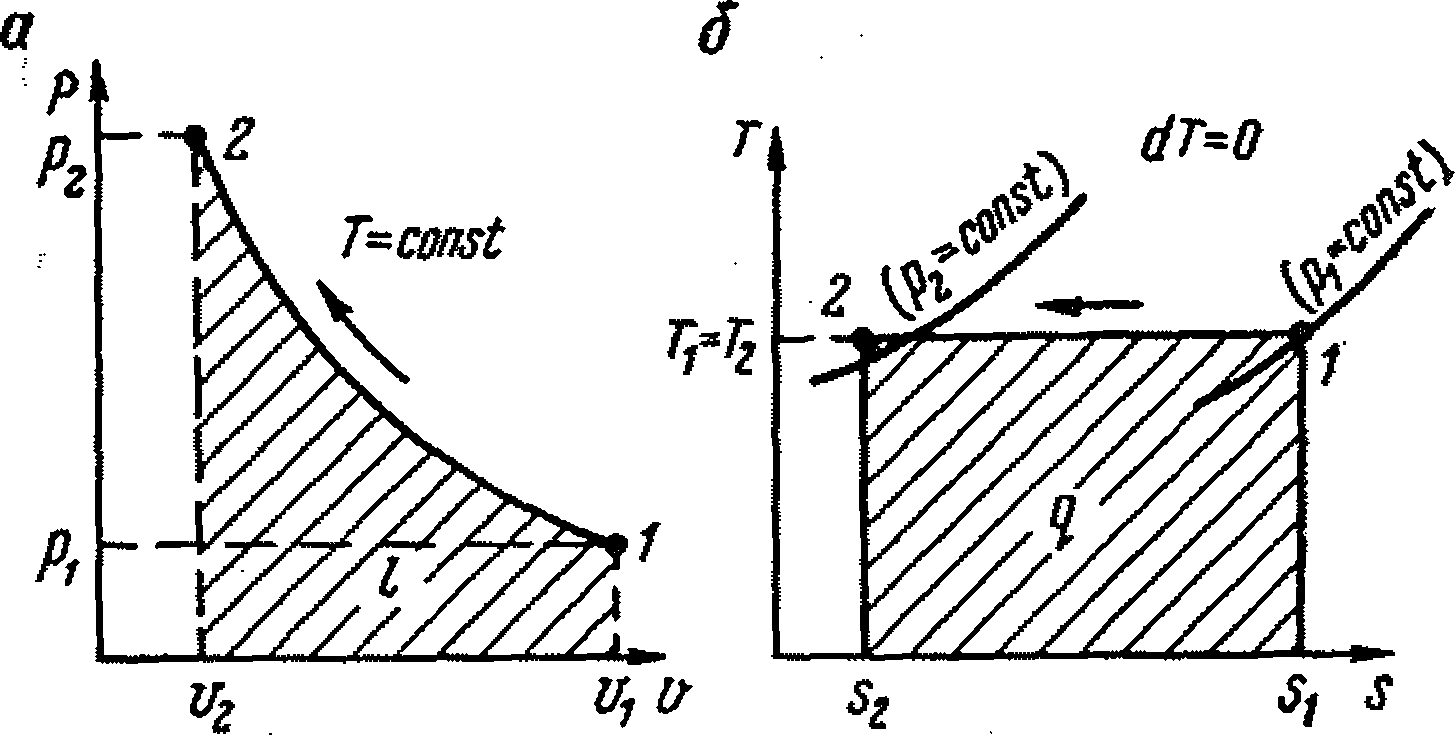
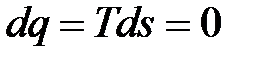
 0. Однако степень охлаждения не такая, чтобы осуществлялось изотермное сжатие, т. е. d Т
0. Однако степень охлаждения не такая, чтобы осуществлялось изотермное сжатие, т. е. d Т 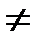 0.
0.
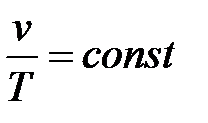 (9.52)
(9.52)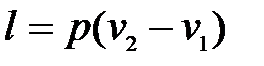 (9.53)
(9.53)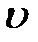 2
2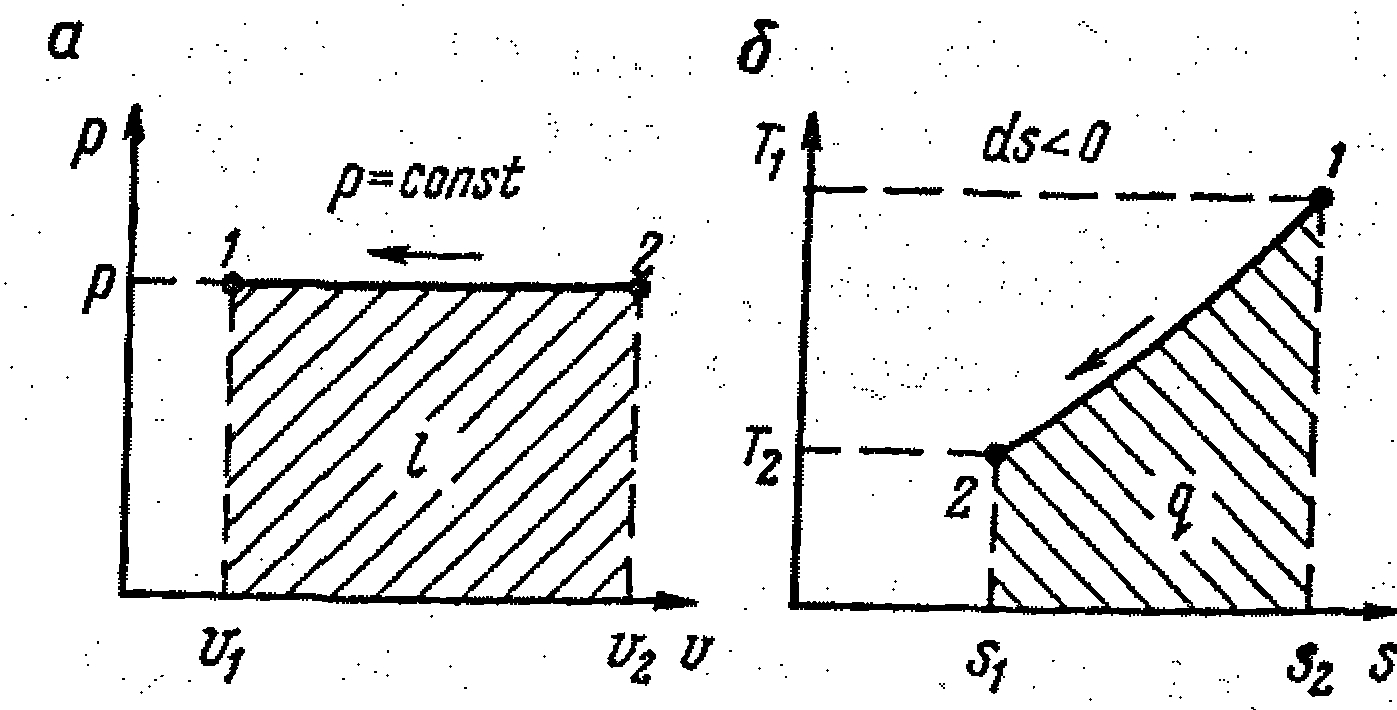
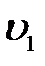 при постоянном давлении. Процесс идет в этом случае в сторону уменьшения энтропии системы.
при постоянном давлении. Процесс идет в этом случае в сторону уменьшения энтропии системы.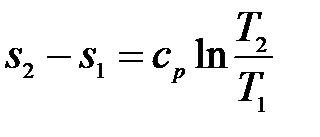 (9.54),
(9.54),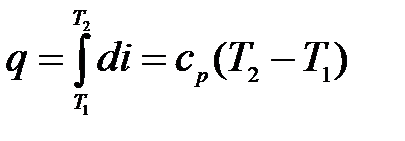 .
.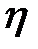 в %; степень сжатия
в %; степень сжатия 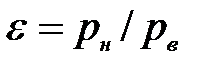 ; температура компримирования t в °С.
; температура компримирования t в °С.


