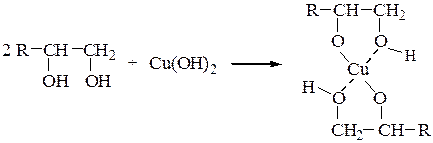Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 4.1 Гидролиз хлорзамещенных углеводородов
Реактивы, материалы, приборы: хлороформ; дихлорэтан; 10%-й раствор гидроксида натрия; 1%-й раствор нитрата серебра; азотная кислота (1:2); пробирки; водяная баня; капельницы. В две пробирки наливают по 1 см3 10 %-го раствора гидроксида натрия и добавляют: в первую – 0,5 см3 хлороформа, во вторую – 0,5 см3 дихлорэтана. Смесь нагревают на водяной бане при 60 ºС в течение 10 мин, подкисляют разбавленной HNO3 (1:2), добавляют по 2-3 капли 1%-го раствора нитрата серебра. В условиях опыта гидролиз происходит не полностью, часть исходного вещества остается без изменения. Образуются соответственно этиленгликоль и формиат натрия:
С lCH2CH2Cl + 2NaOH ¾ ® Н OCH2CH2OH + 2NaCl CHCl3 + 4 NaOH ¾ ® HCOONa + 3NaCl + 2H2O
Наблюдение:
Выводы:
Опыт 4.2 Различная реакционная способность хлорбензола
Реактивы, материалы, приборы: хлорбензол; хлористый бензил, 10%-й раствор гидроксида натрия, 1%-й раствор нитрата серебра, азотная кислота (1:2), пробирки, водяная баня, капельницы.
В две пробирки наливают по 1 см3 10%-го раствора гидроксида натрия, в одну добавляют 0,5 см3 хлорбензола, а в другую – 0,5 см3 хлористого бензила. Нагревают на водяной бане при кипении в течение 10 мин, подкисляют разбавленной HNO3 (1:2) и добавляют по 2-3 капли 1%-го раствора нитрата серебра. Отмечают образование хлорида серебра в пробирке с хлористым бензилом и отсутствие осадка в случае хлорбензола.
AgNO 3 + NaCl ¾ ® AgCl ↓ + NaNO 3
Наблюдение:
Выводы:
Опыт 4.3 Образование и гидролиз алкоголятов
Реактивы, материалы, приборы: этанол, металлический натрий, фенолфталеин, пробирки, капельницы, пробка с газоотводной трубкой, мерные пробирки.
В сухую пробирку наливают 2 см3 этанола, вносят кусочек (не более размера горошины) очищенного от оксидной пленки металлического натрия. Пробирку закрывают пробкой с газоотводной трубкой, конец которой оттянут. Через 1-2 мин после начала реакции осторожно поджигают выделяющийся водород. После окончания реакции (в пробирке не должно быть натрия!) добавляют 1,5-2 см3 воды и 1-2 капли фенолфталеина. Наблюдают образование малиновой окраски раствора, что доказывает наличие его щелочной среды.
2R–OH + 2Na ¾ ® 2R–ONa + H2 ↑ R–ONa + H2O ¾ ® R–OH + NaOH
Наблюдение:
Выводы:
Опыт 4.4 Реакция многоатомных спиртов с
Реактивы, материалы, приборы: этанол, этиленгликоль, глицерин, маннит, 1%-й раствор сульфата меди, 10%-й раствор гидроксида натрия, пробирки, мерные пробирки.
Гидроксид меди (II) получают смешиванием 3 см3 1%-го раствора сульфата меди с 3 см3 10%-го раствора гидроксида натрия. Он образуется в виде студенистого светло-голубого осадка. Его разливают в четыре пробирки. В первую пробирку добавляют 1 см3 этанола. Растворения и изменения окраски гидроксида меди (II) не происходит. Во вторую и в третью пробирки добавляют по 1 см3 этиленгликоля и глицерина, а в четвертую – 0,5 г кристаллического маннита. Многоатомные спиртырастворяют свежеприготовленный осадок Cu(OH)2 c образованием темно-синих растворов комплексных соединений меди (II) хелатного типа:
Наблюдение:
Выводы:
|
|||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 153; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.154.103 (0.005 с.) |