Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Краниоцеребральная гипотермия в остром периодеСтр 1 из 11Следующая ⇒
КРАНИОЦЕРЕБРАЛЬНАЯ ГИПОТЕРМИЯ В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА
14.01.20 – анестезиология и реаниматология
ДИССЕРТАЦИЯ на соискание ученой степени кандидата медицинских наук
Научный руководитель: доктор медицинских наук, профессор Бутров А.В.
Москва – 2018 ОГЛАВЛЕНИЕ Введение 3 Глава 1 1.2. Обзор литературы 9 1.2.1. Методика терапевтической гипотермии 9 1.2.2. Механизм действия гипотермии 12 1.2.4. Терапевтическая гипотермия при поражениях ГМ 15 Глава 2 Материалы и методы 25 Глава 3 Результаты собственных исследований. 3.1. Доклинический этап исследования. Исследование со здоровыми добровольцами 42 3.2.1. Термомониторинг 44 3.2.2. Влияние КЦГ на гемодинамику и кислородно – транспортную функцию крови 46 3.2.3. Влияние КЦГ гомеостаз КОС и ВЭБ 51 3.2.4. Нутритивная поддержка 55 3.2.5. Влияние КЦГ на неврологический дефицит и степень инвалидизации 59 3.2.6. Осложнения и летальность 64 4. Заключение 66 5. Выводы 70 6. Список работ, опубликованных по теме диссертации 71 7. Список сокращений 73 8. Список используемой литературы 75
ВВЕДЕНИЕ Актуальность проблемы Согласно данным Федеральной службы государственной статистики инсульт является одной из основных причин смерти и инвалидизации среди россиян. Так, в 2013 году, причинами смерти у 55% погибших являлись кардиоваскулярные заболевания, в том числе цереброваскулярные болезни - 16,9% [14]. При этом успехи в терапии данного заболевания весьма символичны. «Золотым стандартом» лечения инфаркта головного мозга являются методики реканализации, однако данные методы терапии резко ограничены по причинам позднего обращения больных за медицинской помощью. Известно, что за каждую минуту без лечения погибает почти 2 млн нейронов, повреждается 14 млрд синапсов и более 12 км миелинизированных волокон [112], в связи с чем время от начала клинической симптоматики заболевания до оказания специализированной медицинской помощи играет основополагающую роль в исходе данного заболевания. Требуется усиление мер как по профилактике возникновения инфаркта головного мозга, так и в обучении и улучшении информированности населения о симптомах ОНМК, и мерах, которые требуется принять для улучшения прогноза и неврологического исхода у больных. Следует упомянуть и тот факт, что реперфузия не менее пагубна для нейрона, чем сама ишемия, провоцируя развитие каскада патологических реакций [44]. При этом до сих пор нет препаратов с доказанным нейропротективным эффектом [118]. В России также отмечают значительные трудности в реабилитации данных пациентов, как на ранних этапах заболевания, так и на поздних. Терапевтическая гипотермия показала себя, как действительно перспективный метод нейропротекции [7, 12, 15, 16]. В эффективности терапевтической гипотермии (ТГ), в том числе и нормотермии, при СЛР и у новорожденных с гипокисчески-ишемической энцефалопатией у большинства специалистов нет сомнений. Применение методик ТГ при ишемическом инсульте с целью защиты зоны пенумбры, как и при проведении реканализации, кажется оправданным, однако остается много вопросов и споры об эффективности не прекращаются. В связи с чем все исследователи призывают к проведению клинических испытаний для обеспечения достоверной доказательной базы [6,7,91].
Учитывая определенные ограничения в применении методик общего охлаждения, смещение акцента в сторону применения локальной краниоцеребральной гипотермии является весьма перспективным, как в связи с относительной простотой методики, так и вследствие возможности более глубокого и безопасного охлаждения головного мозга.
Цель исследования
Улучшить результаты лечения пациентов с ишемическим инсультом путем проведения КЦГ в остром периоде.
Задачи исследования 1. Исследовать температурный баланс ГМ при КЦГ в остром периоде ишемического инсульта. 2. Исследовать влияние КЦГ на параметры гемодинамики и кислородно-транспортную функцию. 3. Исследовать влияние КЦГ на КОС и ВЭБ. 4. Исследовать влияние КЦГ на энергетические потребности организма. 5. Исследовать влияние КЦГ на уровень неврологического дефицита у пациентов в остром периоде ишемического инсульта и на степень инвалидизации в отдаленном периоде (3 мес и более). 6. Разработать алгоритм проведения КЦГ в комплексе со стандартной терапией ишемического инсульта в остром периоде с целью оптимизации лечения больных. Научная новизна 1. Выявлено, что КЦГ в остром периоде снижает риск развития центральной церебральной гипертермии. 2. Установлено, что КЦГ снижает СВ у пациентов с ИИ. КЦГ уменьшает потребление кислорода, увеличивает рvO2 с одновременным снижением артериовенозной разницы рО2. 3. Показано, что КЦГ не вызывает нарушений КОС и ВЭБ. 4. Выявлено, что КЦГ снижает энергопотребности организма. 5. Доказано, что проведение КЦГ в остром периоде снижает неврологический дефицит и степень инвалидизации в отдаленном периоде ИИ. 6. Разработан алгоритм для проведения КЦГ в комплексе со стандартной терапией ишемического инсульта в остром периоде с целью оптимизации лечения больных.
Апробация работы Основные положения диссертации доложены и обсуждены на совместном заседании кафедры анестезиологии и реаниматологии с курсом медицинской реабилитации и кафедры общей патологии и патологической физиологии им. Ф.А. Фролова Медицинского института ФГАОУ ВО РУДН 21 ноября 2017 г. Материалы исследования были представлены докладами и обсуждались на научно-практических конференциях различного уровня: 7, 8 и 9 Международных научных конференциях SCIENCE4HEALTH (Москва 2016, 2017, 2018), Научно-методической конференции с международным участием «Стандарты и индивидуальные подходы в анестезиологии и реаниматологии» (Геленджик, 2017, 2018), Всероссийской конференции с международным участием «Жизнеобеспечение при критических состояниях» (Москва, 2016, 2017), VIII съезде Ассоциации анестезиологов-реаниматологов Центрального Федерального округа (Ярославль, 2017), II Съезде анестезиологов-реаниматологов Северо-Запада с участием медицинских сестер-анестезисток (Санкт-Петербург, 2017), Нейрошколе профессора А.Н. Кондратьева «Актуальные вопросы в нейроонкологии» (Санкт-Петербург, 2017 г.), совместном заседании кафедры анестезиологии и реаниматологии и кафедры общей патологии и патологической физиологии им. Ф.А. Фролова Медицинского института РУДН (21 ноября 2017 г.).
Публикации
По теме диссертации опубликовано 7 печатных работ – 2 статьи в научных рецензируемых центральных периодических изданиях, рекомендованных ВАК РФ, 5 тезисов.
Структура диссертации
Диссертация состоит из введения, обзора литературы, характеристики собственных материалов и методов исследования, результатов собственных исследований, заключения, выводов, практических рекомендаций и списка цитируемой литературы. Исследование изложено на 91 странице, иллюстрировано 2 рисунками и 29 таблицами. Список литературы представлен 135 источниками, 21 из которых – отечественные публикации.
ГЛАВА 1 Обзор литературы Доклинический этап Исследование проводили в группе здоровых лиц на клинической базе кафедры анестезиологии и реаниматологии РУДН, ГБУЗ «ГКБ №64» ДЗМ, в отделении анестезиологии-реанимации и интенсивной терапии для больных с инфарктом миокарда. Здоровым лицам проводили 1,5-часовой сеанс КЦГ. Регистрировали следующие показатели: ТКБП, Та, Тт, СВ, АД, ЧСС. Измерения проводили до сеанса КЦГ, в момент пика гипотермии (через 1,5 ч после начала сеанса, непосредственно перед снятием шлема), через 1 ч после окончания сеанса гипотермии.
Клинический этап Этап клинического исследования проводили у больных (n = 113) с инфарктом головного мозга, поступавших в первые 24 ч в отделение реанимации и интенсивной терапии для лечения больных с острым нарушением мозгового кровообращения. Больных распределяли по группам случайным образом с помощью «метода конвертов». До начала лечения проводили полное клиническое, лабораторное, инструментальное обследования. По истечении 48 ч лабораторные обследования больного повторяли. Исследование неврологического статуса проводили каждые 6 ч. Неврологический дефицит оценивали по общепринятой шкале NIHS (National Institutes of Health Stroke Scale), разработанной Американским Национальным Институтом Здоровья (табл. 1). Шкалу используют для объективизации состояния пациента с ишемическим инсультом при поступлении, в динамике процесса и исхода инсульта к 21-м сут нахождения в стационаре. Шкала содержит 15 пунктов, которые характеризуют основные функции, чаще всего нарушающиеся вследствие церебрального инсульта. Функции оценивают в баллах. Шкала отличается очевидной простотой, внутренняя согласованность и ретестовая надежность шкалы подтверждена рядом исследований (Goldstein J.C. et al., 1989). Отсутствие изменений в неврологическом статусе принимается как 0 баллов. Уровень сознания оценивали по шкале FOUR (Full Outline of Un Responsiveness). У пациентов основных подгрупп данные на момент поступления, через 6 ч после начала сеанса гипотермии, на 2-е, 3-и сутки от момента поступления и на 6-е сутки записывали в исследовательский протокол. У пациентов контрольных подгрупп записывали данные при поступлении, на 2-е, 3-и и на 6-е сутки. Далее у всех исследуемых пациентов на 90-й день от начала заболевания регистрировали степень инвалидизации по модифицированной шкале Рэнкина (табл. 3).
Таблица 1
В связи с очевидными недостатками общепринятой ШКГ при оценке пациентов с инфарктом головного мозга и отсутствием возможности оценить рефлексы ствола головного мозга или речевую реакцию у больных с ИВЛ, афазией или другими нарушениями речи, для оценки уровня сознания дополнительно использовали шкалу FOUR (табл. 2). Таблица 2 Шкала комы FOUR
Шкала комы FOUR имеет преимущества перед шкалой комы Глазго, а именно: точнее детализирует неврологический статус, распознает синдром «запертого человека» дает оценку рефлексам ствола мозга, дыхательному паттерну, выявляет различные стадии дислокации мозга. Шкала комы FOUR также предоставляет дополнительную информацию о прогнозе у больных с низким баллом по шкале комы Глазго. Вероятность внутрибольничного летального исхода выше у больных с наименьшим баллом по шкале FOUR, чем у пациентов с наименьшим баллом по шкале комы Глазго.
Таблица 3 Модифицированная шкала Рэнкина
Включенные в основные и контрольные группы были сравнимы по возрасту, исходному уровню неврологического дефицита, уровню сознания и степени инвалидизации до возникновения настоящего инфаркта (табл. 4-6). Таблица 4 Описательная характеристика групп
Таблица 5 Степень инвалидизации у пациентов до возникновения текущего инфаркта,
Таблица 6 Уровень исходного сознания, неврологического дефицита у пациентов
Сведения о локализации инфаркта головного мозга у исследуемых пациентов согласно заключениям методов нейровизуализации представлены в табл. 7. У пациентов основных и контрольных групп не выявлено достоверных отличий в локализации очагов поражений.
Таблица 7 Локализации инфаркта головного мозга у исследуемых пациентов
При поступлении у всех пациентов до получения данных компьютерной или магнитной резонансной томографии проводили термокартирование головного мозга по ранее апробированной методике. Повторное исследование ТКБП выполняли на 6-е сутки, а у пациентов с КЦГ дополнительно измеряли на пике гипотермии перед началом процедуры согревания, через 2 ч после окончания процедуры согревания. Аналогично проводили измерение Та, Тт, Тн с помощью инфракрасного термометра. У пациентов 2а и 2б групп измеряли СВ и VO2. Показатели фиксировали до КЦГ, через 6 ч КЦГ, в конце сеанса КЦГ и через два часа после окончания процедуры согревания. У всех пациентов групп 2а (n=14) и 2б (n=13), которым с первых суток проводили ИВЛ дополнительно измерялиREE и RQ согласно вышеизложенным схемам. Также у данных пациентов измеряли суточные потери белка методом определения количества мочевины и креатинина в суточной моче. Анализ проводили в день поступления, на 2, 3, 5 и 9 сутки. Фиксировали результаты анализа газового состава, КОС и ВЭБ артериальной и смешанной венозной крови, взятые до начала процедуры охлаждения, через 6 ч КЦГ, в конце процедуры охлаждения и на 6-й час согревания. Базисную терапию у больных инсультом проводили в соответствии с рекомендациями Министерства здравоохранения, она включала: — оценку и коррекцию нарушений со стороны дыхательной и сердечно-сосудистой систем; — контроль и коррекцию водно-электролитного баланса, КОС; — лечение повышенного внутричерепного давления и эпилептических приступов; — коррекцию артериального давления; — нормализацию уровня гликемии; — нормализацию температуры тела; — профилактику и своевременную диагностику инфекционных и тромбоэмболических осложнений; — раннее начало полноценного питания; — максимально раннюю вертикализацию, комплексную реабилитацию силами мультидисциплинарной бригады. Все данные по больным, за исключением фамилии, имени, отчества, контактного номера больного или родственника, записывали в клинический протокол исследования в таблицу MS Excel для дальнейшего статистического анализа.
Методики исследования Методика КЦГ КЦГ воспроизводили при помощи специальных гипотермических шлемов аппарата АТГ-01 (ООО «Центрмед-Плюс», Россия) (табл. 8), с помощью которых обеспечивали отведение теплоты от волосистой поверхности кожи головы, поддерживая температуру кожи на уровне 3-8°С по стандартной методике. Всем добровольцам и пациентам объясняли цели процедуры, возможные последствия, после чего брали письменное информированное согласие. Если вследствие тяжести состояния пациент не мог дать информированного согласия, решение о проведении КЦГ принималось консилиумом врачей. Перед началом процедуры хладоноситель (пропиленгликоль) охлаждали до минус 8°C в течение 30 мин с помощью встроенного холодильного агрегата (350-450 Вт). Далее на голову надевали одноразовую медицинскую шапочку, смоченную в воде, после чего поверх шапочки помещали резиновый шлем, который крепили на голову термоизолирующей шапкой (рис. 1). Постоянный уровень теплоотведения поддерживали управлением на основании обратной связи по заданной и реальной температуре хладоносителя в баке (t – от - 8 до 0°C), температуре шлема-аппликатора (t – от 0 до +5°C), с уставками температуры тела в аксиллярной области (Та от + 36,0 до +37,0°С) и тимпанической области (Тт – от + 32,0 до +35,0°С). Подача хладоносителя в шлемы-аппликаторы регулировалась автоматически за счет срабатывания клапанов с электромагнитным приводом. Подача хладоносителя и прекращение циркуляции (срабатывание клапанов) осуществлялась при достижении заданных значений контролируемых температур. Автоматизированная система управления выполнена на базе специализированного контроллера. При снижении Та до 36,0°С увеличивалась Тш на 5°С с целью недопущения общей гипотермии. По окончании сеанса шлем кратковременно снимали с пациента для измерения ТКБП, после чего надевали на голову больного и проводили поэтапное согревание больных в течение 24 ч с увеличением Тш на +1°С каждый час. Таблица 8 Основные технические параметры охлаждения
Рис. 1. Аппарат АТГ – 01 Методика СВЧ-термометрии Температуру головного мозга у здоровых лиц и на последующих этапах исследования у больных с ИИ регистрировали неинвазивно с помощью СВЧ-термометра РТМ-01-РЭС (Россия) (рис. 2) путем регистрации мощности собственного электромагнитного излучения глубоких тканей мозга в диапазоне 3,2-4,5 ГГЦ, что позволяло расчетным путем определить температуру коры больших полушарий (табл. 9).
Таблица 9 Основные технические характеристики Аппарата РТМ – 01 – РЭС
Проводили измерения в 9 областях в каждом полушарии, распределённых по трём линиям: 1 – 2 см латеральнее срединой линии, 2 – уровень надбровных дуг, 3 – уровень глаз (рис. 3).
Рис. 2. Неинвазивный СВЧ-термометр РТМ-01-РЭС Рис. 3. Схема проекции областей регистрации температур головного мозга
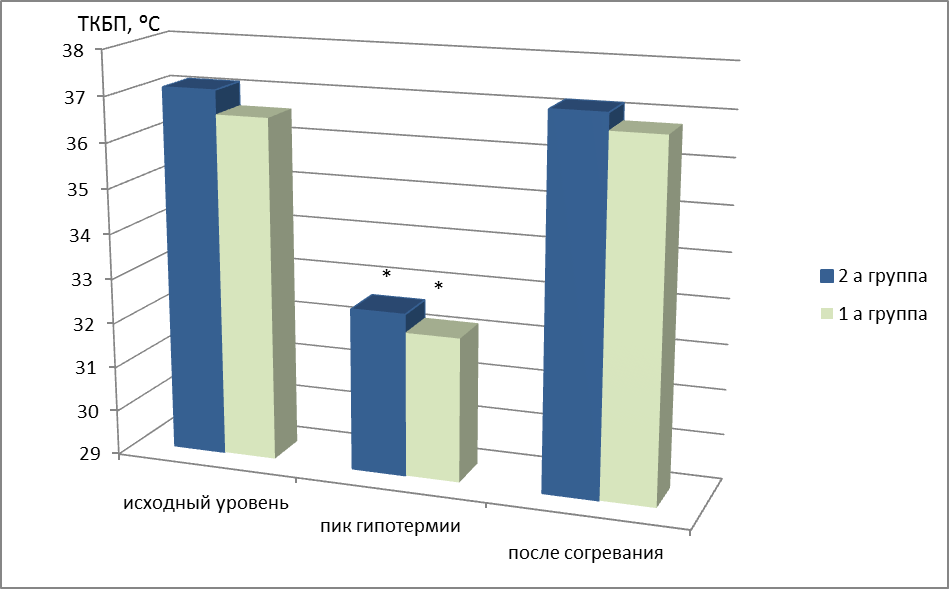
Статистические методы Полученные данные записывали в базу данных “MS Excel” (пакет офисных приложений “Microsoft Office 2010”). Каждый столбец таблицы соответствовал номеру клинического случая и определенному клиническому признаку (полу, возрасту, диагнозу, локализации поражения, а также данные NIHSS, неинвазивных температурам, температурам, измеренным в аксиллярной области и др.). Для дальнейшего статистического анализа результаты переносили в «статистический пакет для социальных наук» (SPSS 12.0 2012 г., «SPSS: An IBM Company»). С целью оценки статистической значимости различий между несвязанными выборками использовали критерий Манна-Уитни и Фишера, для связанных выборок– парный критерий Вилкоксона. Вариабельность исследуемых показателей оценивали по коэффициенту вариации (Кв). Контроль статистической значимости полученных результатов реализовывался комплексом современных статистических методов. Графическое построение статистических данных производили в программе “Microsoft Word 2010”. Термомониторинг У пациентов с ишемическим инсультом усредненные по 18 областям измерений исходные ТКБП составили: 1а – 36,59 ± 0,36⁰С; 1б – 36,74 ± 0,29⁰С; 2а – 37,02 ± 0,83 ⁰С; 2б – 37,14 ± 0,88 ⁰С. КЦГ обеспечила достоверное снижение усредненной по 18 областям измерений ТКБП (рис. 9).
Рис. 9. Динамика церебральной температуры у пациентов с КЦГ Примечание: ТКБП – температура коры больших полушарий; * - значимость различий при сравнении показателей с исходным уровнем (р<0,01).
Вариации Та демонстрировали недостоверное снижение базальной температуры от 36,67 ± 0,31 °С до 36,40 ± 0,21 °С и от 36,62 ± 0,11 °С до 36,51 ± 0,21 °С у пациентов подгрупп 2а и 1а соответственно. При выявлении общей гипертермии выше 37°С или церебральной гипертермии выше 37,5°С после процедуры согревания у пациентов основных групп принимали решение об инициации повторного сеанса КЦГ, длительностью 48 часов. У пациентов контрольных групп при выявлении общей гипотермии назначали стандартную антипиретическую терапию. СВЧ-исследование на 6-е сутки от начала заболевания выявило достоверное (р<0,05) снижение частоты центральной церебральной гипертермии у пациентов с тяжестью неврологического дефицита более 13 баллов по NIHSS, которым проводили КЦГ. Так, у 33% пациентов основных групп выявлено повышение средней ТКБП выше 37,5°С, в то время как у пациентов контрольных групп данный показатель равнялся 58%. При анализе Кв измеренных при поступлении ТКБП не выявлено статистически достоверной связи с уровнем неврологического дефицита (табл. 12).
А группа 1б группа Рис. 11. Распределение исходных ТКБП у пациентов 1а и 1б группы.
Рис. 12. Распределение исходных ТКБП у пациентов 2а и 2б группы.
Таблица 12 Корреляционная связь Кв ТКБП и тяжести неврологического дефицита
Функцию крови В 2а группе пациентов с ИИ КЦГ приводила к достоверному снижению СВ уже через 6 часов охлаждения на 15,8%, а на пике гипотермии – на 17,2% (р<0,01), VO2 снижался на 14,7 и 16,1% соответственно (р<0,01). После окончания КЦГ все показатели возвращались к исходным данным (табл. 13).
Таблица 13 Динамика СВ и VO2 у пациентов 2а группы (с КЦГ)
Примечание: СВ – сердечный выброс, VO2 – потребление кислорода; * – значимость различий при сравнении показателей с исходным уровнем, (р<0,01).
В 2б группе пациентов, которым КЦГ не проводили, отмечали спонтанное недостоверное снижение показателей на протяжении 48 часов наблюдений (табл.14). Таблица 14 Динамика СВ и VO2 у пациентов у пациентов 2б группы (без КЦГ)
Примечание: СВ – сердечный выброс, VO2 – потребление кислорода.
Важно отметить, что в группах пациентов с ИИ, которым проводили сеанс КЦГ, на всем протяжении исследования показатели АД не претерпевали сколь-нибудь заметных изменений, как и в группах сравнения. Отмечали динамику снижения ЧСС, что объясняется нарушениями ритма (фибрилляцией предсердий, со склонностью к тахикардии) у большинства пациентов всех групп при поступлении. В процессе терапии значения ЧСС были несколько снижены (табл. 15). Таблица 15 Данные физиологических показателей у исследуемых пациентов, M ± σ
Примечание: САД – среднее артериальное давление, ЧСС – частота сердечных сокращений.
В тоже время в нашем исследовании выявлено снижение СВ у здоровых и больных с ИИ при стабильной температуре тела, причем при использовании двух методов регистрации – импедансного и ультразвукового (ранее у здоровых добровольцев). Связать развитие обнаруженного нами эффекта только с действием низкотемпературного фактора вряд ли возможно. Свидетельств изменения пред- и постнагрузки, а также ЧСС и АД не отмечено. В механизмы развития данного эффекта могут быть вовлечены реакции, являющиеся следствием снижения температуры нейронов коры больших полушарий, что требует дальнейшего изучения. Также следует упомянуть, что в исследовании участвовали 2 пациента с исходной ФВ ниже 30%, у которых не отмечено столь значимого снижения СВ, в связи с чем дополнительной коррекции гемодинамики им не потребовалось. При исследовании газового состава артериальной и смешанной венозной крови в 2а группе отмечали незначительное увеличение раО2 наряду с достоверным увеличением рvО2 на 9,9% уже через 6 часов после начала сеанса КЦГ по сравнению с исходными значениями, артериовенозная разница при этом снижалась на 10,6%. В группе сравнения динамики не выявлено в течение аналогичного периода наблюдения. На момент окончания процедуры согревания отмечали снижение рvО2 на 6,5% с одновременным увеличением артериовенозной разницы на 7,2% (рис. 13-14).
Рис. 13. Динамика рО2 артериальной и смешанной венозной крови и артериовенозной разницы рО2 у пациентов 2а подгруппы.
Примечание: pvO2 – парциальное давление О2 в смешанной венозной крови, paO2 – парциальное давление О2 в артериальной крови; * - значимость различий при сравнении показателей с уровнем предыдущего измерения, (р<0,01).
Рис. 14. Динамика рО2 артериальной и смешанной венозной крови у пациентов 2б подгруппы
Примечание: pvO2 – парциальное давление О2 в смешанной венозной крови, paO2 – парциальное давление О2 в артериальной крови.
Снижение артериовенозной разницы по О2 в течение сеанса гипотермии с одновременным повышением рvO2 подтверждает снижение метаболических потребностей организма. Причем несмотря на снижение доставки О2, вызванное снижением СВ, усугубления церебральной или тканевой гипоксии не происходит, на что указывает повышение рvO2. Не выявлено достоверной динамики по уровню лактата в артериальной и смешанной венозной крови у пациентов при индукции КЦГ и в процессе согревания, что также косвенно подтверждает отсутствие гипоксии в течение сеанса КЦГ (табл. 16 и 17).
Таблица 16 Динамика уровня лактата у пациентов 2а и 2б групп, ммоль/л, M ±σ
Примечание: СВК – смешанная венозная кровь.
Таблица 17 Динамика уровня лактата у 2а группы при согревании, ммоль/л, M ±σ
Примечание: СВК – смешанная венозная кровь. Нутритивная поддержка В 2а группе пациентов с ИИ КЦГ (n=14) приводила к достоверному снижению RЕЕ через 6 часов на 17,1% и на пике гипотермии – на 18,8% (р<0,01). После окончания КЦГ все показатели возвращались к исходным значениям (табл. 22, 23). В 2б группе пациентов, которым КЦГ не проводили (n=13), достоверной динамики не было (табл. 22). Таблица 22 Динамика энергопотребностей и респираторного коэффициента
Примечание: REE–реальные энергозатраты, RQ – респираторный коэффициент; * – статистически значимые различия при сравнении параметра с исходным уровнем, (р<0,01). Таблица 23 Динамика энергопотребностей и респираторного коэффициента
Примечание: REE–реальные энергозатраты, RQ – респираторный коэффициент; * – статистически значимые различия при сравнении параметра с уровнем на момент окончания КЦГ (р<0,01).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-14; просмотров: 76; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.67.166 (0.173 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||