
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ii . Вычисление концентрации иона комплексообразователя в присутствии избыточной концентрации лиганда.Пример 3. Вычислите концентрацию ионов Со3+ в 0,30М растворе [Co(NH3)6](NO3)3, содержащем 0,2 моль аммиака. Кн=6,2·10-38 Решение: Комплексная соль диссоциирует: [Co(NH3)6](NO3)3 = [Co(NH3)6]3+ + 3NO3– [Co(NH3)6]3+ = 0,3 моль/л. Диссоциация комплексного иона и Кн: [Co(NH3)6]3+ ↔ Co3+ + 6NH3 Кн = Обозначим равновесную концентрацию ионов Co3+ через х, тогда равновесная концентрация аммиака будет равна (0,2 + 6х). Равновесная концентрация комплексного иона [Co(NH3)6]3+ равна (0,3 – х). Тогда: Кн = С учетом очень малого значения х получаем: 6,2 · 10–36 = Концентрация ионов Co3+ равна 2,9 · 10–32 моль/л.
Пример 4. К 0,20М раствору сульфата меди (II) добавили 2,0 моль аммиака. Вычислите концентрацию иона Cu2+, если в растворе образуется комплексный ион [Cu(NH3)4]2+. Решение: При добавлении аммиака к раствору сульфата меди образуется комплексный ион, концентрация которого 0,2 моль/л: Cu2+ + 4NH3 = [Cu(NH3)4]2+; диссоциация комплексного иона: [Cu(NH3)4]2+ ↔ Cu2+ + 4NH3, Кн= Примем равновесную концентрацию ионов Cu2+ за х, концентрация аммиака 4х, равновесные концентрации: [Cu(NH3)4]2+ = (0,2 – х) и [NH3] = (2 – 0,8 + х) = (1,2 + 4х). Подставим найденные равновесные концентрации в уравнение Кн= Пренебрегая малым значением х, получим:
Ответ: концентрация ионов меди (II) в растворе равна 8,1 · 10–14 моль/л.
Определение возможности разрушения комплексного иона при добавлении электролита по значениям Кн комплексного иона и ПР малорастворимого соединения. Пример 5. Выпадет ли осадок бромида серебра, если к 0,01М раствору соли Na[AgS2O3] добавить 0,001 моль бромида калия? ПРAgBr = 5,38 · 10–13. КН[ AgS2O3 ]=7,5·10-9 Решение: Диссоциация комплексного иона: [AgS2O3]– ↔ Ag+ + S2O32–; Кн = Примем концентрацию ионов серебра за х моль/л, концентрация S2O32– х моль/л, концентрация комплексного иона [AgS2O3]– = (0,01 – х) моль/л. Кн= Бромид калия — сильный электролит, концентрация ионов брома будет 0,001 моль/л. В данном растворе произведение ионов [Ag+][Br]– = 3,9 · 10–6 · 10–3 = 3,9 · 10–9 больше, чем ПРAgBr, следовательно, осадок бромида серебра выпадет. Ответ: осадок бромида серебра выпадет.
Пример 6. Вычислите растворимость хлорида серебра (моль/л, г/л) в 1 л 0,1М раствора аммиака; ПР(AgCl) = 1,8 · 10–10. Решение: AgCl(ТВ) + 2NH3= [Ag(NH3)2]+ + Cl–; Константа равновесия этой реакции КР = Выразим концентрацию ионов хлора через ПР(AgCl): [Cl–] = подставим в выражение константы равновесия (КР). Получим: КР = Кр = 3,1 · 10–3. Если растворится х моль AgCl, то концентрация ионов хлора в растворе х моль/л, концентрация [Ag(NH3)2]+ х, концентрация аммиака (0,1 – х). Подставим эти значения в выражение Кр. Кр. = поскольку х много меньше, чем 0,1, то этой величиной в разности можно пренебречь. Получим: 3,1 · 10–3 = х = 5,6 · 10–3 — это количество моль AgCl, которое растворится в 1 л 0,1М раствора аммиака. Растворимость AgCl в г/л будет составлять: 5,6 · 10–3. 143,5 = 0,80 г.
Пример 7. Сколько л 1М раствора Na2S2O3 надо взять для полного растворения 0,1 г иодида серебра? ПРAgI = 8,30 · 10–17. Решение: Растворение иодида серебра можно представить: AgI + S2O32–- = [AgS2O3]– + I–.
Кр = Выразим количество моль иодида серебра, перешедшего в раствор через х, тогда [AgS2O3]– = [I–] = х, равновесная концентрация [S2O32–] = (1 – х).
Кр = пренебрегая значением х в знаменателе, получим: 5,5 · 10–8 = х2. х = 2,4 · 10–4 моль/л. Следовательно, в 1 л 1М раствора Na2S2O3 растворяется 2,4 · 10–4 моль иодида серебра. Для растворения 0,10 г соли потребуется
Контрольные вопросы 1. Дайте определения следующим понятиям: § комплексное соединение, § центральный атом (комплексообразователь), лиганд, § координационное число, § дентантность, § константа нестойкости и константа устойчивоcти комплексного иона. Разберите на конкретном примере 2. Приведите примеры комплексных соединений, являющихся солями, в состав которых входит: § комплексный анион, § комплексный катион. 3. Приведите примеры комплексных соединений, являющихся § кислотами, § основаниями. 4. В растворе присутствуют ионы Zn2+, аммиак и цианид-ионы. Какой лиганд образует с катионом цинка более прочное соединение? 5. По какому признаку комплексные соединения относят к хелатным? 6. Назовите перечисленные ниже соединения: а) K2[Pb(OH)4]; б) Na3[Co(NO2)6]; в) [Co(NH3)6]Cl2. Напишите уравнения диссоциации этих соединений в водном растворе. Приведите выражение константы нестойкости и его значение. 7. Какой аммиачный комплекс катионов VI аналитической группы наиболее прочный? Как можно разрушить этот комплекс? Ответ подтвердите соответствующими уравнениями реакций. 8. Могут ли реакции комплексообразования применяться для уменьшения токсического действия катионов тяжелых металлов? Приведите пример такой реакции комплексообразования для ионов: свинца (II), ртути (II), меди (II). 9. К какому типу комплексных соединений относится соединение Ni2+ с диметилглиоксимом? Приведите структурную формулу диметилглиоксима и уравнение реакции с катионом Ni2+. 10. Чему равны координационное число и дентантность лиганда в следующих координационных соединениях: а) K2[Cd(CN)3Br]; б) K3[FeF4Cl2]; в) K2[Pt(OH)5Br]; г) [Cr(H20)5OH]NO3; д) [Ni(NH3)6]SO4. 11. Приведите примеры использования реакции комплексообразования в анализе катионов V—VI аналитических групп с целью разделения этих катионов на группы. 12. Приведите примеры реакций разрушения аммиакатов для катионов VI аналитической группы. 13. Возможно ли обнаружение иона калия в присутствии иона аммония с реактивом Na3[Co(NO2)6]? Напишите соответствующие реакции ионов калия и аммония с данным реактивом. 14. Напишите реакцию обнаружения иона Со2+ с реактивом, содержащим ион SCN–. Почему эту реакцию выполняют капельным способом? 15. Катион Cu2+ можно открыть: а) используя комплексное соединение как реагент; б) используя реакцию комплексообразования с характерной окраской раствора. Напишите эти реакции в молекулярном и ионном виде. 16. Как можно обнаружить катион Cd2+, используя комплексные соединение в качестве реагента? Что происходит с комплексным соединением в процессе реакции? Напишите соответствующую реакцию в молекулярном и ионном виде.
Задачи для самостоятельного решения 1. Напишите уравнения диссоциации солей K3[Fe(CN)6] и NH4Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадет осадок гидроксида железа (III)? Напишите молекулярное и ионно-молекулярное уравнения реакции. 2. Напишите уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадет осадок гидроксида железа (II)? Напишите молекулярное и ионно-молекулярное уравнения реакции. 3. Напишите уравнения диссоциации солей Na3[AlF6] и NH4Al(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадет осадок гидроксида алюминия? Напишите молекулярное и ионно-молекулярное уравнения реакции. 4. Определите концентрацию ионов Zn2+ в 0,01М растворе соли [Zn(NH3)4]Cl2. 5. Вычислите концентрацию ионов Cl– в 0,10М растворе соли K2[HgCl4]. 6. Вычислите массу ионов Ag+ в 0,10М растворе K[Ag(CN)2]. 7. Вычислите массу ионов CN– в 500 мл 0,10М растворе K4[Fe(CN)6]. 8. Вычислите массу ионов Со2+ в 250 мл 0,20М растворе соли [Co(NH3)6]Cl3. 9. Определите массу ионов Au3+ в 500 мл 0,10М растворе H[AuCl4]. 10. В 20,0 мл воды растворили 0,1842 г K4[Fe(CN)6]. Чему равна концентрация (моль/л) ионов железа (II) в растворе? 11. В каком из растворов одинаковой молярной концентрации солей состава K2[Hgl4] и K2[Hg(CN)4] концентрация ионов Hg2+ больше и во сколько раз? Ответ подтвердите расчетами. 12. В каком из растворов одинаковой молярной концентрации солей состава K[Ag(CN)2] и [Ag(NH3)2]Cl концентрация ионов Ag+ больше? Ответ подтвердите расчетами. 13. Сколько моль аммиака необходимо добавить к 1 л 0,10М раствору хлорида кадмия (II), чтобы снизить концентрацию ионов кадмия до 2 · 10–6 моль/л? Учесть, что образуется комплексный ион [Cd(NH3)4]2+. 14. К 0,20М раствору сульфата меди (II) добавили равный объем 2,0М раствора аммиака. Вычислите концентрацию ионов меди, если считать, что в растворе образуются комплексные ионы [Cu(NH3)4]2+. 15. Сколько моль KSCN необходимо внести в 1 л 10–5М раствора нитрата ртути (II), чтобы снизить концентрацию ионов ртути (II) до 10–11 моль/л? Кн = 1,7 · 10–20. 16. Образуется ли осадок сульфида кадмия, если к 0,01М раствору соли [Cd(NH3)4Cl2 добавили 0,01 моль сульфида натрия? 17. Произойдет ли разрушение комплекса, если к 0,20М раствору Na[AgS2O3] прилить равный объем 0,02М раствора иодида калия? 18. Рассчитайте, образуется ли осадок FeS, если к 0,20М раствору комплексной соли K4[Fe(CN)6] добавить 0,0002 моль сульфида натрия. 19. Вычислите растворимость (г/л) гидроксида цинка в 1 л 1,0М раствора аммиака, если образуется комплексный ион [Zn(NH3)4]2+. 20. Сколько граммов хлорида серебра растворится в 100 мл 2,0М раствора аммиака? 21. Вычислите растворимость бромида серебра (моль/л) в 0,10М растворе аммиака. 22. Сколько мл 1,0М раствора аммиака необходимо для растворения 0,20 г AgCl? 23. Сколько мг AgBr растворится в 100 мл 4,0М раствора тиосульфата натрия? 24. Сколько мл 5,0М раствора аммиака надо взять для растворения 0,20 г иодида серебра? 25. К раствору, содержащему 0,10 моль/л [CdI4]2–, прибавлено 0,10 моль нитрата свинца (II). Образуется ли осадок иодида свинца? ПР(PbI)2= 1,1 · 10–9.
Список литературы 1. Цитович И. К. Курс аналитической химии. СПб.: Лань, 2007. 2. Основы аналитической химии: Практ. руководство / Под ред. Ю. А. Золотова. М.: Высшая школа, 2001. 3. Лурье Ю. Ю. Справочник по аналитической химии. М.: Химия, 1989. 4. Воскресенский А. Г. Сборник задач и упражнений по аналитической химии / А. Г. Воскресенский, И. С. Солодкан, Г. Ф. Семиколенов. М.: Просвещение, 1985. 5. Васильев В. П. Аналитическая химия: Сб. вопросов, упражнений и задач / В. П. Васильев, Л. А. Кочергина, Т. Д. Орлова. М.: Дрофа, 2004. 6. Джабаров Д. Н. Сборник упражнений и задач по аналитической химии. М.: ООО «Медицинское информационное агентство». 2007. ПРИЛОЖЕНИЕ Таблица 1
|
||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 2618; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.121.242 (0.003 с.) |
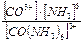
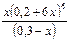
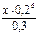 , х = 2,9 · 10–32.
, х = 2,9 · 10–32.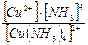
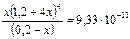
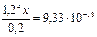 , х = 8,1 · 10–14.
, х = 8,1 · 10–14.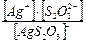
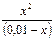 ;
; 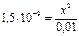 ; х=3,9·10-6 моль/л
; х=3,9·10-6 моль/л 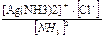
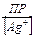 ,
,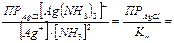
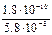 = 3,1 · 10–3.
= 3,1 · 10–3.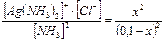 ,
,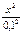
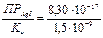 = 5,5 · 10–8.
= 5,5 · 10–8.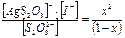 ,
,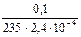 = 1,8 л раствора тиосульфата натрия.
= 1,8 л раствора тиосульфата натрия.


