
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II. Гидролиз солей по катиону
Катионы слабых оснований (аквакомплексные ионы магния, цинка, алюминия, марганца (II), меди (II), железа (II), железа (III) и т. д.) в реакциях гидролиза ведут себя как слабые кислоты. Гидролиз многозарядных катионов проходит в основном по первой ступени с образованием основных солей: CrCl3 + HOH ↔ CrOHCl2 + HCl; [Cr(H2O)n]3+ + HOH ↔ H3O+ + [Cr(H2O)n–1OH–]2+. В упрощенном виде реакцию гидролиза записывают: Cr3+ + HOH ↔ H+ + CrOH2+, рН < 7, среда кислая. Данное протолитическое равновесие также характеризуется константой гидролиза:
В общем случае для гидролиза солей по катиону имеем следующие расчетные формулы: 1. Для константы гидролиза: Кв — константа сопряженного основания, т. е. константа диссоциации слабого основания (табл. 2). 2. Для степени гидролиза катиона: 3. Величина рН растворов таких солей рассчитывается по уравнению: рН = 7 + ½ lgKв – ½ lgСс
III. Для солей, образованных анионами слабых кислот и катионами слабых оснований, применяют следующие расчетные формулы: 1.
3. рН = 7 – ½lgKа – ½lgКв.
Решение типовых задач Пример 1. Рассчитайте Kг, hг, pH 0,01М раствора гипохлорита натрия. Кα(HClO) = 2,95 · 10–8. Решение: Гипохлорит натрия — соль образована сильным основанием NaOH и слабой кислотой HClO, следовательно, она подвергается гидролизу по аниону. 1. Запишем уравнение гидролиза: ClO– + H2O ↔ HClO + OH–. 2. Рассчитаем константу гидролиза: 3. Определим степень гидролиза соли:
4. Найдем концентрацию ОН–: из уравнения реакции гидролиза видно, что [HClO] = [OH–]
pOH = – lg(5,8 · 10–5) = 4,23; pH = 14 – 4,25 = 9,77. Применив расчетную формулу, также можно вычислить рН данного раствора: рН = 7 – ½ lg (2,95 · 10–8) +1/2 lg10–2 = 7 + 3,77 – 1 = 9,77.
Пример 2. рН раствора ацетата натрия CH3COONa равно 9,50. Рассчитайте См, Kг, hг соли. Кα(CH3COOН) = 1,76 · 10–5. Решение: Соль ацетат натрия образована сильным основанием NaOH и слабой кислотой CH3COOН, следовательно, гидролизу подвергается по аниону. 1. Запишем уравнение гидролиза: CH3COO– + Н2О ↔ CH3COOН + ОН–. 2. Определим концентрацию соли, используя значение рН данного раствора:
3. Рассчитаем константу и степень гидролиза:
Пример 3. Вычислите рН раствора, полученного при растворении 5,35 г хлорида аммония в 1 л H2O. Kв(NH3∙Н2О) = 1,75 · 10–5. Решение: Хлорид аммония — соль, образованная сильной кислотой HCl и слабым основанием NH3∙Н2О, следовательно, гидролизуется по катиону. 1. Запишем уравнение гидролиза в ионной форме: NH4+ + H2O Û NH3 + H3O+. 2. Рассчитаем молярную концентрацию хлорида аммония:
3. Находим концентрацию катионов водорода:
рН = –lg7,56 · 10–6 = 5,10.
Пример 4. Вычислите степень гидролиза и константу гидролиза бромида аммония в 0,10М растворе, рН которого равен 5. Кв = 1,75 · 10–5. Решение: 1. Запишем ионное уравнение гидролиза: NH4+ + H2O ↔ NH3 + H3O+. 2. Определим концентрацию ионов водорода в растворе соли: рН = 5,00; [H+] = 10–5 моль/л. 3. Рассчитаем степень гидролиза бромида аммония: [NH3] = [H+], тогда hг = 4. Константу гидролиза рассчитаем согласно уравнении.
Зная константу ионизации слабого электролита и ионное произведение воды, запишем:
Пример 5. Рассчитайте константу диссоциации (Кα) азотистой кислоты, если концентрация раствора нитрита калия равна 1 · 10–3 моль/л, рН раствора соли равен 7,15. Решение: 1. Запишем уравнение гидролиза: NO2– + H2O Û HNO2 + OH–. 2. [HNO2] = [OH–],
3. Среда раствора при гидролизе этой соли определяется наличием в растворе гидроксильных групп. рН + рОН = 14, тогда рОН = 14 – рН, рОН = 14 – 7,15 = 6,85, рОН = –lg[OH–] [OH–] = 1,4 · 10–7 моль/л. 4. Рассчитаем константу диссоциации слабого протолита (HNO2); подставить в формулу (I) численные значения.
Пример 6. Во сколько раз надо изменить концентрацию 0,1М раствора ацетата натрия (CH3COONa), чтобы степень гидролиза соли удвоилась? Решение: Степень гидролиза любого растворенного вещества увеличивается при уменьшении концентрации раствора, значит, раствор следует разбавить, добавив воды.
При уменьшении концентрации Сс в х раз степень гидролиза увеличивается в
Пример 7. Оцените рН 1,0М раствора гидросульфита калия (KHSO3). Решение: 1. Гидросульфит калия в растворе полностью диссоциирован на ионы:
KHSO3 → К+ + HSO3–. KI = 1,6 ·10-2
2. Ионы HSO3– участвуют в двух равновесиях: — диссоциации по второй ступени: HSO3– + H2O Û Н3О+ + SO32–, КII = 6 · 10–8; —гидролиза: HSO3– + H2O Û H2SO3 + OH–, Если Кll > Kr, то реакция среды практически полностью определяется равновесием диссоциации иона HSO3–.
рН = –lg[H+] = –lg (2,40 · 10–4) = 3,60.
Контрольные вопросы 1. В чем состоит различие между гидратацией иона и гидролизом иона? 2. Как влияет на глубину протекания гидролиза соли заряд катиона и его радиус? 3. Какие факторы влияют на степень гидролиза соли? 4. Расположите перечисленные катионы в ряд по возрастанию способности к гидролизу: Al3+, Cr3+, Fe3+. 5. В какой цвет окрасится каждый из растворов К2СО3 и NH4Cl при добавлении следующих индикаторов: а) метилового оранжевого; б) фенолфталеина? Напишите реакции гидролиза этих солей. 6. Напишите уравнения реакций гидролиза следующих солей: сульфат меди (II), карбонат аммония, фосфат натрия, хлорид железа (III). 7. Укажите реакцию среды водных растворов следующих солей: а) иодид калия, бромид аммония, сульфид натрия; б) дигидрофосфат калия, нитрат калия, цинкат натрия; в) хлорид хрома (III), хлорид бария, сульфат калия. 8. Какие условия необходимо создать, чтобы подавить гидролиз сульфата железа (II)? 9. Как изменится степень гидролиза цианида натрия при добавлении к раствору: а) гидроксида натрия; б) хлороводородной кислоты? 10. Почему гидролиз сульфида хрома (III) идет необратимо? Ответ подтвердите уравнением реакции. 11. При взаимодействии растворов Fe2(SO4)3 и K2CO3 выпадает осадок гидроксида железа (III)? Дайте пояснения, напишите реакции. 12. При равных концентрациях солей степень гидролиза какой соли больше: NH4NO2 или NH4СN? Ответ подтвердите расчетами. 13. В какой последовательности уменьшаются значения рН водных растворов приведенных ниже солей с одинаковой молярной концентрацией: а) нитрит калия; б) нитрат калия. в) сульфат меди (II) 14. Какую реакцию среды (кислую, нейтральную, щелочную) имеют водные растворы следующих солей: а) цианид аммония; б) ацетат аммония; в) фторид аммония.
Задания для самостоятельной работы 1. Почему при растворении в воде хлорида висмута (III) раствор подкисляют? Напишите уравнение гидролиза, выражение константы гидролиза. Какие факторы надо использовать, чтобы подавить гидролиз этой соли? 2. В 1 л раствора содержится 1,96 г ацетата калия. Рассчитайте степень гидролиза и концентрацию уксусной кислоты, которая образовалась в результате гидролиза соли. 3. Во сколько раз надо изменить концентрацию 0,10 М раствора цианида натрия, чтобы степень гидролиза соли удвоилась? 4. рН 0,01М раствора калиевой соли слабой одноосновной кислоты равно 9,50. Вычислите: а) константу гидролиза этой соли б) степень гидролиза этой соли. 5. Вычислите константу гидролиза и рН раствора гидроселенита калия. 6. Какую массу сульфата аммония растворили в 1 л воды, если в результате гидролитического процесса рН раствора равен 5,60? 7. Вычислите степень гидролиза и рН 0,012М раствора сульфата меди (II). 8. Рассчитайте рН раствора арсената натрия, содержащего 3,05 г соли в 250 мл раствора. 9. Как изменится рН 0,10 моль/л раствора карбоната натрия, если этот раствор разбавить в 10 раз?
10. Рассчитайте молярную концентрацию раствора силиката натрия, если рН раствора равен 8,50. 11. Рассчитайте константу гидролиза и степень гидролиза раствора цианида аммония. 12. Какие факторы подавляют гидролиз солей, образованных сильным основанием и слабой кислотой (например, K2S, K2CO3, K2SO3): а) разбавить водой; б) понизить температуру; в) повысить температуру; г) добавить кислоту; д) добавить щелочь? Обоснуйте ответ, написав реакции гидролиза этих солей. 13. Рассчитайте рН 0,10 моль/л растворов следующих солей: Na3PO4, Na2HPO4, NaH2PO4. Прокомментируйте полученные результаты. 14. Вычислите степень гидролиза ацетата аммония: а) при t = 25 °C; б) при t = 100 °C. Какой вывод можно сделать из полученных результатов? 15. При обнаружении ацетат-ионов исследуемый раствор нагревают на водяной бане с хлоридом железа (III). Образуется красно-бурый осадок. Напишите уравнение реакции. Какой процесс при этом протекает? 16. Рассчитайте константу диссоциации метановой кислоты, если концентрация раствора формиата натрия равна 1 · 10–2 моль/л, рН раствора соли 7,50. 17. Вычислите значение констант гидролиза при t = 25 °C растворов: а) цианида калия; б) ацетата калия. Прокомментируйте полученные результаты. 18. К раствору хлорида хрома (III) прибавили раствор карбоната натрия. При этом образовался осадок, растворимый в избытке щелочи и кислоты. Напишите уравнения реакций, дайте пояснения. 19. Пробирку с раствором хлорида железа (III) нагрели и поместили в нее кусочек цинка (предварительно очищенного). Какой газ при этом выделяется? Напишите уравнения соответствующих реакций. 20. Расположите соединения Na2СO3, NaHСO3, NaОH. в порядке увеличения рН, если растворы имеют одинаковую концентрацию равную 0,10 моль/л.
Варианты контрольных задач по темам: расчеты рН и рОН сильных и слабых электролитов, буферных растворов, растворов гидролизующихся солей Вариант № 1 1. Рассчитайте [H+] и рН в растворах: а) HCl; б) Ва(ОН)2 Молярную концентрацию растворов считать равной 0,015 моль/л. 2. Рассчитайте коэффициент активности активности ионов водорода в растворе уксусной кислоты, если молярная концентрация кислоты равна 0,006 моль/л и рН = 3,49. 3. Как изменится [H+] в растворе, если величина рН раствора: а) уменьшится на 2 единицы; б) увеличится на 2 единицы. 4. Вычислите значения рН растворов, содержащих в 1 л: а) 0,10 г КОН; б) 6,30 г HNO3 5. Рассчитайте рН буферного раствора, полученного растворением 9,60 г CH3COOH и 0,82 г CH3COONa в 500 мо воды.
6. Концентрация нитрита калия в растворе равна 1 · 10–3 моль/л, рН раствора 7,15. Рассчитайте константу диссоциации азотистой кислоты Кα. 7. Сколько граммов NH4Cl надо растворить в 20,0 мл 0,50М раствора аммиака, чтобы получить концентрацию гидроксид-ионов, равную 5 · 10–4 моль/л?
Вариант № 2 1. Рассчитайте [H+] и рН в растворах: а) NH3 · H2O; б) HCl Молярную концентрацию растворов считать равной 0,015 моль/л. 2. Рассчитайте коэффициент активности ионов водорода в растворе серной кислоты, если См (H2SO4) = 0,01 моль/л; рН = 1,76. 3. Вычислите молярную концентрацию растворов муравьиной кислоты, значения рН которых составляют: а) 2,30; б) 3,10. 4. Вычислите активность ОН- и значения рН для раствора КОН с массовой долей раствора 2,00 %, ρр-ра = 1,02 г/мл. 5. Определите рН в растворе, содержащем 0,10 моль аммиака и 0,01 моль NH4Cl в 100 мл раствора. КВ = 1,80 · 10–5. Как изменится рН раствора при добавлении 0,70 г HCl? 6. рН раствора ацетата натрия составляет 9,50. Рассчитайте СМ, Кг, hг раствора полученной соли. 7. Сколько граммов нитрита натрия надо растворить в 0,60 л воды, чтобы рН полученного раствора стало равным 6,00?
Вариант № 3
1. Рассчитайте рН раствора серной кислоты объемом 100 мл и массовой долей 3,00 % (ρр-ра = 1,0 г/мл). Как изменится рН раствора после добавления 0,05 моль сульфата алюминия? 2. Какая масса НСООН содержится в 300 мл раствора, если рН = 3,00? 3. Степень диссоциации 0,10М раствора аммиака равна 1,33 %. Вычислите рН этого раствора. 4. Как изменится концентрация ионов водорода в воде, если температура воды увеличилась от 20 до 80 °С? 5. В 1,0 л раствора содержится 1,96 г ацетата калия. Рассчитайте степень гидролиза и концентрацию уксусной кислоты, образовавшейся в результате гидролиза соли. 6. Сколько граммов цианида калия надо добавить к 500 мл 0,40М раствора HCN, чтобы раствор стал нейтральным? 7. Сколько граммов KH2PO4 надо растворить в 25,0 мл 0,20М раствора К2НРО4, чтобы рН = 7,20?
Вариант № 4 1. Как изменится рН раствора серной кислоты объемом 100 мл с СЭ = 0,05 моль/л после добавления 20,0 мл 0,50М раствора сульфата калия? 2. Рассчитайте значение рН раствора, полученного при смешении равных объемов растворов 0,06М H2SO4 и 0,02М HCl. 3. Вычислите концентрацию сероводородной кислоты в растворе, рН которого 4,60. 4. При разбавлении раствора в 10 раз его рН изменился точно на единицу. Что можно сказать на основании этого факта о концентрации раствора и природе растворенного электролита? 5. рН 0,10М раствора калиевой соли некоторой одноосновной органической кислоты равна 9,00. Вычислите константу гидролиза и константу диссоциации этой кислоты. 7. Во сколько раз надо изменить концентрацию 0,10М раствора ацетата натрия, чтобы степень гидролиза соли удвоилась? 7. Сколько граммов уксусной кислоты надо добавить к 100 мл 0,50М раствора ацетата калия, чтобы раствор имел рН = 5,00?
Вариант № 5 1. рН желудочного сока равен 0,90. Определите молярную концентрацию (моль/л) соляной кислоты.
2. Рассчитайте активность Н+ в 0,01М растворе H2SO4, содержащем 0,20 моль/л Na2SO4. 3. В растворе какой кислоты и во сколько раз [Н+] больше: а) Н2СО3 или H2SiO3; б) HCl или HCIO? Молярные концентрации кислот считать одинаковыми. 4. Вычислите КВ и рКВ в растворе аммиака (NH3 · H2O) ω = 1,00 % и ρ = 1,0 г/мл, если степень диссоциации α = 0,77%. 5. Рассчитайте рН 0,10М растворов следующих солей: а) Na3PO4; b) Na2HPO4; с) NaH2PO4. Напишите соответствующие уравнения реакций, прокомментируйте полученные результаты. 6. Сколько молей NH4Cl следует добавить в один литр 0,10М раствора NH3 · H2O, чтобы молярная концентрация гидроксид-ионов стала равной константе диссоциации этого слабого основания? 7. К 210 мл 0,10М раствора карбоната натрия добавили 90 мл 0,10М HCl. Вычислите рН полученного раствора.
Вариант № 6 1. Рассчитайте [Н+] и рН растворов а) H2SO4; б) Са(ОН)2. Молярная концентрация растворов равна 0,0125 моль/л. 2. Чему равен рН раствора ортоборной кислоты молярной концентрации эквивалента 0,08 моль/л? 3. Какую массу азотистой кислоты необходимо растворить в 200,0 мл воды, чтобы рН раствора был равен 2,50? 4. Вычислите активность Н+ и значение рН раствора NaОH объемом 300,0 мл ω = 3,00% и ρ = 1,02 г/мл. 5. К 500,0 мл раствора муравьиной кислоты с молярной концентрацией 0,20 моль/л прибавили 3,40 г формиата натрия. Определите рН полученного раствора. Как изменится рН раствора при добавлении 1,00 г NaОH? 6. Рассчитайте Kг, hг, рН раствора нитрата аммония СМ = 0,025 моль/л. 7. Сколько граммов карбоната натрия растворено в 0,50 л воды, если рН полученного раствора равен 9,90?
Вариант № 7 1. Рассчитайте [Н+] и рН растворов: а) HCN; б) NaOH. Молярная концентрация растворов равна 0,003 моль/л. 2. Какую массу уксусной кислоты необходимо растворить в 500 мл воды, чтобы получить раствор с рН = 2,50 (плотность полученного раствора принять за 1 г/мл)? 3. Чему равен рН раствора Са(ОН)2 с молярной концентрацией эквивалента, равной 0,08 моль/л? 4. Вычислите активность Н+ и значение рН раствора H2SO4 ω = 2,5 % и ρ = 1,019 г/мл. 5. Рассчитайте рН раствора, содержащего 5,0 г аммиака и 2,0 г нитрата аммония в 0,59 л раствора. Как изменится рН раствора при добавлении 1,0 г HCl? 6. Рассчитайте Kг, hг, рН для 0,05М раствора K2SO3. 7. В каком объеме воды надо растворить 0,03 г ацетата натрия, чтобы рН стало равным 8,00? Вариант № 8 1. Рассчитайте [Н+] и рН растворов: а) Ва(ОН)2; б) HNO3. Молярная концентрация растворов равна 0,02 моль/л. 2. Какая масса муравьиной кислоты содержится в 0,3 л раствора, имеюшего рН = 6,04? 3. Чему равен рН раствора угольной кислоты с молярной концентрацией эквивалента, равной 0,05 моль/л? 4. Вычислите активность Н+ и рН раствора HClO4, если молярная концентрация раствора равна 0,08 моль/л. 5. Рассчитайте рН раствора, содержащего в 1 л раствора 0,10 моль гидрофосфата натрия и 0,20 моль дигидрофосфата натрия. Как изменится рН при добавлении 0,05 моль NaOH? 6. Рассчитайте Kг (по 1 ступени), hг, рН раствора, полученного при растворении 5,00 г ортофосфата натрия в 200 мл воды. 7. Какую массу хлорида аммония надо растворить в 100 мл воды, чтобы рН = 6,00? Вариант № 9 1. Рассчитайте [Н+] и рН растворов: а) Са(ОН)2; б) Н2SO4. Молярная концентрация растворов равна 0,0125 моль/л. 2. Чему равен рН раствора ортоборной кислоты с молярной концентрацией эквивалента 0,08 моль/л? 3. Какую массу азотистой кислоты необходимо растворить в 200 мл воды, чтобы рН раствора был равен 2,50 (плотность полученного раствора принять за 1 г/мл)? 4. Вычислите активность гидроксид-ионов и значение рН для раствора NaOH ω = 3,00 % и ρ = 1,02 г/мл. Объем раствора 300 мл. 5. К 500 мл раствора муравьиной кислоты См = 0,20 моль/л прибавили 3,40 г формиата натрия. Определить рН полученного раствора. Как изменится рН раствора при добавлении 1,00 г NaOH? 6. Рассчитайте Kг, hг, рН для 0,025М раствора NH4NO3. 7. Сколько (г) карбоната натрия растворено в 0,50 л воды, если рН полученного раствора равняется 9,80? Вариант № 10 1. Рассчитайте [Н+] и рН растворов: а) Sr(OH)2; б) HCIO4. Молярная концентрация растворов равна 0,005 моль/л. 2. Определите молярную концентрацию раствора кислоты HNO2, рН которого равен 3. 3. Чему равен рН сероводородной кислоты с концентрацией 0,001 моль/л? 4. Вычислите активность гидроксид-ионов и рН раствора LiOH ω = 1,90 %, ρ = 1,012 г/мл. Объем 400 мл. 5. Рассчитайте рН раствора, если к 200 мл 0,20М раствора уксусной кислоты прибавили 0,90 г ацетата натрия. Сколько (г) HCI надо добавить, чтобы рН изменилось на 1,00? 6. Рассчитайте Kг, hг, рН для 0,01М раствора NH4NО2. 7. Какую массу сульфата аммония растворили в 100 мл воды, если рН полученного раствора стало равным 5,00? Вариант № 11 1. Рассчитайте рН смеси равных объемов 0,06М раствора серной кислоты и 0,02 моль/л соляной кислоты. 2. Рассчитайте активность ионов водорода и рН раствора, содержащего 0,00343 г гидроксида бария в 200 мл раствора. Как изменится рН раствора после добавления в него 20,0 г хлорида бария? 3. Чему равен рН сероводородной кислоты с концентрацией 0,01 моль/л? 4. Вычислите активность гидроксид-ионов и рН раствора Ва(ОН)2 ω = 2,80 %, ρ = 1,012 г/мл. Объем 600 мл. 5. Рассчитайте рН раствора, если к 200 мл 0,20М раствора уксусной кислоты прибавили 1,80 г ацетата натрия. Сколько (г) HCI надо добавить, чтобы рН изменилось на 1,00? 6. Рассчитайте Kг, hг, рН для 0,01М раствора NH4CN. 7. Какую массу сульфата аммония растворили в 100 мл воды, если рН полученного раствора стало равным 4,00? Вариант № 12 1. Чему равен рН раствора, содержащего 1,00 г гидроксида натрия в 250 мл раствора? 2. Какова активность ионов водорода в растворе, полученном при смешивании равных объемов 0,10 моль/л раствора соляной кислоты и 0,30 моль/л раствора серной кислоты? Каково рН полученного раствора? 3. Рассчитайте рН 3,00 % раствора перекиси водорода (плотность раствора принять равной 1,00 г/мл). 4. В 0,05М растворе HCN степень диссоциации равна 1,26 10–4. При какой концентрации она увеличится в 5 раз? 5. Как изменится рН аммиачного буферного раствора, содержащего 0,15 моль аммиака и 0,20 моль хлорида аммония в 1,0 л раствора, если к 50,0 мл этого раствора прибавить 25,0 мл 0,30 моль/л раствора гидроксида калия? Рассчитайте буферную емкость исходного буферного раствора. 6. Рассчитайте концентрацию раствора хлорида алюминия, рН которого равен 3,50, учитывая только 1-ю ступень гидролиза. 7. Рассчитайте степень гидролиза и рН раствора карбоната калия с концентрацией соли 10–3 моль/л. Гетерогенные равновесия
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 511; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.242.141 (0.184 с.) |
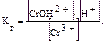 ?
?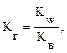 где
где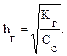
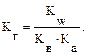 2.
2. 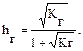
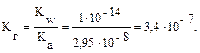
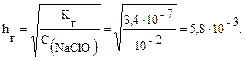
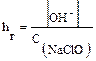 [OH–] = hr · C(NaClO) = 5,8 · 10–3∙10-2=5,8∙10-5;
[OH–] = hr · C(NaClO) = 5,8 · 10–3∙10-2=5,8∙10-5;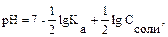 обозначим [CH3COONa] = х моль/л,
обозначим [CH3COONa] = х моль/л,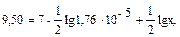 0,24 = lgx, x = 1,74 моль/л.
0,24 = lgx, x = 1,74 моль/л.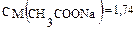 моль/л.
моль/л.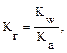
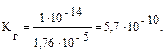
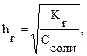
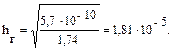
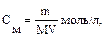
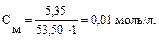
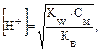
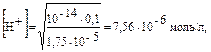
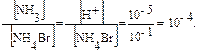
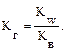

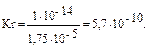
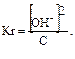
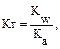 следовательно?
следовательно?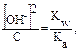
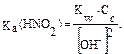 (I)?
(I)?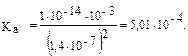
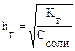
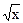 раз Û чтобы hr удвоилась, раствор нужно разбавить в 4 раза.
раз Û чтобы hr удвоилась, раствор нужно разбавить в 4 раза.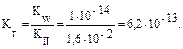
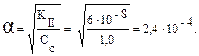 Равновесная концентрация [H+] = 𝑎· См при С = 1 моль/л. [H+] = 2,4 · 10–4 моль/л,
Равновесная концентрация [H+] = 𝑎· См при С = 1 моль/л. [H+] = 2,4 · 10–4 моль/л,


