Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема № 8: классы неорганических соединений ⇐ ПредыдущаяСтр 7 из 7
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. Оксиды бывают: Основные – оксиды металлов (Na2O, Fe2O3, СаО, СuO), им соответствуют основания. Кислотные – оксиды неметаллов (СO2, N2O5, SO3), им соответствуют кислоты. Амфотерные – это оксиды металлов со степенью окисления +3,+4 иногда +2 (Аl2O3, Cr2O3, ZnO). Свойства оксидов 1. Оксид щелочного металла + вода = щелочь; К2О + Н2О → 2КОН щелочные металлы: Li, Na, К, Rb, Сs, Fr, Са, Ва. 2. Основный оксид + кислота; Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O 3. Основный оксид + кислотный = соль; CaO + CO2 → CaCO3 4. Кислотный оксид + вода = кислота; SO3 + H2O→ H2SO4 5. Кислотный оксид + щелочь = соль + вода; N2O5 + Ca(OH)2 → CaCO3 + H2O Основания – сложные вещества, состоящие их ионов металла и гидроксогруппы (OH-). Основания делятся на растворимые в воде или щелочи: NaOH, КОН, Сa(OH)2, Ва(ОН)2 и нерастворимые в воде Сu(OH)2, Fl(OH)2, Al(OH)3, Zn(OH)2 и др. Получение оснований 1. Оксид щелочного металла + вода = щелочь; СаО + Н2О→ Са(ОН)2 2. Щелочной металл + вода = щелочь; 2Na+H2O→ 2NaOH + H2 3. Соль + щелочь = нерастворимое основание + соль СuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 Амфотерные основания – соединения, которые в зависимости от условий проявляют кислотные или основные свойства, т.е. проявляют двойственность. Zn(OH)2, Be(OH)2, Al(OH)3. 1. С кислотами, проявляет свойства оснований. Zn(OH)2 + H2SO4 → ZnSO4 + H2O основание кислота 2. С основаниями, проявляет свойства кислот. в расплаве: Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O кислота основание
в растворе: Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] + 2H2O кислота основание комплексная соль
Кислоты – сложные вещества, состоящие из ионов водорода и кислотного остатка. По количеству ионов водорода определяют основность кислот. Одноосновные – НCl – соляная кислота (Сl – хлорид) НF – фтороводородная кислота (F – фторид) НNO3 – азотная кислота (NO3– нитрат) НNO2 – азотистая кислота (NO2– нитрат) Двухосновные – H2SO4 – серная кислота (SO42 – сульфат) H2SO3 – сернистая кислота (SO32 – сульфит) H2S – сероводородная кислота (S2 – сульфид) H2СO3 – угольная кислота (СO32 – карбонат)
Н2SiO3 – кремневая кислота (SiO32 – силикат) Трехосновные – Н3РО4 – фосфорная кислота (РO42 – фосфат) Свойства кислот 1. кислота + основный оксид = соль +вода; 2НСl + CaO → CaCl2 + H2O 2. кислота + соль = соль + кислота; H2SO4 + Ва(NO3)2 → ВаSO4↓+ 2HNO3 3. кислота + основание = соль↓ + вода; 2НСl + К2СО3 → 2КСl + Н2О 4. кислота + металлы = соль и водород; Fe + H2SO4 → FeSO4 + H2 Взаимодействие с металлами зависит от концентрации кислот и активности металлов. Соли – сложные вещества, состоящие из ионов металла и ионов кислотного остатка. Классификация солей: Средние соли – состоят из ионов водорода, и кислотного остатка. К2СО3 - карбонат калия, MgCl2 – хлорид магния, Zn(NO3)2 – нитрат цинка. Кислые соли – состоят из ионов металла, водорода и кислотного остатка. К H СО3 – гидро карбонат калия, Na H 2 PO4 – дигидро фосфат натрия Основные соли – состоят из ионов металла, гидроксогруппы и кислотного остатка. Mg ОН Cl – гидроксо хлорид магния, Al(ОН)2 Cl – дигидроксохлорид алюминия. Свойства солей: 1. соль + щелочь = соль + основание (н); ZnCl2 + 2NaOH →Zn(ОН)2 + 2NaCl 2. соль + кислота = соль↓ + кислота; Ва(NO3)2 + H2SO4→ ВаSO4↓+ 2HNO3 3. Соль + соль = соль↓+ соль; AgNO3 + NaCl → AgCl + NaNO3 4. Соль + металл = соль + менее ак. металл Запомни: более активный металл вытесняет менее активный из его соли. Fe + CuSO4 → Cu + FeSO4 Пример 1. Назвать и охарактеризовать вещества: СuO, LiOH, Pb(NO3)2, CO2 СuO – оксид меди (основный) NaOH – гидроксид лития (щелочь) Pb(NO3)2 – нитрат свинца (средняя соль) CO2 – оксид углерода (IV) (кислотный оксид) Пример 2. Составить уравнения реакций по схеме, назвать полученные вещества: Р→ Р2О5→ Н3РО4 → Са3(РО4)2 1) 4Р + 5О2→ 2Р2О5 (оксид фосфора) 2) Р2О5 + 3Н2О → 2Н3РО4 (фосфорная кислота) 3) Н3РО4 +СаО → Са3(РО4)2 +Н2О (фосфат кальция + вода) Контрольное задание №8 Тема: «Классы неорганических соединений» 1. Назвать и охарактеризовать вещества. 2. Составить уравнения реакций по схеме, назвать полученные вещества. Варианты заданий 1. 1) HNO3, Na3PO4, Cu(OH)2, SO3 MgO 2) Fe → FeCl3 → Fe(OH)3 →Fe2O3 →Fe2(SO4)3 2. 1) CuCl2, Al2O3, CaO, H2SiO3, N2O5 2) Mg→ MgO →MgCl2 →Mg(OH)2 → MgO 3. 1) Ca(OH)2, PbO, CaHPO4, SiO2, P2O5, 2) Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
4. 1) Na3PO4, AlCl3, CuO, NaOH, CaCO3 2) S → SO3 → H2SO4 → MgSO4 → BaSO4 5. 1) CaОНCl, BaO, H3PO4, Fe(OH)2, H2SO4 2) Ca→ CaO→ Ca(OH)2→ Ca3(PO4)2→ H3PO4 6. 1) HNO3 HgO,SO2, CaCl2, Ca(OH)2 2) Cu→CuO→CuCl2→Cu(OH)2→CuO 7. 1) BaO, КH2PO4, FeCl3, Al(OH)3, CO2 2) SiO2→Na2SiO3→H2SiO3→SiO2 →Si 8. 1) NiO, FeS, H2CO3, Fe(OH)2Сl, HCl 2) Рb → PbO → PbCl2 → Pb(OH)2 → PbO 9. 1) HgO, BaSO3, HNO3, Ba(OH)2, CO2 2) Ca → CaO → Ca(OH)2 → CaCl2→ CaSO4 10. 1) Cl2O7, H2S, HgCl2, Mg(OH)2, Na2O 2) Al→Al2O3→AlCl3→Al(OH)3→Al2O3 11. 1) HBr, Fe(OH)2NO3, KOH, Li2O, N2O3 2) CuO→CuCl2→Cu(OH)2→CuO→Cu 12. 1) H2SiO3, Ca(OH)2, МgO, AlPO4, SO3 2) N2→N2O5→HNO3→Fe(NO3)2→Fe(OH)2 13. 1) HNO2, FeSO4, HgO NaOH СO2 2) Si→SiO2→Na2SiO3→H2SiO3→SiO2 14. 1) Fe2(SO4)3, SO2, Na3PO4, Ag2O, Cu(OH)2 2) Cu→CuO→CuCl2→Cu(OH)2→CuO 15. 1) HgNO3, H2SO4 CaO, Al(OH)3, ОF2 2) S→ SO3 → H2SO4 → MgSO4 → BaSO4 16. 1) Al2(SO4)3, MgO, CO2, NaCl, Ca(OH)2 2) Zn → ZnO → ZnSO4 → Zn(OH)2→ ZnO 17. 1) H2CO3, CuO, Fe2O3, NaNO3, КОН 2) Fe → FeCl2 → Fe(OH)2 → FeO → Fe 18. 1) Сr2O3, FeSO4, HBr, CaO Zn(OH)2 2) C → CO2 → CaCO3 → CaO → Ca(OH)2 19. 1) AlCl3, N2O5, Ва(ОН)2, Fe(OH)3, Na2SO3 2) Na → Na2O → NaOH → Cu(OH)2 → CuO 20. 1) K2O, CO2, NaHCO3, Ca(OH)2, NaCl 2) Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3 21. 1) LiOH, NaHSO3, Na2CO3, MgO, SO2 2) Cu → CuCl2 → Cu(OH)2 → CuO → CuSO4 22. 1) Р2О5, HNO3, CaOHCl, LiOH, Al2(SO4)3 2) N2 → N2O5 → HNO3 → Fe(NO3)2 → Fe(OH)2 23. 1) H2S, BaCO3, SO2, NaHSiO3, Cu(OH)2 2) Al2O3 → AlCl3 → Al(OH)3 → Al2O3 → Al 24. 1) Ca(OH)2, H3PO4, Na2O, KOH, NaHSO4 2) CuO → CuCl2 →Cu(OH)2 → CuO CuSO4 25. 1) Fe(NO3)3, НСl, SiO2, Zn(OH)2, СаО 2) CO2 → CaCO3 → CaO → Ca(OH)2 → СаСl2 26. 1) NaHCO3, NaOH, CuCl2 BaO, SO3 2) Mg→ MgO →MgCl2 →Mg(OH)2 → MgO 27. 1) Al2O3 H2SO3, Ва(ОН)2 MgCO3, Р2О5 2) Ca → CaO → Ca(OH)2 → CaCl2→ CaSO4 28. 1) Ca3(PO4)2, Na2O, HNO3 SO3, Fe(OH)3 2) Fe → Fe2O3→FeCl3 → Fe(OH)3 → Fe2(SO4)3 29. 1) CuO, FeOHCl, KOH, Р2О5, Cu(OH)2 2) N2 → N2O5 → HNO3 → Cu(NO3)2 → Cu(OH)2 30. 1) Ca(OH)2 K2O, Р2О3, Fe(OH)2Cl, СО2 2) Р→ Р2O5 → Н3РО4 → Na3PO4 →Na2SO4
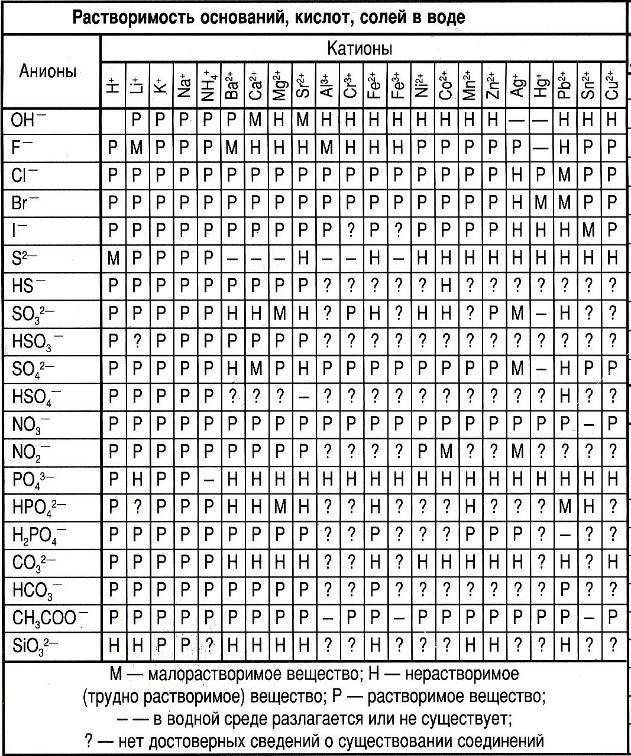
Приложение 1
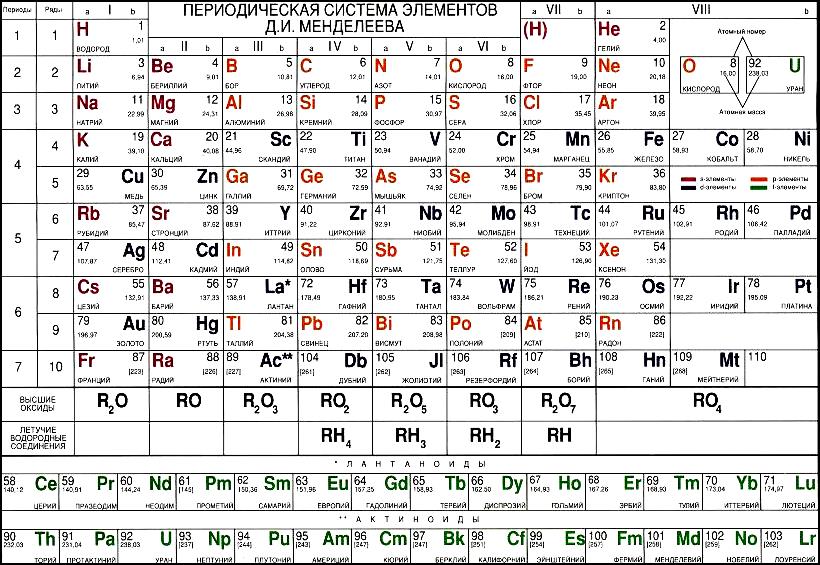
Приложение 2
|
||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 76; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.152.162 (0.022 с.) |