Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема№ 3: периодический закон и периодическая система Д. И. Менделеева. Строение атома
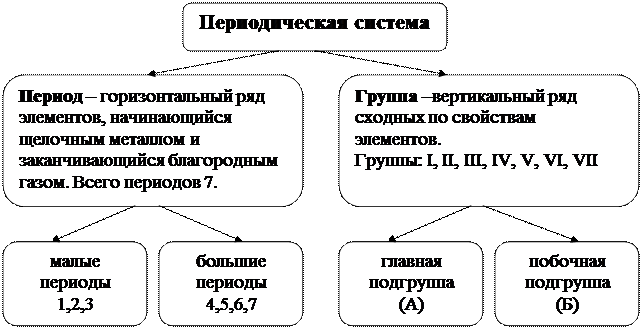
Периодический закон химических элементов был открыт русским ученым Д.И.Менделеевым в 1869 году. Современная формулировка: свойства простых тел, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра атома. Периодическая система – это графическое изображение периодического закона, где по горизонтальной оси расположены периоды, по вертикальной оси – группы.
Для компактности и удобства пользования Периодической системой 14 элементов из 6-го периода, сходных по свойствам с лантаном и 14 элементов из 7-го периода, сходных с актинием вынесены в отдельный ряд за пределы таблицы. Если в таблице провести диагональ от бора к астату, то в правом верхнем углу находятся типичные неметаллы, в левом нижнем углу – металлы, вдоль диагонали располагаются амфотерные элементы. В Периодической системе, как правило, указаны формулы высших оксидов и летучих водородных соединений. Чтобы составить формулу нужно вместо буквы R подставить элемент в соответствии с номером группы. Например, азот N находится в V группе, высший оксид R2O5 – N2O5, летучее водородное соединение RH3 – NH3. Свойства элемента и его соединений зависят от электронного строения атома. Атом состоит из ядра и электронов. Электрон (ē) – отрицательно заряженная частица. Количество электронов соответствует порядковому номеру химического элемента. Число электронов равно числу протонов (ē = р+). Протоны- положительно заряженные частицы, определяют заряд ядра. Чтобы вычислить число нейтронов нужно из атомной массы вычесть число протонов (n º = Ar – p +). Нейтроны – нейтральные частицы. Электроны вокруг ядра располагаются по энергетическим уровням, их количество соответствует номеру периода. Обозначаются 1,2,3,4.… Энергетические уровни состоят из подуровней, s, p, d, f. Распределение электронов по уровням и подуровням: 1уровень – 2ē 1s2 2 уровень – 8ē 2s22p6 3 уровень – 16ē 3s23p63d10 4 уровень – 32ē 4s24p64d104f14 План характеристики химического элемента по месту положения в П.С. Д.И. Менделеева: 1. Название, символ, период, группа, подгруппа 2. Порядковый номер, заряд ядра, количество протонов, электронов, нейтронов 3. Строение атома, электронная и графическая формула;
4. Возможные ковалентности 5. Металл, неметалл, амфотерный металл 6. Формула высшего оксида элемента, его характер (основный, кислотный, амфотерный) 7. Формула летучего водородного соединения. Пример 1. Дать характеристику атома химического элемента лития по положению его в Периодической системе Д.И. Менделеева. 1. Мышьяк (As) ― элемент 4 периода V группы главной A подгруппы периодической системы Д. И. Менделеева. 2. Порядковый номер 33, заряд ядра +33, р+ = 33, ē = 33, n º = 74 – 33=31 3. +33 As)2)8)18)5 1s22s22р63s23p63d104s24p3 – электронная формула графическое изображение
S 4. ковалентности - 3,5 5. не металл 6. высший оксид Аs2O5 – кислотный 7. летучее водородное соединение - AsH3 Контрольное задание № 3 Тема: «Периодический закон и периодическая система Д.И. Менделеева. Строение атома». Дать характеристику атома химического элемента по положению его в Периодической системе Д.И. Менделеева. Варианты заданий
ТЕМА № 4: ХИМИЧЕСКАЯ СВЯЗЬ Химическая связь – взаимодействие атомов, приводящее к образованию устойчивой многоатомной системы. Различают три основных типа химической связи: ковалентная, ионная, металлическая. Ковалентная связь – это связь, образованная за счет обобществления общих электронных пар. Различают два вида ковалентной связи: полярная и неполярная. Таблица 1-виды ковалентной связи Виды ковалентной связи
Донорно-акцепторный механизм образования ковалентной связи. В этом случае химическая связь возникает за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). Пример: образование иона аммония NH4+. В молекуле аммиака NH3 азот имеет одну неподеленную пару электронов (двухэлектронное облако), у иона водорода одна свободная орбиталь.
  Н Н + Н Н +
: N: + Н+ →: N: Н · · · · Н Н
При образовании иона аммония двухэлектронное облако азота становится общим для азота и водорода, образуется четвертая ковалентная связь. Ионная связь – химическая связь, возникающая между ионами за счет сил кулоновского притяжения между атомами металла и неметалла. Ионы – положительно или отрицательно заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов. Пример: образование химической связи в молекуле NaCl. Na ˙ - 1ē →Na+ .. : Cl · + 1ē →Сl¯ ˙˙ Na+ + Сl¯ → NaCl Металлическая связь – это связь между ионами металлов, расположенными в узлах кристаллической решетки, осуществляемая за счет обобществления внешних электронов. Электроны играют роль цемента, удерживая вместе положительные ионы, в противном случае решётка распалась бы под действием сил отталкивания между ионами. Металлическая связь характерна для металлов в твердом и жидком состоянии.
Контрольное задание № 4 Тема «Химическая связь» 1.Определить тип связи в молекулах. 2. В первой молекуле показать механизм образования связи. Варианты заданий
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 77; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.39.32 (0.012 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||