
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Загальні положення потенціометричного методу
Кількісною мірою кислотності середовища, тобто вмісту в розчині іонів водню, є величина Це суто теоретична величина, бо експериментально визначити активність окремого іону
Визначення рН розчинів здійснюють потенціометричним методом, який ґрунтується на вимірюванні електрорушійної сили (Е) гальванічного елементу, складеного з індикаторного електрода, потенціал якого є функцією концентрації іонів водню в розчині, і електрода порівняння, який має сталий і добре відтворюваний потенціал. Величина Е залежить від концентрації іонів На сьогодні найбільш поширеним електродом порівняння є хлоридсрібний електрод, а індикаторним – скляний іон-селективний електрод (ІСЕ). Скляний іон-селективний електрод виготовляють зі спеціального сорту електропровідного скла у вигляді скляної кульки з порожниною, заповненою розчином НCl з концентрацією 0,1 моль/л. У цей розчин занурено допоміжний хлоридсрібний електрод, що виконує роль зовнішнього виводу скляного електрода для його підключення до однієї з клем приладу, що вимірює значення електричного потенціалу (рис.4.1).
Схематично будова зображеного на рис.4.1 скляного електрода має вигляд Ag, AgCl|HCl (C=0,1моль/л)|скло÷÷Н+(досліджуваний розчин). Потенціал такого електрода лінійно залежить від показника активності іонів водню зовнішнього розчину, тобто значення рН:
де
Рівняння (4.3) – (4.5) – це рівняння прямих у координатах
Схема гальванічного елемента для потенціометричних вимірювань зі скляним електродом має вигляд Ag,AgCl|HCl(C=0,1моль/л)|скло|| Н+ || KCl нас.|AgCl,Ag скляний електрод досліджуваний хлоридсрібний електрод розчин Електрорушійна сила такого елемента (Е) визначається як різниця потенціалів хлоридсрібного Е= Е=const+ Згідно з (4.6) Е лінійно залежить від рН, до того ж тангенс кута нахилу цієї прямої визначає крутизну електродної функції
Експериментальна частина Реагенти, посуд і апаратура 1. Іономер І-160 М. 2. Скляний електрод ЕСЛ–43-07. 3. Хлоридсрібний електрод ЕВЛ–1М3.1 Підготовку електродів до роботи здійснюють згідно з правилами, наведеними в паспортах до електродів. 4. Буферні розчини– стандарт титри: – 0,05 m розчин гідрофталату калію ( – 0,025 m розчин дигідрофосфату калію та 0,025 m розчин гідрофосфату натрію ( – 0,01 m розчин тетраборату натрію ( Готувати буферні розчини необхідно на звільненій від вуглекислоти дистильованій воді. Буферні розчини зберігають у герметичному скляному або поліетиленовому посуді. Термін зберігання фосфатного буферу – 2 міс., решти – 3 міс.
5. Стаканчик місткістю 100 мл. 6. Хлорид калію, хч, насичений розчин. 7. Кислота хлоридна, 0,1М розчин.
Мета роботи: 1. Освоїти принципи й техніку прямих потенціометричних визначень і роботу зі скляним електродом. 2. Визначити Лабораторний іономір І-160 М призначений для прямого і непрямого потенціометричного вимірювання активності іонів водню (pХ), активності й концентрації інших одновалентних і двовалентних аніонів і катіонів (pХ ), окисно-відновних потенціалів (Eh) і температури у водних розчинах з поданням результатів у цифровій формі й у вигляді аналогового сигналу напруги постійного струму. За допомогою цього іономіру, використовуючи різні іон-селективні електроди, можна визначати вміст багатьох іонів, наприклад При визначенні рН досліджуваної води прямою потенціометрією, за допомогою іономеру І–160 М можна діяти двома способами: 1. Для декількох буферних розчинів з відомими значеннями рН виміряють Е і будують градуювальний графік у координатах Е– рН. Далі виміряють Е проби води, що аналізують, і за градуювальним графіком знаходять рН. 2. При масових визначеннях достатньо надійно відкалібрувати прилад за двома буферними розчинами з відомими значеннями Визначення рН води проводять одразу після відбору проби для запобігання хімічних і біохімічних процесів, що можуть привести до суттєвої зміни рН води. Для визначення рН використовують гальванічний елемент, який складають з індикаторного скляного електрода (ЕСЛ –43–07), потенціал якого є функцією концентрації іонів
Порядок роботи на іономірі при визначенні
1. Перед початком роботи прилад необхідно ввімкнути й прогріти протягом 30 хв. 2. Для проведення вимірів вимірювальний (скляний) і допоміжний (хлоридсрібний) електроди встановити на штатив і підключити відповідно до гнізд «ИЗМ.» і «ВСП.» приладу. 3. Вибір каналу вимірювання (іономір має 9 каналів). Натисканням кнопок ◄ або ► встановити курсор на цифру, що позначає номер каналу. Кнопками ▲ або ▼ вибрати номер каналу. Натиснути кнопку «ВВОД».
4. Робота в режимі «УСТАНОВКА» 4.1. Натисканням кнопки «РЕЖИМ» вибрати режим «УСТАНОВКА», натиснути кнопку «ВВОД». У режимі «УСТАНОВКА» необхідно: 4.1.1. Вибрати «Вид ионов» ( 4.1.2. Вибрати одиниці вимірювання «Размерность» (рХ). Після вибору натисніть кнопку «ВВОД». 4.1.3. Перевірити координати ізопотенціальної точки скляного електрода (рНі і Еі). На дисплеї д ля електроду ЕСЛ-43-07 повинні з’явитися координати ізопотенціальної точки: рНі = 7; Еі = – 25 мВ. Допустима похибка відхилення рН в ізопотенціальній точці Після перевірки значень координат ізопотенціальної точки натисніть кнопку «ВВОД».
5. Робота в режимі «НАСТРОЙКА» 5.1. Натисканням кнопки «Режим» вибрати режим «НАСТРОЙКА» і натиснути кнопку «ВВОД». Для настройкивикористовують 3 контрольних буферних розчина з відомими значеннями рН. При цьому доцільно вибирати буферні розчини таким чином, щоб з рН, близьким до рН досліджуваної води. Перед кожним занурюванням електродів у буферний розчин або пробу води обов’язково необхідно робочі частини електродів промити дистильованою водою, а залишки крапель води обережно видалити (без тертя) фільтрувальним папером!! 5.2. Настройка за першим буферним розчином (рН=6,86). 5.2.1. Занурити електроди й термометр у перший буферний розчин таким чином, щоб робочі частини електродів не торкалися один одного, стінок і дна стаканчика. Кулька скляного й носик хлоридсрібного електродів обов’язково повинні знаходитися під поверхнею рідини. 5.2.2. Установка температури розчинів. Іономір може працювати при автоматичній («Та) або ручній («Тр») установці температури. Ручну установка використовують при постійній температурі розчинів. Для ручної установки температури необхідно: натисканням кнопки ► перемістити курсор у поле значення наявної температури, що показує термометр. Ввести необхідне значення температури, використовуючи кнопки ▲,▼,◄,►і натиснути кнопку «ВВОД». 5.2.3. Дочекатися встановлення стабільного значення температури і Е (ЕРС) у правому верхньому куті приладу (не менше 3 хв.). При цьому на дисплеї виводиться значення рН першого буферного розчину. Якщо визначене приладом рН співпадає з теоретичним значенням рН буферного розчину, то натискають кнопку «ВВОД»; Якщо визначене приладом рН не співпадає з теоретичним значенням рН буферного розчину, то необхідно відкорегувати значення рН, котре виводиться на дисплей, використовуючи кнопки ▲,▼,◄,►, після чого натиснути кнопку «ВВОД». Прилад запропонує провести настройку за другим буферним розчином. 5.3. Настройка за другим буферним розчином проводять згідно з пунктами (5.2.1–5.2.3). Увага! Якщо в процесі настройки за двома розчинами в правому нижньому куті дисплея з'явиться повідомлення К s < 0,8 або Ks > 1,2 (де К s – поправочний коефіцієнт, який враховує відхилення реальної крутизни електродної функції від теоретичного значення), необхідно замінити буферні розчини й повторити настройку! Якщо повідомлення повториться, необхідно замінити електроди!
6. Робота в режимі «ИЗМЕРЕНИЕ» Натисканням кнопки «РЕЖИМ» вибрати «ЗАКОНЧИТЬ» настройку і прилад автоматично перейде в режим «ИЗМЕРЕНИЕ», після чого необхідно: 1) виконати контроль правильності проведення настройки за третім 2) виконати вимірювання рН проби води. Лабораторна робота № 5 Метод нейтралізації. Приготування і стандартизація робочих розчинів Самостійна підготовка Проробити такі питання: 1. У чому суть методу нейтралізації, які реакції лежать у його основі? 2. Які речовини можна визначити методом нейтралізації і чому? Наведіть приклади. 3. Які робочі розчини використовують у методі нейтралізації? Якої концентрації їх готують і чому? 4. Які речовини використовують як вихідні, які вимоги до них ставляться? 5. Які індикатори використовують у методі нейтралізації? Що таке інтервал переходу й показник титрування індикатора? 6. На чому ґрунтується вибір індикатора, яке значення при цьому має стрибок рН на кривій титрування? Робота в лабораторії Посуд і реактиви 1. Хлоридна кислота 2. Хлоридна кислота (фіксанал). 3. Тетраборат натрію Na 2 B 4 O 7 × 10 H 2 O (бура). 4. Гідроксид натрію 5. Індикатори: метиловий жовтогарячий і фенолфталеїн – 0,1%-ні розчини. 6. Бюретка місткістю 25 мл. 7. Колби мірні (250, 500, 1000 мл). 8. Конічна колба місткістю 250 мл. 9. Піпетки місткістю 10, 20 мл.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 154; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.156.35 (0.052 с.) |

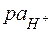 =
=  (4.1)
(4.1)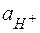 (або коефіцієнт активності) неможливо. Експериментально визначають тільки так зване ”інструментальне” значення рН, яке умовно теж знаходять як
(або коефіцієнт активності) неможливо. Експериментально визначають тільки так зване ”інструментальне” значення рН, яке умовно теж знаходять як 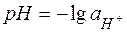 (4.2)
(4.2)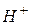 у розчині.
у розчині.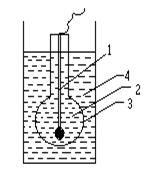 Рис. 4.1-Скляний електрод
Рис. 4.1-Скляний електрод
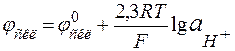 ; (4.3)
; (4.3)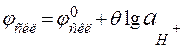 ; (4.4)
; (4.4)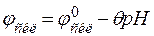 , (4.5)
, (4.5) – потенціал скляного електрода (стрибок потенціалу, що виникає на межі фаз скло-зовнішній розчин), В;
– потенціал скляного електрода (стрибок потенціалу, що виникає на межі фаз скло-зовнішній розчин), В; – певна стала, В. Це умовне значення потенціалу не можна уособлювати зі стандартним електродним потенціалом, бо ця стала зумовлена сортом скла й типом внутрішнього електрода;
– певна стала, В. Це умовне значення потенціалу не можна уособлювати зі стандартним електродним потенціалом, бо ця стала зумовлена сортом скла й типом внутрішнього електрода;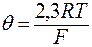 – крутизна електродної функції. За умов Т=298К,
– крутизна електродної функції. За умов Т=298К,  =0,059 В.
=0,059 В. від
від 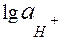 або від рН. Межа значень рН, де витримується така лінійна залежність, зумовлена сортом скла. В сильно кислих і сильно лужних розчинах спостерігається відхилення від лінійної залежності (електрод не має водневої функції) – рис.4.2. Для перевірки скляного електрода та його калібрування складають гальванічний елемент із скляного та хлоридсрібного електродів і експериментально виміряють його електрорушійну силу (Е) в буферних розчинах з відомим значенням рН.
або від рН. Межа значень рН, де витримується така лінійна залежність, зумовлена сортом скла. В сильно кислих і сильно лужних розчинах спостерігається відхилення від лінійної залежності (електрод не має водневої функції) – рис.4.2. Для перевірки скляного електрода та його калібрування складають гальванічний елемент із скляного та хлоридсрібного електродів і експериментально виміряють його електрорушійну силу (Е) в буферних розчинах з відомим значенням рН.

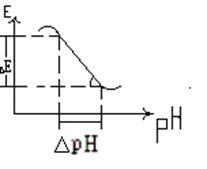 Рис.4.2
Рис.4.2
 і скляного
і скляного 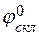 -
- 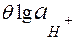 =
= 
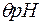 . (4.6)
. (4.6)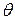 (див. рис.4.2):
(див. рис.4.2):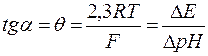 .
.  (4.7)
(4.7)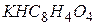 ), рН= 4,01;
), рН= 4,01;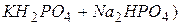 , рН=6,86;
, рН=6,86;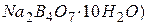 , рН=9,18.
, рН=9,18.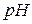 проб води за допомогою іономіра лабораторного І -160 М.
проб води за допомогою іономіра лабораторного І -160 М. 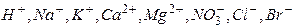 тощо.
тощо.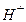 ,
, 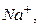
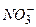 тощо). При вимірюванні рН слід вибрати
тощо). При вимірюванні рН слід вибрати 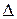 рН= ± 0,3 іЕ= ± 25 мВ.
рН= ± 0,3 іЕ= ± 25 мВ.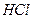 (конц.).
(конц.).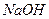 (ч.д.а.).
(ч.д.а.).


