Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема. Арены. Бензол. Химические свойства бензола. Применение бензола на основе свойств.
Цель: сформировать представление обучающихся о строении бензола, познакомить с его физическими и химическими свойствами, способами получения и рассмотреть применение бензола.
Задание1. Ознакомьтесь с теоретическим материалом занятия. Составить опорный конспект, используя различные источники литературы и интернет ресурсы по плану: 1.Дать общее понятие арены. (Указать общую формулу). 2.Особенности строения аренов. 3.Физические свойства аренов. 4.Номенклатура и изомерия. 5.Химические свойства аренов. 7.Применение.
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей. Общая формула: CnH2n–6 при n ≥ 6.
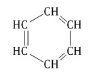
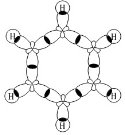
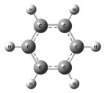
Строение аренов В молекуле бензола присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н. Структурная формула бензола:
Сокращенная структурная формула бензола:
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp 2 -гибридизации. Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 120 0:
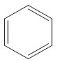
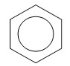
Атомы углерода и водорода в молекуле бензола, соединенные σ-связями, образуют правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости. Негибридные р-орбитали атомов углерода образуют единую циклическую (ароматическую) π-систему – единое электронное облако над и под плоскостью кольца. Все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь ). Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы). Поэтому структурную формулу бензола изображают в виде правильного шестиугольника и кружка внутри него, который обозначает делокализованные π-связи:
Гомологический ряд аренов Простейший представитель гомологического ряда аренов — бензол:
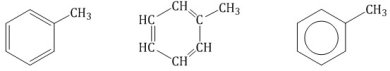
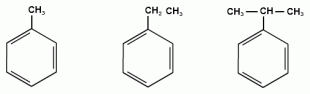
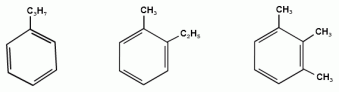
Ближайший гомолог бензола – толуол (метилбензол):
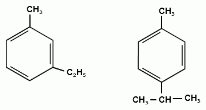
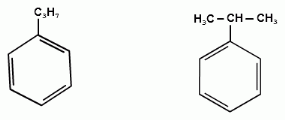
Еще один представитель гомологического ряда бензола – этилбензол:
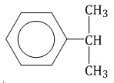
Изопропилбензол (кумол):
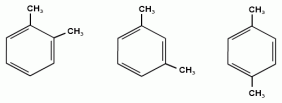
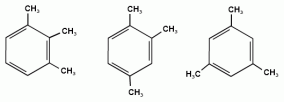
Номенклатура аренов При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
метилбензол этилбензол изопропилбензол
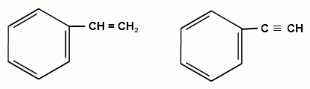
винилбензол этинилбензол
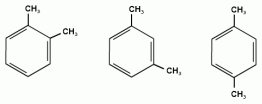
В случае двух одинаковых заместителей вместо цифр можно пользоваться приставками: 1,2- (орто-), 1,3- (мета-), 1,4- (пара-). 1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол мета — (м-) заместители расположены через один атом углерода (1,3-положения); пара — (п-) заместители расположены на противоположных сторонах кольца (1,4-положения).
1-метил-3-этилбензол 1-метил-4-изопропилбензол
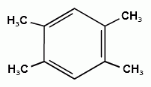
1,2,3-триметилбензол 1,2,4-триметилбензол 1,3,5-триметилбензол
Изомерия аренов пропилбензол изопропилбензол 3) Изомерия, зависящая от положения заместителей в цикле: 1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол
Физические свойства аренов Бензол – бесцветная легкоподвижная жидкость с характерным запахом. Бензол хорошо растворяется в спирте и эфире. В воде бензол малорастворим и как более легкая жидкость всплывает наверх. Бензол является хорошим растворителем. Температура замерзания бензола +5,5 °С. Арены - это обычно жидкости и реже твердые вещества с сильным специфическим запахом. В ряду гомологов бензола каждая новая группа СН2 повышает температуру кипения на 300 С. Химические свойства Бензол не обесцвечивает при обычных условиях бромную воду и раствор перманганата калия. 1.Горение (полное): 2C6H6 + 15O2 На воздухе бензол горит сильно коптящим пламенем из-за неполного сгорания. C6H5—CH3 + 3[O] Замещение:
б) нитрование: C6H6 + HONO2
У гомологов бензола галогенирование на свету приводит к замещению атомов водорода в радикале. C6H5—CH3 + Cl2 Присоединение:
б) галогенирование
Получение Ароматические углеводороды нефтяного происхождения (содержащиеся в природной нефти и образующиеся во вторичных процессах термокаталитической переработки фракций нефти) являются основным исходным сырьем для огромного числа нефтехимических производств получения ценных продуктов.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 237; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.121.131 (0.012 с.) |
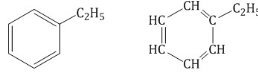
 12CO2 + 6H2O
12CO2 + 6H2O C6H5—COOH + H2O
C6H5—COOH + H2O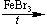
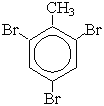
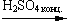 C6H5—NO2 + H2O (смесь орто- и пара- изомеров)
C6H5—NO2 + H2O (смесь орто- и пара- изомеров)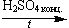
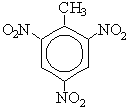
 C6H5—CH2Cl + HCl
C6H5—CH2Cl + HCl