
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 2. Органическая химияСтр 1 из 9Следующая ⇒
РАЗДЕЛ 2. ОРГАНИЧЕСКАЯ ХИМИЯ Тема1. Основные понятия органической химии и теория строения органических соединений. Тема. Предмет органической химии. Теория строения органических соединений А.М.Бутлерова. Цель: сформировать представление о составе и строении органических соединений, их отличительных признаках; выявить причины многообразия органических веществ; научить составлять структурные формулы органических веществ; сформировать представление об изомерии и изомерах. Интернет-ресурсы:https://resh.edu.ru/subject/lesson/6149/conspect/ 1.Предмет органической химии. До начала 19-века все известные вещества делили по их происхождению на две группы: вещества минеральные и вещества органические. Многие ученые тех времен считали, что органические вещества могут образоваться только в живых организмах при помощи "жизненной силы". Такие взгляды назывались виталистическими. Большой удар взглядам виталистов нанес немецкий химик Ф. Велер. Он первые получил органические вещества из неорганических: в 1824 г. – щавелевую кислоту, а в 1828 г. – мочевину. Щ. к. встречается в растениях, а мочевина образуется в организме человека и животных. Большинство неорганических веществ немолекулярного строения, и поэтому они обладают высокими температурами плавления и кипения. Органические вещества, как правило, молекулярного строения, и поэтому они имеют низкие температуры плавления. В состав молекул всех органических веществ входит углерод. Органическая химия - это раздел химической науки, в котором изучаются соединения углeрода - их строение, свойства, способы получения и практического использования. Соединения, в состав которых входит углерод, называются органическими. Кроме углерода, они почти всегда содержат водород, довольно часто - кислород, азот и галогены, реже - фосфор, серу и другие элементы. Однако сам углерод и некоторые простейшие его соединения, такие как оксид углерода (II), оксид углерода (IV), угольная кислота, карбонаты, карбиды и т.п., по характеру свойств относятся к неорганическим соединениям. Поэтому часто используется и другое определение: Органические соединения - это углеводороды (соединения углерода с водородом) и их производные. Благодаря особым свойствам элемента углерода, органические соединения очень многочисленны. Сейчас известно свыше 10 миллионов синтетических и природных органических веществ, и их число постоянно возрастает.
Углерод Символ С, элемент IVA группы 2-го периода; порядковый номер 6; атомная масса 12,01115. 1) соединяться друг с другом в цепи различного строения: открытые (неразветвленные, разветвленные), замкнутые: 2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи: 3) образовывать прочные связи почти с любым другим элементом. Эти уникальные свойства углерода объясняются сочетанием двух факторов: · наличие на внешнем энергетическом уровне (2 s и 2 p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов); · малый размер атома (в сравнении с другими элементами IV группы). Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4. Органические соединения Критерием деления соединений на органические и неорганические служит их элементный состав. К органическим соединениям относятся химические вещества, содержащие в своем составе углерод, например:
Органические соединения отличаются от неорганических рядом характерных особенностей: · почти все органические вещества горят или легко разрушаются при нагревании с окислителями, выделяя СО2 (по этому признаку можно установить принадлежность исследуемого вещества к органическим соединениям); · в молекулах органических соединений углерод может быть соединен почти с любым элементом Периодической системы; · органические молекулы могут содержать последовательность атомов углерода, соединенных в цепи (открытые или замкнутые); · молекулы большинства органических соединений не диссоциирует на достаточно устойчивые ионы; · реакции органических соединений протекают значительно медленнее и в большинстве случаев не доходят до конца;
· среди органических соединений широко распространено явление изомерии; · органические вещества имеют более низкие температуры фазовых переходов (т.кип., т.пл.)
Значение органической химии Органическая химия имеет исключительно важное познавательное и народнохозяйственное значение. Природные органические вещества и их превращения лежат в основе явлений Жизни. Поэтому органическая химия является химическим фундаментом биологической химии и молекулярной биологии - наук, изучающих процессы, происходящие в клетках организмов на молекулярном уровне. Исследования в этой области позволяют глубже понять суть явлений живой природы. Множество синтетических органических соединений производится промышленностью для использования в самых разных отраслях человеческой деятельности. Сырьевыми источниками органических соединений служат: нефть и природный газ, каменный и бурый угли, горючие сланцы, торф, продукты сельского и лесного хозяйства.
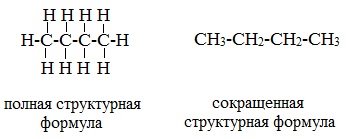
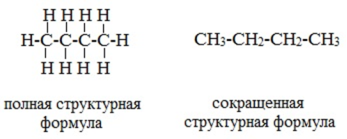
2. Теория химического строения органических соединений Основные положения теории химического строения органических соединений были сформулированы профессором Казанского университета А. М. Бутлеровым в 1861 г. Современная теория строения позволяет предсказывать основные химические и физические свойства органических соединений, исходя из их химического, пространственного и электронного строения. Формулы строения Формула строения (структурная формула) описывает порядок соединения атомов в молекуле, т.е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными). Например, полная и сокращенная структурные формулы н -бутана C4H10 имеют вид:
Структурные формулы отличаются от молекулярных (брутто) формул, которые показывают только, какие элементы и в каком соотношении входят в состав вещества (т.е. качественный и количественный элементный состав), но не отражают порядка связывания атомов.
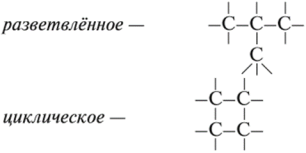
В состав углеродных цепочек может входить разное число атомов углерода: от одного до нескольких тысяч. Кроме того, цепочки могут иметь разное строение:
Между атомами углерода могут возникать химические связи разного типа:
Задание 1. Попробуйте составить 2–3 цепочки атомов углерода иного строения из пяти атомов углерода.
Задание2. Среди следующих соединений найдите изомеры:
Задание3. Среди следующих соединений найдите изомеры:
Из положения теории строения органических соединений Бутлерова следует, что вещества, имеющие похожее (сходное) строение молекул, должны иметь и похожие (сходные) свойства. Органические соединения, которые имеют похожее строение, а, значит, и похожие свойства, образуют гомологические ряды. Например, углеводороды, в составе молекул которых есть только одна двойная связь, образуют гомологический ряд алкенов:
Углеводороды, в молекулах которых имеются только простые связи, образуют гомологический ряд алканов:
Реакции разложения В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ: А→ В + С +... К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов: CnH2n+2→ CmH2m+2 + CpH2p (n = m + p) Например: C10H22→ C5H12 + C5H10 Реакции разложения при высокой температуре называют пиролизом, Например: СН4 → C + 2H2 пиролиз метана (1000 oC)
Гомологический ряд метана Гомологи — вещества, сходные по строению и свойствам и отличающиеся на одну или более групп -СН2.
Изомерия и номенклатура Для алканов характерна структурная изомерия – изомерия углеродного скелета. Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкан, для которого характерны структурные изомеры, — это бутан. Основы номенклатуры Правила номенклатуры (названий) органических соединений были приняты в 1965 году. Они называются правилами ИЮПАК (IUPAC). За основу названий органических соединений принимаются названия гомологов-алканов: СН4 — МЕТ ан, C2H6 — ЭТ ан, С3Н8 — ПРОП ан, С4Н10 — БУТ ан и тд. В этих названиях КОРНИ слов (полужирный шрифт) — мет-, эт-, проп- и так далее — указывают на число атомов углерода в цепи: МЕТ — 1 атом углерода, ЭТ — 2 атома углерода, ПРОП — 3 атома углерода и так далее. Суффикс в названии указывает на характер (тип) связей. Так, суффикс -ан- показывает, что все связи между атомами углерода простые. Выбор главной цепи. Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
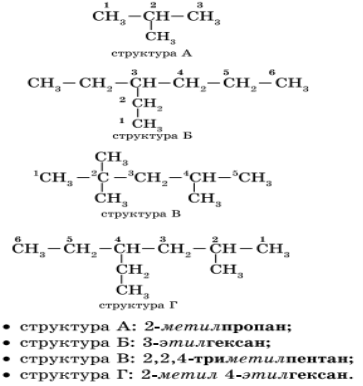
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—СН3), затем этил (-СН2-СН3), пропил (-СН2-СН2-СН3) и т. д. Названия радикалов предельных углеводородов имеют суффикс -ил-:
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан СН4, этан С2Н6, пропан C3H8, бутан С4Н10, пентан С5Н12, гексан С6Н14, гептан C7H16, октан C8H18, нонан С9Н20, декан С10Н22).
Физические свойства алканов зависят от их состава и строения. Агрегатное состояние: С1- С4 – газы, С5 – С15 – жидкости, С16 – и выше твердые вещества. Простейшие и высшие не имеют запаха, жидкие обладают специфическим запахом. Плотность углеводородов нормального строения возрастает в гомологическом ряду, но не больше 1. Температура кипения и температура плавления увеличивается с увеличением молярной массы. Температура кипения углеводородов изостроения ниже, чем углеводородов нормального строения. Алканы не растворяются в воде, но хорошо растворяются в органических растворителях и сами являются хорошими растворителями. Легко горят.
Получение алканов Для получения алканов используют в основном природные источники. Газообразные алканы получают из природного и попутных нефтяных газов, а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск — природный битум. 1. Из простых веществ: n C + 2 n Н2 500 °С, кат → С n Н2 n + 2
2. Действие металлического натрия на галогенопроизводные алканов— реакция А.Вюрца: 2CH3-Cl + 2Na → CH3-CH3 + 2NaCl 3. Электролиз солей карбоновых кислот (реакция Кольбе) 2СН3-СН2-СООNa+2Н2О → СН3СН2СН2СН3+Н2+2СО2+2NaOH 4. Реакция Дюма (сплавление солей карбоновых кислот с твердыми щелочами):
5. Гидролиз карбида алюминия
Al4C3+12H2O → 4Al(OH)3+3CH4 Химические свойства алканов Для предельных углеводородов характерны реакции: разложения, замещения, окисления. 1. Реакции замещения - Галогенирование (стадийно) CH4 + Cl2 hν → CH3Cl(хлорметан) + HCl (1 стадия); метан CH3Cl + Cl2 hν → CH2Cl2 (дихлорметан)+ HCl (2 стадия); СH2Cl2 + Cl2 hν → CHCl3 (трихлорметан)+ HCl (3 стадия); CHCl3 + Cl2 hν → CCl4 (хлорметан)+ HCl (4 стадия). 2. Реакции горения (горят светлым не коптящим пламенем) CnH2n+2 + O2 t→ nCO2 + (n+1)H2O
Горение метана
Реакции разложения а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи: C10H22 → C5H12 + C5H10 Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены. Крекинг бывает термический и каталитический. Термический крекинг протекает при сильном нагревании без доступа воздуха. Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия). б) Пиролиз при температуре 1000°С разрываются все связи, продукты – С (сажа) и Н2: СH4 1000°С→ C + 2H2
Применение Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека. Использование в качестве топлива – в котельных установках, бензин, дизельное топливо, авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит. Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров. Метан используется для производства шин и краски. Значение алканов в современном мире огромно. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Велико значение в медицине, парфюмерии и косметике.
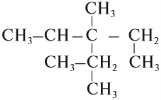
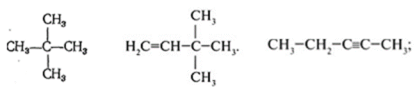
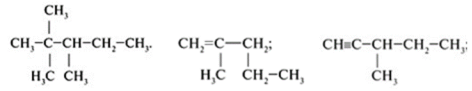
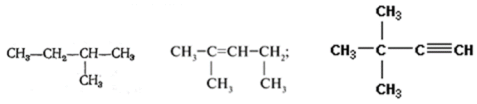
Задание 2. Назвать углеводород:
Задание3. Составить графическую формулу углеводорода: 3,3-диметилбутан; 2,2,4 – триметилпентана. Задание 4. Составьте графические формулы всех изомеров гептана. Назовите эти изомеры. Задание 5. Приведите названия предельных углеводородов, которые имеют следующие формулы:
Задание 6. Бензин представляет собой смесь алканов с числом атомов углерода от 5 до 9. Составьте их молекулярные формулы. Задание 7. Составьте молекулярные формулы веществ.
Тема. Алкены. Этилен, его получение (дегидрированием этана, деполимеризацией полиэтилена). Гомологический ряд, изомерия, номенклатура алкенов. Цель: дать представление о непредельных углеводородах, о ненасыщенной (кратной) связи; о строении молекулы этилена – первого представителя ряда алкенов, о физических свойствах веществ этого ряда, их номенклатуре и изомерии. Интернет-ресурсы: https://portal.tpu.ru/SHARED/e/ELINE/academic/PCMI/up1.pdf Задания для самостоятельной работы Задание1. Ознакомьтесь с теоретическим материалом занятия. Составить опорный конспект, используя различные источники литературы и интернет ресурсы по плану: 1.Дать понятие непредельные углеводороды. Алкены. (Указать общую формулу). 2.Особенности пространственного и электронного строения алкенов. 3.Физические свойства алкенов. 4.Гомологический ряд алкенов. 5.Номенклатура и изомерия. 6. Химические свойства алкенов. 7.Способы получения алкенов. 8.Применение этилена и его соединений.
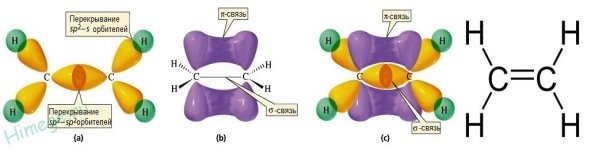
К непредельным относят углеводороды, содержащие в молекулах кратные 0связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов. Строение алкенов Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n. Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел. Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Гомологический ряд этена Неразветвленные алкены составляют гомологический ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен, С7Н14 — гептен и т.д. Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2. Изомерия алкенов Для алкенов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения двойной связи) и пространственная изомерия.. Простейший алкен, для которого характерны структурные изомеры — это бутен:
Алкены изомерны циклоалканам (межклассовая изомерия), например:
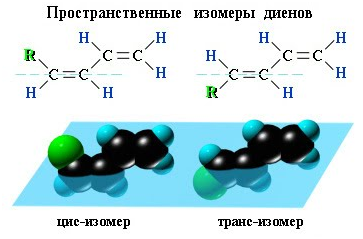
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- и транс-изомерии.
Номенклатура алкенов 1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
5-метилгексен-2 Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
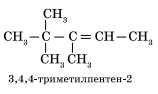
3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов. Например:
Физические свойства алкенов Физические свойства алкенов в основном сходны с соответствующими свойствами алканов. Алкены, в составе которых до пяти атомов углерода, при стандартных условиях — газы, с пентена до гексадекена —жидкости, с гексадекена С16Н32 — при стандартных условиях —твердые вещества. Газы и жидкости — бесцветны. Газы не имеют запаха, у жидкостей — нерезкий запах. Этилен — газ без цвета и запаха, немного легче воздуха. В гомологическом ряду алкенов с увеличением молекулярной массы наблюдается увеличение температур кипения, плавления и плотности. Алкены нерастворимы в воде и полярных жидкостях, растворяются в неполярных растворителях (бензин, бензол, толуол и др.). Химические свойства алкенов Реакции присоединения. Отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
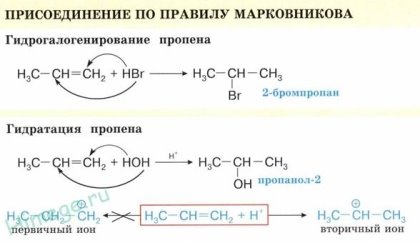
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование. 2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов. С2Н4+Br2=C2H4Br2 3. Гидрогалогенирование (присоединение галогеноводорода).
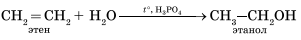
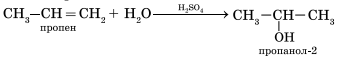
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
Первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
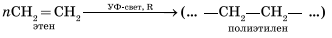
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному. Особым случаем присоединения является реакция полимеризации алкенов:
2.Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Применение Благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ, поэтому в качестве горючего они не используются. Этилен находится в больших количествах в коксовых газах и газах очистки нефтеперерабатывающих установок и выделяется оттуда путем низкотемпературной перегонки. Все увеличивающаяся потребность в этом исходном продукте тяжелого органического синтеза может быть, однако, удовлетворена лишь путем высокотемпературного пиролиза этана и других алканов при 800 — 9000С. Подходящим методом получения этилена в лаборатории является дегидратация этилового спирта под действием концентрированной серной кислоты и нагревании до 1700С. Этилен представляет собой бесцветный, почти нерастворимый в воде газ, горящий светящимся пламенем и образующий с воздухом взрывчатые смеси. Этилен используют для получения этилового спирта, уксусного альдегида, винилхлорида и стирола, но главным образом для производства полиэтилена. Хлорированием этилена получают важнейший растворитель 1,2-дихлорэтан, гидрохлорированием — средство для анестезии — хлорэтан. Пропилен выделяют из газов нефтепереработки и в больших количествах используют для получения изопропилового спирта, аллилхлорида (3-хлорпропена) и полипропилена.
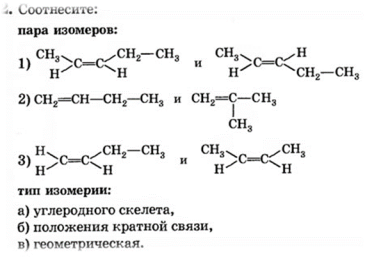
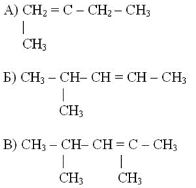
Задание 1. Изомерами углеродного скелета являются:
Задание2. Соотнесите: тип углеводорода: 1) алканы, 2) алкены формула: а) С5Н12, б) С11Н24, в) С7Н14, г) С2Н6, д) С8Н16, е) С4Н8. Определите название веществ.
Задание3.
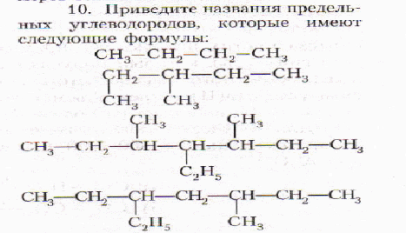
Задание4. Дайте названия следующим углеводородам по систематической номенклатуре:
г) СН3 — СН — СН2 — СН2 — СН = СН2 │ С2Н5
д) СН3—СН2—СН2—С = СН—СН3 │ СН3 СН3 │ е) СН3—С—СН=СН—СН2—СН3 │ СН3
ж) СН3 — СН — СН = С — СН3 │ │ СН3 СН2— СН3
з) СН2= СН— СН — СН2— СН— СН3 │ │ СН2— СН2— СН3 СН2— СН3 СН2— СН3 │ и) СН3 — СН — СН2 — СН = СН — СН2— СН— СН3 │ СН3
Задание 5. Напишите структурные формулы следующих алкенов: а) 3-метилпентен-1 б) 2-метил - 4-этилгексен-2 в) 2,2-диметил-3-этилгептен-3
Классификация алкадиенов В зависимости от взаимного расположения двойных связей диены подразделяются на три типа: 1.углеводороды с кумулированными двойными связями, т.е. примыкающими к одному атому углерода. Например, пропадиен CH2=C=CH2 2. углеводороды с изолированными двойными связями, т.е разделенными двумя и более простыми связями. Например, пентадиен -1,4 CH2=CH–CH2–CH=CH2 3. углеводороды с сопряженными двойными связями, т.е. разделенными одной простой связью. Например, бутадиен -1,3 или дивинил CH2=CH–CH=CH2 Наибольший интерес представляют углеводороды с сопряженными двойными связями. К наиболее известным представителям сопряженных диенов относятся: бутадиен-1,3 (дивинил), 2-метилбутадиен-1,3 (изопрен), 2-хлорбутадиен-1,3 (хлоропрен).
Изомерия сопряженных диенов Структурная изомерия 1. Изомерия положения сопряженных двойных связей:
2. Изомерия углеродного скелета:
3. Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6 соответствуют следующие соединения:
Пространственная изомерия Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис - транс -изомерию.
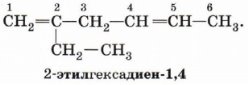
Номенклатура Номенклатура. Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна.
В названии соответствующего алкана окончание -ан заменяется на - диен. Физические свойства Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется в эфире, бензоле, не растворяется в воде.
Получение алкадиенов 1.Дегидрирование алканов: CH3—CH2—CH2—CH3 2.Дегидратация и дегидрирование этанола (метод С. В. Лебедева; только для бутадиена):
Применение В промышленности диены используют для получения синтетического каучука. Углеводороды, содержащие две и более двойные связи в молекуле – терпены – широко распространены в растительных организмах, часто обладают приятным запахом. Смеси терпенов используют в производстве духов и ароматических отдушек, а также в медицине. Жизненно важен для человека b-каротин, который превращается в организме в витамин А, он содержится в красных и желтых плодах. Красный цвет b-каротина обусловлен длинной цепочкой сопряженных двойных связей.
Задание2. Из перечня формул, приведенных ниже, выберите формулы, соответствующие алкадиенам: С4Н6,С8Н16, С9Н16, С7Н16,С7Н12,С5Н10,С4Н8 Дать названия веществам, построить структурные формулы. Задание 3. Составьте молекулярные формулы алкадиенов, в молекулах которых число атомов углерода равно: 6; 8;12 Постройте структурные формулы. Задание4. Назовите алкадиены, формулы которых: а) СН2=С(СН3)-С(СН3)=СН2 б) СН2=С=СН-СН(СН3)-СН3 в) СН2=СН-СН(СН3)-СН2-СН=СН2 г) СН3-СН(С2Н5)-СН(С2Н5)-СН=СН-СН=СН2 д) СН3 –С (СН3) = СН- С (СН3) = СН2 е) СН3 - СН2 - С (СН3) = СН – СН2 - С (СН3) =СН - СН3 Определите к какому типу алкадиенов относится каждое из веществ? Задание5 Напишите формулы всех изомерн
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 578; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.61.119 (0.318 с.) |
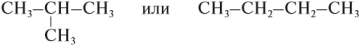

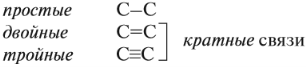
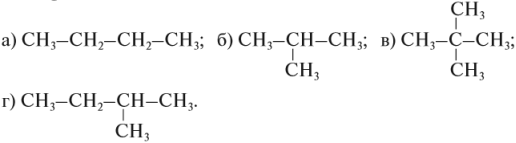
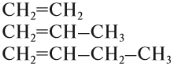 и так далее.
и так далее.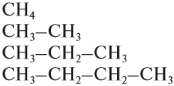 и так далее.
и так далее.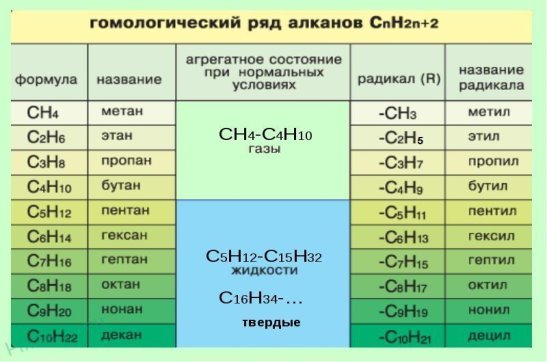
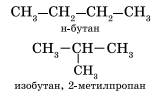
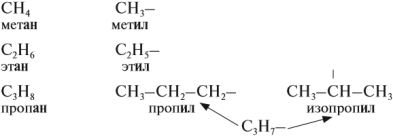

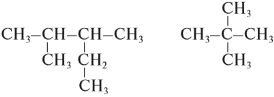


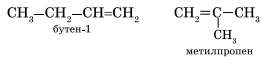
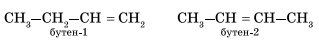
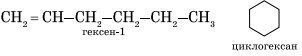

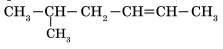
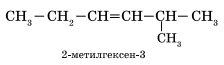

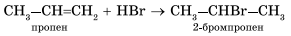
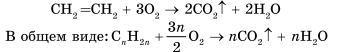
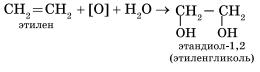

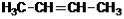
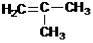
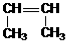
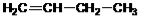
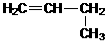
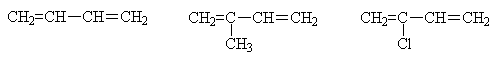
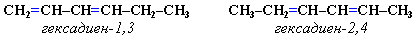
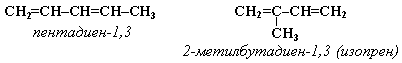
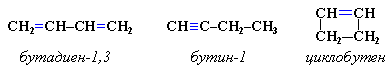
 CH2=CH—CH=CH2 +2H2
CH2=CH—CH=CH2 +2H2 CH2=CH—CH=CH2 +2H2O + H2
CH2=CH—CH=CH2 +2H2O + H2


