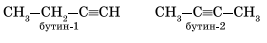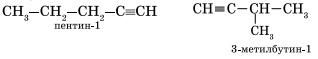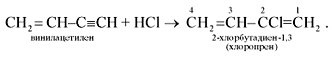Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема. Алкины. Ацетилен. Химические свойства ацетилена. Применение ацетилена на основе свойств.
Цель: изучить общую формулу, номенклатуру, физические свойства представителей гомологического ряда алкинов, их строение, химические свойства первого представителя гомологического ряда алкинов - ацетилена, применение. Интернет-ресурсы: http://school-collection.edu.ru/catalog/rubr/4842a792-b504-427a-53c5-c94cd3e47e34/45283/?interface=pupil&class=53&subject=31 Задания для самостоятельной работы Задание1. Ознакомьтесь с теоретическим материалом занятия. Составить опорный конспект, используя различные источники литературы и интернет ресурсы по плану: 1.Дать общее понятие об алкинах. (Указать общую формулу). 2.Особенности строения алкинов. 3.Физические свойства алкинов. 4.Номенклатура и изомерия. 5.Химические свойства алкинов. 7.Применение.
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С. Алкины образуют гомологический ряд с общей формулой СnН2n-2.
Строение Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов. Молекулярная формула ацетилена C2H2 Структурная формула ацетилена H–C≡C–H Электронная формула H: С ::: С: Н Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp -гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s - и p -орбитали. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p -орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется σ-связь. Остальные две гибридных орбитали перекрываются с s -орбиталями атомов H, и между ними и атомами С тоже образуются σ -связи. Четыре негибридных p -орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям σ-связей. В этих плоскостях p -орбитали взаимно перекрываются, и образуются две π -связи, которые относительно непрочные и в химических реакциях легко разрываются. Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ - и двух π -связей. Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
Физические свойства С2Н2 – Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха. Свойства гомологов изменяются аналогично алкенам. По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами.
Изомерия и номенклатура Для алкинов характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин (С4Н6):
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
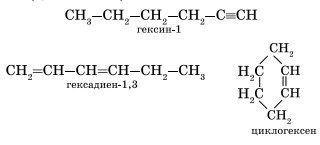
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу С6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
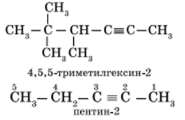
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом — ин, а ее положение в цепи — номером атома углерода. Например:
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH-C- называется «этинил». Гомологический ряд Гомологический ряд Этин:C2H2
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью. I. Реакции присоединения 1)Галогенирование – стадийно, до производных алканов: (как и алкены обесцвечивают бромную воду!) СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен) CHBr=CHBr + Br2 → CHBr2—CHBr2 (1,1,2,2-тетрабромэтан) Гидрогалогенирование (труднее, чем у алкенов) – стадийно:
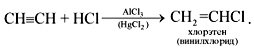
CH3-C≡CH + HBr AlBr3 → CH3-CBr=CH2 2-бромпропен — используется правило Морковникова 3)Гидратация – (р. М.Г. Кучерова) CH≡CH + H2O Hg2+,H+ → [CH2=CH-OH] → CH3-CH=O (уксусный альдегид) непредельный спирт – енол протекает в присутствии солей ртути(II) – HgSO4, Hg(NO3)2 – с образованием уксусного альдегида.
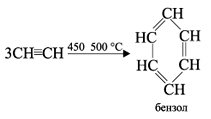
Полимеризация В определенных условиях ацетилен способен полимеризоваться в бензол и винилацетилен. 1. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, образуя винилацетилен:
Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
|
||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 263; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.30.162 (0.012 с.) |