Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
АМКы, строение, классификация. Цвиттер –ионыСтр 1 из 21Следующая ⇒
Свойства белков. Белки, как и АМКы, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. Физико-химические свойства белков: – кислотно-основными;– буферными;– осмотическими- Белки в клетке, межклеточной жидкости, в крови повышают осмотическое давление и вызывают явление осмоса, т.е. перемещение ионов Nа+ и воды через мембраны в раствор белка. – оптическими - Растворы белков способны рассеивать лучи видимого света (эффект дифракции или явление Тиндаля). На этом основан метод количественного определения белка рефрактометрически (в чистых белковых растворах, напр, в сыворотке крови); – растворимостью;– осаждаемостью;– денатурацией. Для обнаружения белка в растворе, для разделения белковых фракций, а также для получения безбелковых фильтратов пользуются реакциями осаждения. Используют различные агенты, снижающие заряд белковой частицы. Процесс денатурации белка сводится к разрушению нативной вторичной и третичной структуры белка, при этом белковая молекула, как правило, теряет свои биологические свойства. 2. Осаждение белка при нагревании. Почти все белки денатурируют при нагревании (50—55° С и выше). Механизм тепловой денатурации связан с перестройкой структуры белковой молекулы, в результате которой белок теряет свои нативные свойства, уменьшается его растворимость (уменьшение гидрофильных свойств ведет к нарушению гидратной оболочки). 3. Осаждение белка концентрированными минеральными к-тами. 5. Осаждение белка алкалоидными реактивами. 6. Осаждение белка солями тяжелых металлов. Белки, обладающие кислыми свойствами, осаждают в слабокислой среде, белки, обладающие щелочными свойствами,— в слабощелочной среде. 4. Осаждение белка органическими к-тами. Свойства растворов белков. Водные растворы белков являются устойчивыми и равновесными, они со временем не коагулируют и не требуют присутствия стабилизаторов. Поскольку белковые растворы гомогенны, то напоминают истинные растворы, однако высокая молекулярная масса белков придает их растворам свойства коллоидных систем: 1. Оптические свойства белков. Растворы белков способны рассеивать лучи видимого света (эффект дифракции или явление Тиндаля). На этом основан метод количественного определения белка рефрактометрически (в чистых белковых растворах, напр, в сыворотке крови).
2. Малая скорость диффузии – способствует равномерному распределению белков внутри клетки, между клеткой и кровью, а также препятствует скоплению белка в местах его биосинтеза. 3. Осмотические свойства белков. Белки в клетке, межклеточной жидкости, в крови повышают осмотическое давление и вызывают явление осмоса, т.е. перемещение ионов Nа+ и воды через мембраны в раствор белка. Неспособность белков проникать через полупроницаемые мембраны вследствие высокой молекулярной массы используется в практике для очистки белков от низкомолекулярных примесей (солей, биогенных аминов, мочевины и др.) – процесс диализа. 4. Высокая вязкость белковых растворов. С увеличением концентрации белка вязкость раствора повышается, поскольку повышаются силы сцепления между поверхностями белковых молекул. Иногда вязкость белкового раствора в присутствии Са2+ настолько увеличивается, что он теряет текучесть и превращается в гель. 5. Способность белков к образованию гелей Для обнаружения белка в растворе, для разделения белковых фракций, а также для получения безбелковых фильтратов пользуются реакциями осаждения. Используют различные агенты, снижающие заряд белковой частицы. Процесс денатурации белка сводится к разрушению нативной вторичной и третичной структуры белка, при этом белковая молекула, как правило, теряет свои биологические свойства. 2. Осаждение белка при нагревании. Почти все белки денатурируют при нагревании (50—55° С и выше). Механизм тепловой денатурации связан с перестройкой структуры белковой молекулы, в результате которой белок теряет свои нативные свойства, уменьшается его растворимость (уменьшение гидрофильных свойств ведет к нарушению гидратной оболочки). 3. Осаждение белка концентрированными минеральными к-тами. 5. Осаждение белка алкалоидными реактивами. 6. Осаждение белка солями тяжелых металлов. Белки, обладающие кислыми свойствами, осаждают в слабокислой среде, белки, обладающие щелочными свойствами,— в слабощелочной среде. 4. Осаждение белка органическими к-тами.
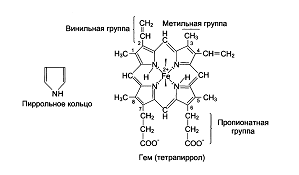
Хромопротеиды. Гемоглобин. Хромопротеины (от греч. chroma – краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (простетическая группа- железо), магнийпорфирины и флавопротеины (содержат производные изоаллоксазина). Ф-ии хромопротеинов: они участвуют в таких фундаментальных процессах жизнедеятельности, как фотосинтез, дыхание клеток и целостного организма, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето-и цветовосприятие и др. Хромопротеины являются участниками аккумулирования энергии, начиная от фиксации солнечной энергии в зеленых растениях и утилизации ее до превращений в организме животных и человека. Гемоглобин - сложный белок, хромопротеид, дыхательный пигмент крови человека, позвоночных и некоторых беспозвоночных животных. Основная ф-я перенос О2 от органов дыхания к тканям. Его форма в р-ре близка к эллипсоиду. Нb А1 имеет четвертичную структуру. Глобин - это белковая часть, состоящая из 4-х субъединиц, а каждая из субъединиц обозначается α, β. Всего 2 α-цепи, содержащие по 141 АМКному остатку и 2 β- по 146 АМК. Вторичные их структуры представлены в виде спиральных сегментов различной длины. Третичные структуры α- и β-цепей очень сходны. Внутри каждой субъединицы имеется гидрофобный "карман", в котором удерживается гем. Гем - это тетрапиррольное соединение с атомом Fе+2, соединенного с азотами пирролов, 5-я связь с имидазольным кольцом гистидина глобина. Шестая координационная связь Fе+2 свободна и используется для связывания кислорода и других лигандов.
Водорастворимые витамины. 1. ВитB1 (тиамин, аневрин). Его хим стр-ра хар-тся наличием аминной группы и атома серы. Наличие спиртовой группы в вите B1 дает возможность образовывать с к-тами сложные эфиры. Соединяясь с двумя молекулами фосфорной кислоты, тиамин образует сложный эфир тиаминдифосфат, который является коферментом декарбоксилаз, катализирующих декарбоксилирование a-кетокислот. При отсутствии или недостаточном поступлении в организм вита B1 становится невозможным осуществление углеводного обмена. 2. Вит В2 (рибофлавин). В организме рибофлавин в виде сложного эфира с фосфорной кислотой входит в состав простетической группы флавиновых ферментов (ФМН, ФАД), катализирующих процессы биологического окисления, обеспечивая перенос водорода в дыхательной цепи, а также реакции синтеза и распада жирных кислот. 3. Вит В3 (пантотеновая к-та). Пантотеновая к-та построена из b-аланина и диоксидиметилмасляной кислоты, соединенных пептидной связью. Биол значение: она входит в состав кофермента А, играющего огромную роль в обмене углеводов, жиров и белков. 4. Вит B6 (пиридоксин). Является производным пиридина. Фосфорилированное производное пиридоксина является коферментом ферментов, катализирующих реакции обмена АМК. 5. Вит B12 (кобаламин). В его состав, входит, четыре пиррольных кольца. В центре находится атом кобальта, связанный с азотом пиррольных колец. Виту B12 принадлежит большая роль в переносе метильных групп, а также синтезе нуклеиновых кислот. 6. Вит РР (никотиновая к-та и ее амид). Представляет собой производное пиридина. 7. Фолиевая к-та (Вит Вс). Выделена из листьев шпината (латинское folium -лист). В состав фолиевой кислоты входит парааминобензойная к-та и глютаминовая к-та. Ей принадлежит важная роль в обмене нуклеиновых кислот и синтезе белка. 8. Пара-аминобензойная к-та. Ей принадлежит большая роль в синтезе фолиевой кислоты. 9. Биотин (вит Н). Входит в состав фермента, катализирующего процесс карбоксилирования (присоединения CO2 к углеродной цепи). Необходим для синтеза жирных кислот и пуринов. 10. Вит С (аскорбиновая к-та). По хим структуре аскорбиновая к-та близка к гексозам. Особенностью является его способность к обратимому окислению с образованием дегидроаскорбиновой кислоты. Аскорбиновая к-та принимает участие в окислительно-восстановительных процессах организма, предохраняет от окисления SH-группы ферментов, обладает способностью обезвоживать токсины.
Активность ферментов. Активный центр – это относительно небольшой участок, расположенный в узком гидрофобном углублении (щели) поверхности молекулы фермента, непосредственно участвующий в катализе. Активный центр – это точная пространственная организация больших ансамблей, построенных из АМКных остатков: серин – ОН группа; цистеин – SH группа; лизин – NH2 группа; гистидин – имидазольное кольцо; глутаминовая, аспарагиновая кислоты – СООН группа.Активный центр включает субстратсвязывающий участок, который отвечает за специфическое комплементарное связывание субстрата, и каталитический участок непосредственного химического взаимодействия.В активный центр сложных ферментов входит участок для связывания кофактора. Регуляторные (аллостерические) ферменты помимо активного центра имеют аллостерический центр. К аллостерическому центру могут присоединяться гормоны или продукты реакции. Это приводит к изменению структуры активного центра. Эти вещества называются аллостерическими эффекторами (модификаторами). Эффекторы могут быть положительными (усиливают действие фермента) и отрицательными (блокируют действие фермента).
Неконкурентное торможение. Ингибитор – это вещество, вызывающее специфическое снижение активности фермента. По прочности связывания ингибитора с ферментом ингибиторы делят на: 1)Необратимые ингибиторы прочно связаны и разрушают функциональные группы молекулы фермента, которые необходимы для проявления его каталитической активности. Хлорофос, зарин, зоман и др. фосфорорганические соединения связываются с активным центром холинэстеразы. В результате происходит фосфорилирование каталитических групп активного центра фермента. В следствии молекулы фермента, связанные с ингибитором, не могут связываться с субстратом и наступает тяжелое отравление. 2)Обратимые игнибиторы, напр, прозерин для холинэстеразы. Обратимое ингибирование зависит от концентрации субстрата и ингибитора и снимается избытком субстрата. По механизму действия выделяют: 1) Конкурентное (изостерическое) ингибирование – это торможение ферментативной реакции, вызванное связыванием ингибитора с активным центром фермента. При этом ингибитор имеет сходство с субстратом. В процессе происходит конкуренция за активный центр: образуются фермент-субстратные и ингибитор-ферментные комплексы. Пр.: фермент холинэстераза катализирует превращение ацетилхолина в холин: (CH3)3-N-CH2-CH2-O-CO-CH3® (над стрелкой ХЭ, под – вода) CH3СOOH+(CH3)3-N-CH2-CH2-OH. Конкурентными ингибиторами явл прозерин, севин. 2) Неконкурентное ингибирование – торможение, связанное с влиянием ингибитора на каталитическое превращение, но не на связывание фермента с субстратом. В этом случае ингибитор может связываться и с активным центром (каталитический участок) и вне его. Присоединение ингибитора вне активного центра приводит к изменению конформации (третичной структуры) белка, вследствие чего изменяется конформация активного центра. К ним относят:- цианиды. Они связываются с атомом железа в цитохромоксидазе и в результате этого фермент теряет свою активность, а т.к. это фермент дыхательной цепи, то нарушается дыхание клеток и они гибнут.- ионы тяжёлых металлов и их органические соединения (Hg, Pb и др.). Соединяются с различными SH-группами. - ряд фармакологических средств, которые должны поражать ферменты злокачественных клеток. 3) Субстратное ингибирование(бесконкурентное) – торможение ферментативной реакции, вызванное избытком субстрата. Происходит в результате образования фермент-субстратного комплекса, неспособного подвергаться каталитическому превращению.
Переваривание, основные ферменты. Образование мочевой кислоты.
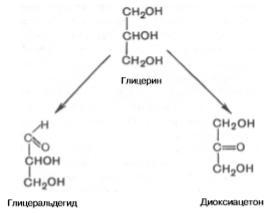
Моносахариды. Моносахариды представляют собой альдегидные или кетоновые производные полигидроксиспиртов, содержащих как минимум три атома углерода. Моносахариды различают по положению их функциональной карбонильной группы (альдегиды или кетоны) и по числу атомов углерода, которое они содержат. Если карбонильная группа в составе моносахарида связана с атомом C1, такой моносахарид называютальдозой. Если же карбонильная группа связана с атомом C2, то —кетозой. Примеры альдоз: эритроза, рибоза, глюкоза, манноза, галактоза. Примеры кетоз: рибулоза, ксилулоза, фруктоза. Самые простые моносахариды — триозы (глицеральдегид — альдотриоза, дигидроксиацетон — кетотриоза).Четырёх-,пяти-,шести- и семиуглеродистые моносахариды называют тетрозами,пентозами,гексозами игептозами, соответственно. Моносахариды можно рассматривать как производные многоатомных спиртов, содержащие карбонильную (альдегидную или кетонную) группу. Если карбонильная группа находится в конце цепи, то моносахарид представляет собой альдегид и называется альдозой; при любом другом положении этой группы моносахарид является кетоном и называется кетозой. Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетон. При окислении первичной спиртовой группы трехатомного спирта – глицерола – образуется глицеральдегид (альдоза), а окисление вторичной спиртовой группы приводит к образованию диоксиацетона (кетоза).
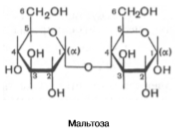
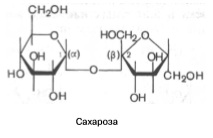
Стереоизомерия моносахаридов. Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдотетрозы – 2, альдопентозы – 3, альдогексозы – 4 и т.д. Кетозы содержат на один асимметричный атом меньше, чем альдозы с тем же числом углеродных атомов. Следовательно, кетотриоза диоксиацетон не содержит асимметричных атомов углерода. Все остальные моносахариды могут существовать в виде различных стереоизомеров. Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n, где N – число стереоизомеров, а n – число асимметричных атомов углерода. Как отмечалось, глицеральдегид содержит только один асимметричный атом углерода и поэтому может существовать в виде двух различных стереоизомеров. Изомер глицеральдегида, у которого при проекции модели на плоскость ОН-группа у асимметричного атома углерода расположена с правой стороны, принято считать D-глицеральдегидом, а зеркальное отражение – L-глицеральдегидом: Альдогексозы содержат четыре асимметричных атома углерода и могут существовать в виде 16 стереоизомеров (24), представителем которых является, напр, глюкоза. Для альдопентоз и альдотетроз число стереоизомеров равно соответственно 23 = 8 и 22 = 4. Все изомеры моносахаридов подразделяются на D- и L-формы (Dи L-конфигурация) по сходству расположения групп атомов у последнего центра асимметрии с расположением групп у D- и L-глицеральдегида. Природные гексозы: глюкоза, фруктоза, манноза и галактоза – принадлежат, как правило, по стереохимической конфигурации к соединениям D-ряда. в растворе в основном существуют в полуацетальных формах. Полуацетальный гидроксил отличается большей реакционной способностью. природные моносахариды обладают оптической активностью. Дисахариды. Дисахариды – сложные сахара, каждая молекула которых при гидролизе распадается на две молекулы моносахаридов. По строению дисахариды – это гликозиды, в которых 2 молекулы моносахаридов соединены гликозидной связью. мальтоза, лактоза и сахароза. Мальтоза, являющаяся α-глюкопиранозил-(1–>4)-α-глюкопиранозой, образуется как промежуточный продукт при действии амилаз на крахмал (или гликоген), содержит 2 остатка α-D-глюкозы
В молекуле мальтозы у второго остатка глюкозы имеется свободный полуацетальный гидроксил. Такие дисахариды обладают восстанавливающими свойствами. Одним из наиболее распространенных дисахаридов является сахароза – обычный пищевой сахар. Молекула сахарозы состоит из одного остатка D-глюкозы и одного остатка D-фруктозы. Следовательно, это α-глюкопиранозил-(1–>2)-β-фруктофуранозид:
В отличие от большинства дисахаридов сахароза не имеет свободного полуацетального гидроксила и не обладает восстанавливающими свойствами. Гидролиз сахарозы приводит к образованию смеси, В этой смеси преобладает сильно левовращающая фруктоза, которая инвертирует (меняет на обратный) знак вращения правовращающего раствора исходной сахарозы. Дисахарид лактоза содержится только в молоке и состоит из D-галактозы и D-глюкозы.
Полисахариды. Полисахариды — или гликаны — состоят из моносахаридов, связанных между собой гликозидными связями. Полисахариды в отличие от белков и нуклеиовых кислот образуют разветвлённые и линейные полимерные структуры. Это связано с тем, что гликозидные связи могут образовываться между любыми гидроксильными группами моносахаридов. Олигосахариды, содержащие три и более моносахаридных остатков, относительно редки и обнаруживаются чаще всего в клетках растений. Дисахариды — простейшие полисахариды — распространены гораздо больше. Многие из них образуются при расщеплении крупных полисахаридов. Дисахарид лактоза содержится в молоке в концентрации0–7%.Самым распространённым дисахаридом является сахароза (столовый сахар). Примерами структурных полисахаридов явл целлюлоза и хитин. Клеточная стенка клеток растений содержит в качестве основного компонента целлюлозу. Это позволяет растениям выдерживать значительную разницу в осмотическом давлении между внеклеточной и внутриклеточной средой вплоть до 20 атм. Целлюлоза представляет собой линейный полимер длиной до 15 000 остатковD-глюкозы,связанных между собой с помощью β(1→4)-гликозидныхсвязей.
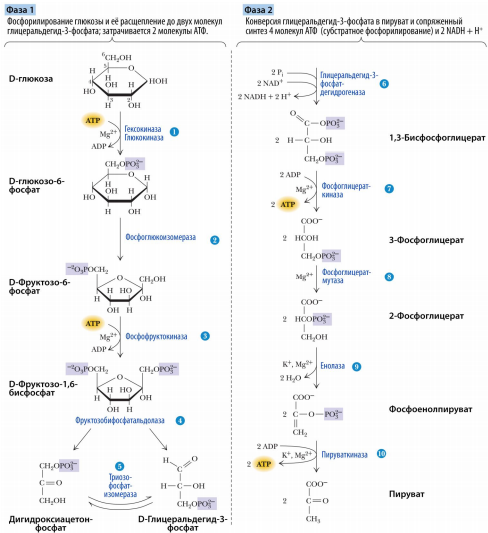
Гликолиз, 1,2 этапы.
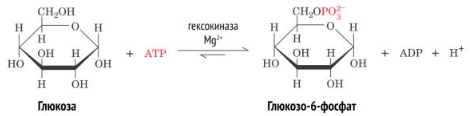
БУравнения реакций 1.Глюкоза + АТФ Глюкозо-6-фосфат+ АДФ + H+
В первой реакции происходит перенос остатка фосфорной кислоты с АТФ на
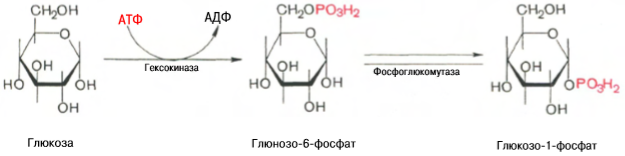
молекулу глюкозы. Эту реакцию катализирует фермент гексокиназа. Помимо глюкозы гексокиназа фосфорилирует и другие моносахариды: маннозу, фруктозу. В печени присутствует изоферментглюкокиназа, который катализирует ту же реакцию, однако имеет более высокую константу Михаэлиса. Это значит, что его сродство к глюкозе ниже, чем у гексокиназы. Кофактором в реакции служатионы магния Mg2+. Они нейтрализуют отрицательный заряд двух остатков фосфорной кислоты в молекуле АТФ. 11.
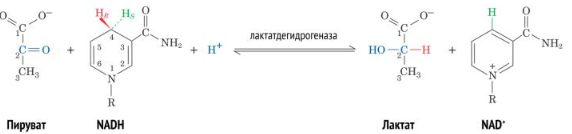
Одиннадцатая реакция гликолиза протекает только в анаэробных условиях. В ходе неё пируват восстанавливается с помощью NADH до лактата. Образуется окисленная форма NAD+. Смысл этой реакции заключается в восполнении клеточного пула NAD+. В отсутствии кислорода молекулы NADH, образующиеся в6-йреакции гликолиза, накапливаются. Но для того, чтобы гликолиз активно работал, необходимо, чтобы в клетке присутствовали окисленные молекулы NAD+, поскольку именно они служат коферментом в 6 реакции (NADH эту роль выполнять не способен). Т.е. отсутствие этой реакции попросту невыгодно для клетки и её энергетического баланса.
Синтез гликогена. Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени – и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фосфат
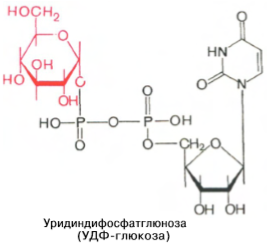
Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглюкозу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорилаза): Глюкозо-1-фосфат + УТФ <=> УДФ-глюкоза + Пирофосфат. Приводим структурную формулу УДФ-глюкозы:
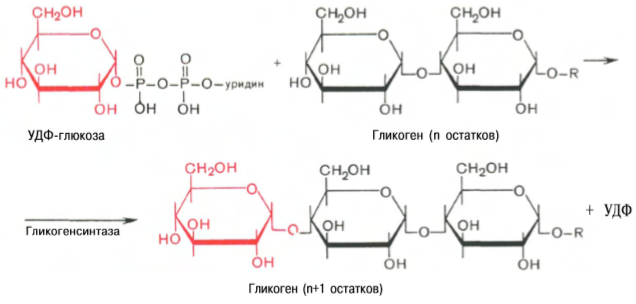
На второй стадии – стадии образования гликогена – происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество). При этом образуется α-(1–>4)связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментом гликогенсинтазой. Необходимо еще раз подчеркнуть, что реакция, катализируемая гликогенсинтазой, возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глюкозы.
Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
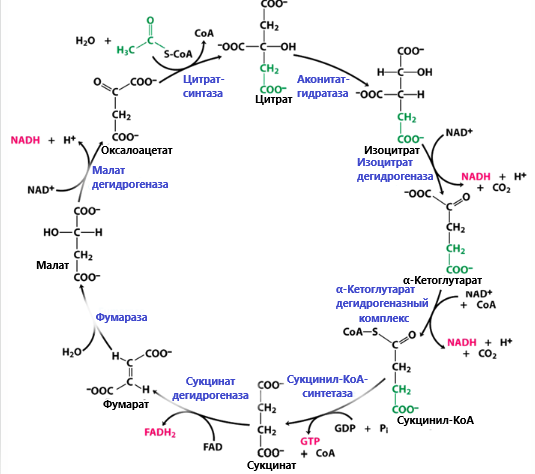
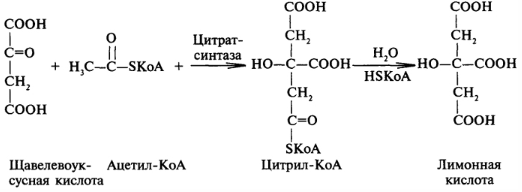
Цикл Кребса.
1. Конденсация Ацетил-Коэнзима А и Щавелево-Уксусной кислоты ➙ лимонная к-та. Превращение Ацетил-Коэнзима А берут начало с конденсации со Щавелево-Уксусной кислотой, в результате образуется лимонная к-та. Реакция не требует расхода АТФ, так как энергия для этого процесса обеспечивается в результате гидролиза тиоэфирной связи с Ацетил-Коэнзимом А, которая является макроэргической:
Глюконеогенез.
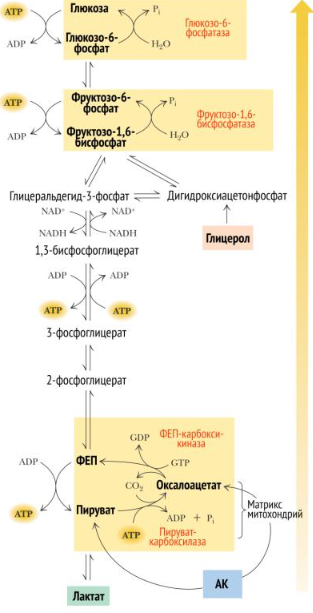
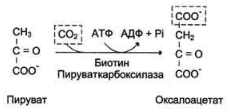
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами явл в первую очередь молочная и пировиноградная кислоты, так называемые гликогенные АМКы, глицерол и ряд других соединений. Иными словами, предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот. 1.Пируват + АТФ + HCO3— + H2O Оксалоацетат + АДФ + Фн + 2H+ (× 2) Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых АМК, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата.
2.Оксалоацетат + ГТФ Фосфоенолпируват + ГДФ + CO2 (× 2) Затем оксалоацетат в результате декарбоксилирования и фосфорилирования под влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ):
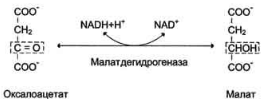
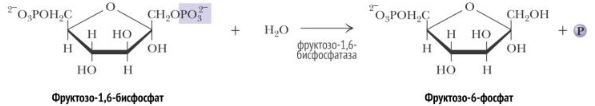
Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма. В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD+. Обе реакции: восстановление оксалоацетата и окисление малага катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором - цитозольный. Образованный в цитозоле из ма-лата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой - ГТФ-зависимым ферментом. 3.Фосфоенолпируват + H2O2-Фосфоглицерат (× 2) 4.2-Фосфоглицерат3-Фосфоглицерат (× 2) 5.3-Фосфоглицерат+ АТФ1,3-Бисфосфоглицерат+ АДФ (× 2) 6.1,3-Бисфосфоглицерат+ NADH + H+ Глицеральдегид-3-фосфат+ NAD+ + Фн (× 2) 7.Глицеральдегид-3-фосфатДигидроксиацетонфосфат (× 2) 8.Дигидроксиацетонфосфат + Глицеральдегид-3-фосфатФруктозо-1,6-бисфосфат Эти реакции катализируются ферментами гликолиза, однако протекают не в прямом (для гликолиза), а в обратном направлении 9.Фруктозо-1,6-бисфосфат+ H2OФруктозо-6-фосфат+ Фн
10.Фруктозо-6-фосфатГлюкозо-6-фосфат 11.Глюкозо-6-фосфат+ H2O Глюкоза + Фн Остаток фосфорной кислоты и глюкоза переносятся обратно в цитозоль с помощью белков T3 и T2, соответственно. Далее свободная глюкоза выносится наружу из клетки белками ГЛЮТ2. Фермент этой реакции обнаружен лишь в печени, почках и тонком кишечнике, поэтому эти органы способны экспортировать глюкозу в кровь. Остальные клетки (не все) синтезируют глюкозу лишь для собственных нужд.
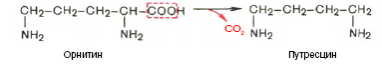
Патологи липидного обмена. Нормальное содержание общих липидов в сыворотке крови составляет 4-8 г/л. Увеличение общих липидов называется гиперлипемией. Переваривание белков в ЖКТ. В желудке имеются все условия для переваривания белков. Во-первых, в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная pH среды. Чистый желудочный сок имеет кислую среду (pH 0,9-1,6), а оптимум pH действия пепсина равен 1,5-2,5. Следует особо указать на существенную роль соляной кислоты в переваривании белков: она переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина, в присутствии свободной НС1 происходят набухание белков (увеличение поверхности соприкосновения фермента с субстратом), частичная денатурация и, возможно, гидролиз пищевых белков. Пепсин гидролизует преимущественно пептидные связи, образованные аминогруппами ароматических АМК (фенилаланин, тирозин). Он расщепляет практически все природные белки. Исключение составляют некоторые кератины, протамины, гистоны и мукопротеиды. Дальнейшее превращение белков пищи осуществляется в тонком кишечнике, где на белки действуют ферменты панкреатического и кишечного соков. В поджелудочной железе вырабатываются три белковых фермента: трипсин, химотрипсин и карбоксипептидаза. Первые два фермента действуют на белки аналогично пепсину, но в отличие от него они разрывают другие внутренние пептидные связи. Кроме того, они активны в слабощелочной среде (оптимум pH действия их составляет 7,2-7,8). Благодаря гидролитическому действию всех трех эндопептидаз (пепсина, трипсина, химотрипсина) на белки образуются различной длины пептиды и некоторое количество свободных АМК. Дальнейший гидролиз пептидов до свободных АМК осуществляется под влиянием группы ферментов - пептидаз. Продукты гидролиза белков всасываются в желудочно-кишечном тракте в основном в виде свободных АМК. Кинетика всасывания АМК в кишечнике в опытах in vivo и in vitro свидетельствует о том, что АМКы, подобно глюкозе, всасываются свободно с ионами натрия. 71.Превращение АМК в толстом кишечнике. Гниение! Часть аминокислот не всасывается и подвергается процессам гниения с участием микрофлоры в толстом кишечнике. Продукты гниения аминокислот могут всасываться и попадают в печень, где подвергаются реакциям обезвреживания. За счет деятельности микрофлоры толстого кишечника АМК подвергаются гниению с образованием ядовитых продуктов: при распаде серусодержащих АМК (цистина, цистеина и метионина) образуются H2S и метилмеркаптан (CH3SH). Диаминокислоты, в частности орнитин и лизин, подвергаются декарбоксилированию с образованием протеиногенных аминов (трупных ядов).
При разрушении фенилаланина, тирозина, триптофана, образуются соответствующие биогенные амины: фенилэтиламин, триптамин, серотонин. При разрушении этих же аминокислот могут образовываться крезол, фенол, скатол, индол, бензол.
Происходит это
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 275; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.6.114 (0.107 с.) |
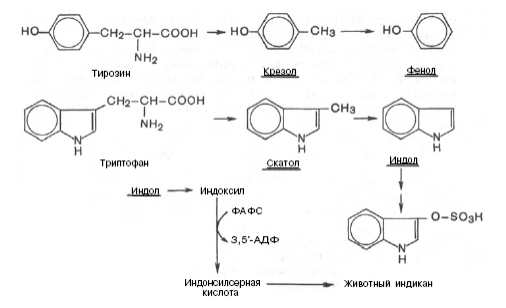
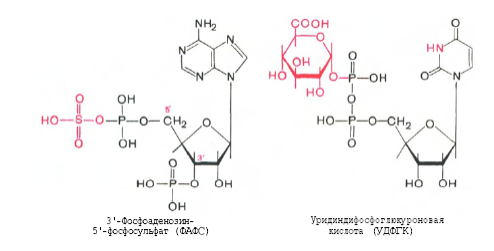
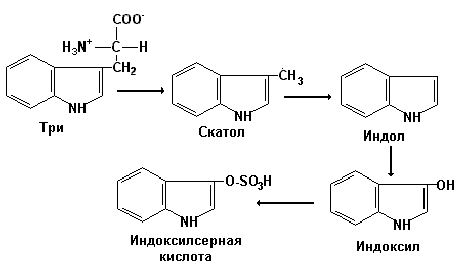 Все эти вещества гидрофобны и обладают мембранотропным действием (поражают мембраны клеток печени, эритроцитов, легких). Продукты распада аминокислот поступают в печень, где подвергаются детоксикации. В печени эти продукты обезвреживаются путем конъюгации с серной или глюкуроновой кислотой с образованием нетоксичных парных кислот (фенолсерная, скатоксилсерная).
Все эти вещества гидрофобны и обладают мембранотропным действием (поражают мембраны клеток печени, эритроцитов, легких). Продукты распада аминокислот поступают в печень, где подвергаются детоксикации. В печени эти продукты обезвреживаются путем конъюгации с серной или глюкуроновой кислотой с образованием нетоксичных парных кислот (фенолсерная, скатоксилсерная).