
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Н. В. Фирстова, Н. В. ВолковаСтр 1 из 8Следующая ⇒
Н. В. Фирстова, Н. В. Волкова ОРГАНИЧЕСКАЯ химия
Учебное пособие
Пенза Издательство ПГУ 2015
УДК 547 ББК 24.2 Р е ц е н з е н т ы: кандидат химических наук, доцент кафедры общей химии Химического факультета Московского государственного университета им. М. В. Ломоносова Э. Ю. Керимов кандидат химических наук, доцент кафедры общей и клинической фармакологии Медицинского института Пензенского государственного университета А.В. Кузнецова
Фирстова, Н. В. Органическая химия: учеб. пособие / Н. В. Фирстова, Н. В. Волкова. – Пенза: Изд-во ПГУ, 2015. – 134 с. Учебное пособие содержит материал для самостоятельной работы, подготовки к контрольным работам и зачету. Каждый параграф включает теоретическое введение, задачи для самостоятельного решения и руководство к выполнению лабораторных работ. Учебное пособие «Органическая химия» подготовлено на кафедре химии и теории и методики обучения химии ПГУ, предназначено для студентов заочного отделения нехимических специальностей, изучающих курс химии. УДК 547 ББК 24.2
© Пензенский государственный университет, 2015 ГЛАВА 2. Углеводороды § 2.1. Алканы Алканы (парафины) – это предельные углеводороды, углеродная цепь которых незамкнута и не содержит кратных (двойных и тройных) связей. · Общая формула: СnН2n+2, где n≥1 (гомологический ряд см. приложение, табл. 4). · Молярная масса: М = 14n+2. · Характерное окончание в названиях по номенклатуре ИЮПАК «ан». · Особенности строения молекул алканов: * длина связи С – С равна 0,154 нм; * длина связи С – Н равна 0,109 нм; * вид гибридизации каждого из атомов углерода – sp3; * валентный угол равен 1090 28′. · Виды изомерии (табл. 2): структурная (изомерия углеродного скелета) и пространственная конформационная. · Общая формула одновалентных алифатических радикалов (алкилов, R): – СnН2n+1, где n≥1. · Характерное окончание в названиях алкилов «ил». · Формулы и названия некоторых одновалентных радикалов представлены в табл. 4: Таблица 4. Формулы и названия предельных одновалентных радикалов
· Для алканов характерны реакции замещения, окисления, расщепления, изомеризации.
Задания для самостоятельной работы
1. Определите вид гибридизации углеродных атомов в молекулах этана и пентана, изобразите их пространственное строение. 2. Закончите следующие сокращённые структурные формулы веществ, дописав атомы водорода: С ― С ― С ― С; С ― С ― С ― С; С ― С; С ― С │ │ С С ― С Сколько веществ обозначено формулами? Назовите эти вещества по систематической номенклатуре. 3. Составьте структурные формулы всех изомеров н -гексана и н -пентана. Назовите их по систематической номенклатуре. Какие из них содержат третичные и четвертичные углеродные атомы? 4. Закончите формулы: а) С ― С ― С ― С; б) С ― С ― С; в) С ― С ― С ― С ― С; │ │ │ С С С С С │ │ г) С ― С ― С ― С ― С― С ― С; д) С ― С ― С; е) С ― С ― С ―С │ │ │ С С С Укажите изомеры среди веществ, формулы которых приведены выше, и назовите все вещества по систематической номенклатуре. 5. Составьте сокращённые структурные формулы следующих соединений: 2-метил-4-этилгептан, 3,3-диметил-5-пропилнонан, 3,3,6-триметил-5-этилоктан, 2,4-диметилгексан. 6. Какие галогеналканы должны быть использованы для получения бутана и гексана (по методу Вюрца)? Назовите их и напишите уравнения реакций.
7. Рассмотрите механизм реакции хлорирования этана. Назовите все вещества по систематической номенклатуре. 8. Напишите структурные формулы монохлорпроизводных, которые могут образоваться при хлорировании пропана, бутана и изобутана. Составьте соответствующие уравнения реакций. 9. Напишите уравнения реакций нитрования пропана и 3-метилпентана по Коновалову. Назовите полученные вещества. 10. Проведите реакции по схеме, назовите вещество Б:
Пропан ── Br 2 ─→ А ── 2 Na ─→ Б 11. Получите реакцией Вюрца следующие углеводороды: 12. В каких валентных состояниях находятся атомы углерода в
§ 2.2. Непредельные углеводороды Непредельными (олефинами) называются углеводороды, содержащие одну или несколько кратных (двойных или тройных) углерод-углеродных связей. Алкены Алкены – это непредельные углеводороды с одной двойной связью в молекулах. · Общая формула: СnН2n, где n≥2. · Молярная масса: М = 14n. · Характерное окончание в названиях по номенклатуре ИЮПАК «ен». · Особенности строения молекул алкенов: * содержат одну двойную связь, состоящую из одной σ- и одной π-связи; * длина связи С = С равна 0,134 нм; * вид гибридизации атомов углерода, соединённых двойной кратной связью – sp2, все остальные атомы углерода находятся в состоянии sp3-гибридизации; * валентный угол для атомов углерода в sp2-гибридизации равен 1200. · Виды изомерии (табл. 2): структурная (изомерия углеродного скелета, изомерия положения кратной связи, межклассовая с циклоалканами) и пространственная (конфигурационная, геометрическая: цис-, транс-). · Общая формула одновалентных радикалов: – СnН2n-1, где n≥2. · Характерное окончание в названиях одновалентных радикалов «ил» или «енил». · Формулы и названия некоторых непредельных одновалентных радикалов представлены в табл. 5: Таблица 5. Формулы и названия непредельных одновалентных радикалов
· Характерны реакции присоединения, окисления, полимеризации, замещения водорода при sp3-гибридном атоме при температуре выше 5000 С. · Качественная реакция – реакция с раствором перманганата калия и бромной водой (обесцвечивание растворов). Алкины Алкины – это непредельные углеводороды с одной тройной связью в молекулах. · Общая формула: СnН2n-2, где n≥2. · Молярная масса: М = 14n – 2. · Характерное окончание в названиях по номенклатуре ИЮПАК «ин». · Особенности строения молекул алкинов: * содержат одну тройную связь, состоящую из одной σ- и двух π-связей; * длина связи С ≡ С равна 0,120 нм; * вид гибридизации атомов углерода, соединённых тройной кратной связью – sp, все остальные атомы углерода находятся в состоянии sp3-гибридизации;
* валентный угол для атомов углерода в sp-гибридизации равен 1800. · Виды изомерии (приложение, таблица 10): структурная (изомерия углеродного скелета, изомерия положения кратной связи, межклассовая с диеновыми углеводородами). · Общая формула одновалентных радикалов: – СnН2n-3, где n≥2. · Характерное окончание в названиях одновалентных радикалов «инил», например, ─ С ≡ СН – этинил. · Характерны реакции присоединения, окисления, замещения водорода у алкинов-1, ди-, три- и полимеризации. · Качественная реакция – реакция с раствором перманганата калия и бромной водой (обесцвечивание растворов), образование ацетиленидов серебра и меди.
Задания для самостоятельной работы 13. Напишите структурную формулу алкена состава С6Н12, имеющего один четвертичный атом углерода и назовите его по систематической номенклатуре. Определите вид гибридизации всех углеродных атомов, изобразите молекулу одного из изомеров с использованием знания о гибридизации электронных облаков и определите, какие типы ковалентной химической связи в нём присутствуют. 14. Закончите формулы, назовите следующие углеводороды по систематической номенклатуре и составьте для каждого структурную формулу одного гомолога и по одному изомеру на каждый из видов изомерии алкенов: С ═С ―С ―С С ―С―С―С ═ С―С │ │ │ С ―С С С―С │ С 15. Какой простейший непредельный углеводород имеет цис- и транс-изомеры? Приведите примеры этих изомеров и назовите их по систематической номенклатуре. 16. Назовите вещество, углеродный скелет которого приведен ниже, по систематической номенклатуре. Составьте для него формулы изомеров, назовите их, определите вид гибридизации всех углеродных атомов. Каким углеродным атомом (первичным, вторичным, третичным, четвертичным) является углеродный атом, обозначенный звездочкой (*). С*– С – С ║ С – С – С 17. Для каких из приведенных ниже веществ возможна цис-, транс-изомерия:
а) СН3 – С = СН – СН3; б) СН3 – СН = СН – СНО; в) СН2 = СН – СН2ОН │ С2Н5
18. Возможна ли геометрическая изомерия: а) пентена-2; 19. Составьте структурные формулы 3-этилпентена-1, октена-2, гексадиена-1,4, метилциклогексана, 3,3,4-триметилпентена-1 и выберите среди этих веществ пары изомеров. 20. Среди перечисленных ниже веществ выберите а) изомеры, 21. Рассмотрите механизм реакции гидрогалогенирования пентена-1. 22. Рассмотрите механизм реакции гидратации 3-хлорбутена-1. 23. Рассмотрите механизм реакции гидрогалогенирования бутена-1 в присутствии пероксида водорода. 24. Определите массу вещества, полученного в результате реакции окисления (по Вагнеру) этилена, объёмом 100 мл. 25. При помощи каких реакций можно из пентена-1 получить 26. Назовите вещества, являющиеся продуктами реакций, поясните выбранный Вами ход реакций:
27. Составьте структурные формулы всех изомеров вещества состава С5Н8 и назовите их по систематической номенклатуре. Определите вид гибридизации всех углеродных атомов, изобразите молекулу одного из изомеров с использованием знания о гибридизации электронных облаков и определите, какие типы ковалентной химической связи в нём присутствуют. 28. Осуществите цепочки превращений (формулы веществ записывайте в структурном виде): а) бутан → 2-хлорбутан → бутен-2 → бутанол-2 → бутен-2; ↓ ↓ ↓ изобутан 2-хлорбутан 2,3-дихлорбутан б) бутин-2 → 2-хлорбутен-2 29. В каких валентных состояниях находятся атомы углерода в пропине. Приведите графическую схему гибридных орбиталей атома углерода в этом соединении с учетом их пространственного строения. Обозначьте вид каждой связи (σ, π). 30. Назовите вещество, углеродный скелет которого приведен ниже, по систематической номенклатуре. Составьте для него формулы изомеров, назовите их, определите вид гибридизации всех углеродных атомов. Каким углеродным атомом (первичным, вторичным, третичным, четвертичным) является углеродный атом, обозначенный звездочкой (*). С– С* – С ≡ С – С │ С 31. Осуществите предложенную схему превращений, назовите полученные углеводороды: С – С – С ─+Вr2(1 моль), hν→ А ─+2Na, t→ В ─+Вr2(2 моль), hν→ С ─+2КОН (спирт.)→ D 32. Определите массу вещества, полученного в результате реакции гидратации пропина массой 33 г.
33. Осуществите предложенную схему превращений, назовите полученные углеводороды, рассмотрите подробно механизм 1-ой реакции: С – С – С ═ С ─+НВr→А ─+КОН (сп.)→В ─+Вr2→ С ─+КОН (сп.)→D ─+Н2О (Нg2+, Н+)→ Е 34. Определите массу вещества, полученного при взаимодействии ацетилена с аммиачным раствором хлорида меди (I) ([Cu(NH3)2]Cl) массой 20 г. 35. Осуществите предложенную схему превращений, назовите полученные углеводороды, рассмотрите подробно механизм 3-ей реакции: С – С – С─+Вr2,hν→ А ─+ КОН (сп.), t→ В ─+ Вr2→ С ─+2КОН(сп.),t→ D ─[Ag(NH3)2]OH → Е
§ 2.3. Ароматические углеводороды (арены) Ароматические углеводороды – это углеводороды, в молекулах которых имеется одно или несколько бензольных колец с насыщенными или ненасыщенными радикалами в боковой цепи. · Общая формула аренов, содержащих одно бензольное кольцо и алифатические радикалы в боковой цепи: СnН2n-6, где n≥6. · Молярная масса: М = 14n – 6. · Особенности строения молекул аренов: * атомы углерода в бензольном ядре находятся в состоянии sp2-гибридизации; * негибридизованные р-орбитали атомов углерода располагаются перпендикулярно плоскости кольца и перекрываются, образуя единое кольцевое шестиэлектронное облако, называемое ароматической электронной системой; * длина связи между атомами углерода, образующими бензольное кольцо, равна 0,139 нм; * валентный угол между связями атомов углерода, образующих кольцо, равен 1200. · Общая формула одновалентных ароматических радикалов (арилов, Ar): – СnН2n-7, где n≥6. · Характерное окончание в названиях одновалентных радикалов «ил». · Формулы и названия некоторых ароматических одновалентных радикалов приведены в табл. 6: Таблица 6. Формулы ароматических одновалентных радикалов
· Характерны реакции замещения атомов водорода в бензольном кольце (S Е -механизм) и боковой цепи (SR -механизм), присоединения (в жёстких условиях), окисления (для гомологов бензола).
Задания для самостоятельной работы 36. Определите массовую долю углерода в гексане, гексене-1, 37. Напишите структурные формулы гомологов бензола состава С8Н10. Назовите их. 38. Как получить бензол, исходя из метана? Составьте уравнения реакций и укажите условия их осуществления. 39. Как распознать на основе химических свойств три жидкости: бензол, гексан и гексен? 40. Какое вещество образуется в результате следующих превращений: Бензол ─+ CH3Br (AlBr3)→ А ─+ HNO3, H2SO4→ В ─+Fe (HCl)→ С 41. Как применяется вещество, образующееся в результате следующих превращений: Бензол ─ этилен (Н+)→ А ─Br2 (hυ)→ Б ─ КOH(спирт. р-р)→ В 42. Как применяется вещество, образующееся в результате следующих превращений: Бензол ─Пропилен (Н+)→ А ─О2→ Б ─H2SO4, t→ В ─р-р NaOH→ Г 43. В соответствии с предложенной схемой осуществите превращения и напишите уравнения реакций:
Лабораторная работа № 1 Предельные спирты Одноатомные предельные спирты – это производные предельных углеводородов, содержащие в молекулах одну гидроксильную группу – ОН. · Общая формула: СnН2n+1–ОН, где n≥1. · Молярная масса: М = 14n+18. · Характерное окончание в названиях по номенклатуре ИЮПАК «ол». · Основные виды изомерии (табл. 2): структурная (изомерия углеродного скелета, изомерия положения функциональной группы – ОН, межклассовая с простыми эфирами). · Характерны реакции замещения группы ОН (SN -механизм), отщепления (элиминирования), замещения водорода (кислотные свойства), окисления.
Фенолы Фенолы – это производные ароматических углеводородов, содержащие гидроксильную группу у атома углерода бензольного кольца. Фенолы нельзя называть ароматическими спиртами. Ароматические спирты – это производные ароматических углеводородов, содержащие гидроксильную группу в боковой цепи (радикале). · Общая формула фенолов: СnН2n-7 – ОН или Ar – ОН, где n≥6. · Молярная масса: М = 14n+10. · Основные виды изомерии (табл. 2): структурная (изомерия положения функциональных групп – ОН у гомологов фенола, межклассовая с ароматическими спиртами для гомологов фенола). · Характерны реакции замещения водорода в бензольном кольце (SE-механизм), замещения водорода в функциональной группе ОН (кислотные свойства). · Качественная реакция с раствором хлоридом железа (III) – образуется комплексное соединение фиолетового цвета. Задания для самостоятельной работы 61. Напишите структурные формулы изомерных ароматических соединений состава: а) С6Н6О2; б) С6Н6О3. Назовите их. 62. Напишите уравнение реакции получения фенола из бензола (кумольный метод). 63. Какое соединение образуется при действии разбавленной азотной кислоты на фенол? Напишите уравнение реакции. 64. Пикриновую кислоту – 2,4,6-тринитрофенол (D) часто получают согласно следующей схеме, напишите уравнения реакций и назовите все промежуточные продукты: бензол Сl2(1 моль), Fe→А—HNO3(2 моль), H2SO4→В —Na2CO3(вод.)→С —HNO3(1 моль), H2SO4→D. Лабораторная работа № 2 Вывод: Опыт 7. Восстановление гидроксида меди. Реактивы и оборудование: 2 н. раствор гидроксида натрия, 0,2 н. раствор сульфата меди (II), вода, 40 % формальдегид, пробирки Канна, спиртовка, пробиркодержатель. Ход работы: поместить в пробирку пять капель воды, 6 капель 2 н. раствора гидроксида натрия и добавить 1 каплю 0,2 н. раствора сульфата меди (II). Наблюдаем _______________________. К выпавшему осадку прибавить 3 капли 40 %-го формальдегида и взболтать раствор. Нагреть верхнюю часть полученной смеси до кипения (не кипятить) При этом отмечаем _________________________. Уравнение реакции имеет вид (расставьте коэффициенты и отметьте цвет получаемых осадков): Сu(OH)2 ↓ + HCНО —t→ HCOOH + CuOH + H2O СuOH ↓—t→ Сu2O + H2O Вывод: § 3.2. Предельные карбоновые кислоты, сложные эфиры, жиры Сложные эфиры, жиры Сложные эфиры – это продукты взаимодействия (реакция этерификации) карбоновых кислот (неорганических кислот) со спиртами (одноатомными и многоатомными) в кислой среде. · Общая формула сложных эфиров RСООR′ (R – атом водорода или радикал, R′ – радикал). · · Основные виды изомерии: структурная (изомерия углеродного скелета в R и R′, межклассовая с карбоновыми кислотами с тем же числом атомов углерода). · Номенклатура: название состоит из названия радикала R′ и кислотного остатка. · Сложные эфиры, образованные глицерином и карбоновыми кислотами, – это триглицериды. · Триглицериды, образованные карбоновыми кислотами нормального строения с числом атомов углерода от 8 до 24, – это жиры. · Выделяют животные жиры (жиры, содержащие преимущественно остатки насыщенных кислот: стеариновой С17Н35СООН, пальмитиновой С15Н31СООН, миристиновой С13Н27СООН) и растительные жиры (жиры, содержащие преимущественно остатки ненасыщенных кислот: олеиновой С17Н33СООН, линоленовой С17Н29СООН, линолевой С17Н31СООН). · Характерны реакции: гидролиза (в кислой и щелочной среде), аммонолиза, алкоголиза (переэтерификации).
Задания для самостоятельной работы 71. Напишите структурные формулы изомерных карбоновых кислот с общей формулой С5Н10О2 и назовите их по систематической номенклатуре. 72. Как, исходя из карбида кальция, получить уксусную кислоту? 73. Напишите уравнения реакций между: а) пропионовой кислотой и оксидом кальция; б) масляной кислотой и метиловым спиртом; 74. Какими химическими и физическими методами можно различить уксусную и муравьиную кислоту? 75. Каково строение кислоты состава С5Н10О2, если известно, что хлор в реакцию с этой кислотой не вступает? 76. Напишите структурные формулы изомерных сложных эфиров с общей формулой С4Н8О4 и назовите их. 77. Имея этиловый спирт и необходимые неорганические вещества, получите этилацетат. 78. Рассмотрите механизм реакции этерификации, приводящей к образованию: а) метилового эфира уксусной кислоты; б) этилового эфира муравьиной кислоты. 79. Осуществите цепочку превращений, назовите все вещества по систематической номенклатуре: 1,2-дихлорпропан ─+Zn→ А ─+HCl→ Б ─+KOH(вод.)→ B ─+СН3СООН, Н+→ Г 80. Имея пропионовую кислоту и неорганические вещества, получите: хлорангидрид, ангидрид и амид пропионовой кислоты. 81. Карбоновую кислоту, полученную при окислении 2 моль этаналя, растворили в 100 г воды. Какова массовая доля карбоновой кислоты в этом растворе? 82. Приведите уравнение реакции взаимодействия олеиновой кислоты с бромной водой. Охарактеризуйте олеиновую кислоту с позиции всех признаков классификации карбоновых кислот. 83. Составьте схему щелочного гидролиза тристеарина.
Лабораторная работа № 3 Вывод: Опыт 3. Взаимодействие уксусной кислоты с оксидом меди (II). Реактивы и оборудование: оксид меди (II), уксусная кислота, спиртовка, пробирка, пробиркодержатель. Ход работы: к 0,2 г оксида меди (II), помещённого в пробирку, приливают 1-2 мл уксусной кислоты, затем осторожно нагревают в пламени спиртовки. При этом наблюдаем________________________. Уравнение реакции имеет вид:
Вывод: Опыт 4. Получение уксусноэтилового эфира. Реактивы и оборудование: этиловый спирт, уксусная кислота, концентрированная серная кислота, вода, насыщенный раствор хлорида натрия, пробирки, две пробки с воздушными холодильниками, водяная баня. Ход работы: в две пробирки поместить по 2 мл этилового спирта и по 2 мл уксусной кислоты. Во вторую пробирку добавить 0,5 мл концентрированной серной кислоты. Закрыть пробирки пробками с воздушными холодильниками, встряхнуть их и поместить в горячую (60-700С) водяную баню на 5 мин. Охладить обе пробирки в холодной воде и добавить в каждую по 2 мл воды, а затем по 3 мл насыщенного раствора хлорида натрия. Отмечаем запах _______, А во второй пробирке __________________________________________. Уравнение реакции имеет вид:
Вывод: Опыт 6. Определение непредельности растительного масла реакцией с бромной водой. Реактивы и оборудование: подсолнечное масло, бромная вода (насыщенная), пробирки. Ход работы: в пробирку внести 0,5 мл растительного масла и 1-2 мл насыщенной бромной воды, которая при встяхивании содержимого пробирки ____________________ вследствие присоединения брома к остаткам непредельных жирных кислот: СН2 – О – СО – (СН2)7 – СН = СН – (СН2)7 – СН3 │ СН – О – СО – (СН2)7 – СН = СН – (СН2)7 – СН3 + 2 Br2 → │ СН2 – О – СО – (СН2)14 – СН3 Пальмитодиолеин
→
Лабораторная работа № 4 Вывод:
Опыт 3. Гидролиз (инверсия) сахарозы. Реактивы и оборудование: 1 %-й раствор сахарозы, 10 %-й раствор серной кислоты, сухой гидрокарбонат натрия, реактив Фелинга, пробирка, пробиркодержатель, спиртовка. Ход работы: в пробирку наливают 3 мл 1 % раствора сахарозы и приливают 10 %-й раствор серной кислоты. Полученный раствор кипятят в течение 1-2 мин, затем охлаждают и нейтрализуют сухим гидрокарбонатом натрия (Осторожно!!! Жидкость вспенивается из-за выделяющегося СО2). После нейтрализации приливают равный объём реактива Фелинга и нагревают верхнюю часть жидкости до начинающегося кипения. При этом окраска реакционной смеси _______________________________________. Уравнение реакции гидролиза сахарозы имеет вид:
Вывод: Опыт 4. Взаимодействие крахмала с йодом. Реактивы и оборудование: 1 % раствор крахмального клейстера, раствор йода, пробирка, пробиркодержатель, спиртовка. Ход работы: в пробирку налить 1 мл 1 % раствора крахмального клейстера и добавить 1-2 капли раствора йода. При этом появляется____________________. Нагреваем полученную смесь, наблюдаем _____________________________________. При дальнейшем охлаждении окраска ______________________________. Схематично взаимодействие йода с крахмалом имеет вид:
Вывод: § 4.2. Аминокислоты Аминокислоты – это производные алифатических или ароматических углеводородов, содержащие одновременно амино (–NH2) и карбоксильную (–СООН) группы. · В зависимости от положения аминогруппы (у α-, β-, γ- углеродного атома) выделяют α-, β-, γ-аминокислоты. · Белки образованы остатками α-аминокислот. · Общая формула α-аминокислот: NH2 – СН(R) – СООН. · Виды изомерии: структурная (изомерия углеродного скелета, изомерия положения аминогруппы) и пространственная (оптическая для α-аминокислот). · Аминокислоты – это амфотерные соединения: основные свойства обусловлены наличием аминогруппы, кислотные – наличием карбоксильной группы. * в кислой среде аминокислоты – катионы; * в щелочной – анионы; * в нейтральной среде аминокислоты существуют в виде биполярных (или цвиттер) ионов, т. е. ионов, имеющих два полюса (+) и (–): NH2 – СН(R) – СООН <=> +NH3 – СН(R) – СОО–.
Задания для самостоятельной работы 96. Составьте формулы и назовите аминокислоты, изомерные γ-аминомаслянной кислоте. 97. Приведите формулы двух аминокислот, одна из которых имеет оптические изомеры, а другая нет. 98. Приведите примеры аминокислот, у которых преобладают: 99. Составьте схему образования амфиона аланина. 100. Напишите уравнения реакций, доказывающих амфотерность аланина (2-аминопропионовая кислота). 101. Составьте схему реакции получения пептида гли-фен-ала. К какому типу пептидов (ди-три-…поли) он относится, приведите полное название этого пептида, обозначьте пептидную связь. 102. Сколько трипептидов может быть получено из трёх аминокислот: цистеина, аланина и лизина? Приведите их формулы и назовите их. Лабораторная работа № 5 Аминокислоты Опыт 1. Отношение аминокислот к индикаторам. Реактивы и оборудование: 2 % раствор глицина, метиловый оранжевый, лакмус, пробирки. Ход работы: в две пробирки наливают по 1 мл 2 % раствора глицина и добавляют по 2 капли растворов индикаторов. Наблюдаем:_______________. То есть, водный раствор этой аминокислоты имеет _______________ реакцию среды. Моноаминомонокарбоновые кислоты в водных растворах существуют в виде биполярных ионов: Н2N – CH2 – COOH <=> Глицин Биполярный ион
Опыт 2. Образование медной соли аминоуксусной кислоты. Реактивы и оборудование: карбонат меди (II), 2 % раствор глицина, Ход работы: в сухую пробирку вносят 0,5 г карбоната меди (II) и Оставшуюся часть жидкости охлаждают в стакане с ледяной водой, протирая стенки пробирки стеклянной палочкой. Наблюдаем _________________________________________________________________.
2Н3N+ – CН2 – СОО– + СuCO3 →
CH2 – NH2 O – C = O
Приложение Таблица 1 Названия кислот и солей Кислота |
Кислотный остаток |
Название соли
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 263; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.5.68 (0.18 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||


 Непредельные углеводороды <=> предельные углеводороды → арены
Непредельные углеводороды <=> предельные углеводороды → арены

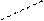
 → О = С – О NH2 – CH2
→ О = С – О NH2 – CH2
 │ Cu │ + H2O + CO2↑
│ Cu │ + H2O + CO2↑


