Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции второго порядка. Выражение для константы скорости, времени полупревращения.
Реакции второго порядка. К реакциям второго порядка относятся реакции соединения типа A + B→C, реакции обмена A + B = C + D, а также реакции разложения и др. Скорость реакции второго порядка определяется уравнением
где k — константа скорости реакции; а — число молей вещества А в начале реакции; b — число молей вещества В в начале реакции; х —число прореагировавших молей. Здесь возможны два случая. Первый случай — это когда какое-то количество вещества А вступает в реакцию с эквивалентным количеством вещества В, т. е. когда а = b. И второй случай более сложный — это когда а ≠ b. Рассмотрим оба эти случая. Первый случай (а= b). Поскольку исходные концентрации реагирующих веществ равны между собой, уравнение (2.13) примет вид
Разделяя переменные и производя интегрирование, получим
При t = 0 x = 0, откуда const =1/а. После подстановки этой величины в уравнение (2.15) получим
Размерность константы скорости реакции второго порядка t -1 C -1. Поэтому в отличие от константы скорости первого порядка численное значение k зависит от того, в каких единицах выражены t и С. Если последняя выражена в кмоль/м3, а время в с, то k имеет размерность [с-1·(кмоль/м3)-1]. Для реакций второго порядка большую роль играет число столкновений, которые происходят в единицу времени между молекулами реагирующих веществ. Число столкновений, в свою очередь, пропорционально числу молекул в единице объема, т. е. концентрации. Таким образом, константа скорости, а следовательно, и скорость реакции второго порядка зависят от разбавления раствора. Второй случай (а ≠ b). Если для реакции взяты неэквивалентные количества реагирующих веществ, скорость реакции выразится так:
После разделения переменных получим это уравнение в другом виде:
Выражение, стоящее в левой части уравнения (2.18), можно представить как
После подстановки этого выражения в уравнение (2.13) получим
После интегрирования
Поскольку при t = 0 х = 0, постоянная интегрирования
Подставляя это выражение в уравнение (2.16), найдём
Это и есть кинетическое уравнение реакции второго порядка. Примером подобной реакции может служить омыление эфиров щелочами: СН3COOC2Н5 + ОН- →СН3COO- + C2Н5ОН
Кинетика реакций второго порядка была детально изучена С. Г. Крапивиным ещё в 1915 г. Реакции третьего порядка встречаются очень редко и потому не имеет смысла рассматривать математический вывод их кинетического уравнения. Существуют экспериментальные способы определения порядка реакции, основные из них: избыточных концентраций, подстановки в кинетическое уравнение реакций, определение полупериода реакций, графический. Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С, t (рис. 40). Математическое уравнение этой зависимости запишется следующим образом
k = и измеряется в л?с -1?моль -1, т.е. ее численное значение зависит от того, в каких единицах измеряется концентрация вещества. Период полупревращения реакций второго порядка обратно пропорционален начальной концентрации реагента t½= Это связано с тем, что скорость реакций второго порядка в сильной мере зависит от числа столкновений между молекулами реагирующих веществ в единицу времени, которое, в свою очередь, пропорционально числу молекул в единице объёма, т. е. концентрации вещества. Таким образом, чем больше концентрация вещества в системе, тем чаще сталкиваются молекулы между собой и тем за меньший промежуток времени половина их успеет прореагировать.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 2025; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.131.72 (0.005 с.) |
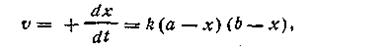
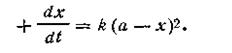
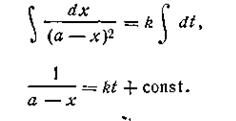
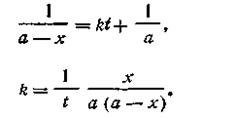
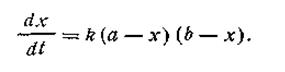
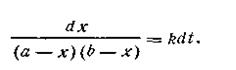
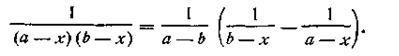
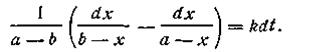
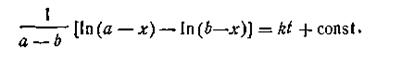
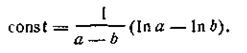
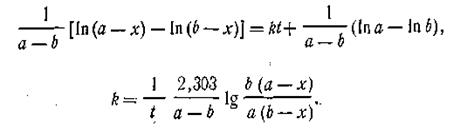
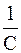 =
= 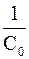 + kt
+ kt
 (
(