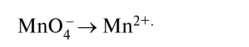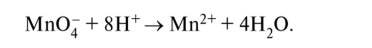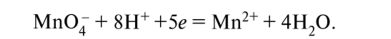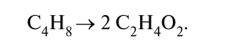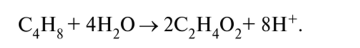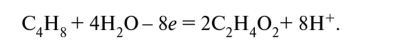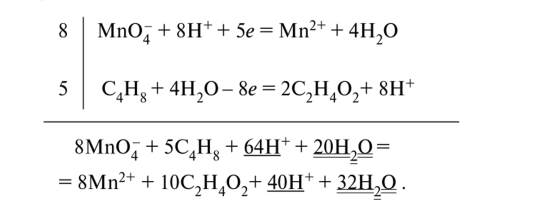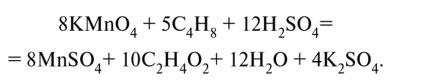Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Процессы окисления, восстановления
Окисление – процесс отдачи электронов Hq0 - 2e → Hq+2 При окислении степень окисления элемента повышается, а элемент является восстановителем. Восстановление – процесс присоединения электронов. S0 + 2e → S-2 При восстановлении степень окисления элемента понижается, а элемент является окислителем. Важнейшие окислители и восстановители. Типичные восстановители Простые вещества • H2 • Щелочные металлы • Щелочноземельные металлы • C • Zn • AI Сложные вещества • KI • NH3 • H2S • CO • Na2SO3 • NaNO2 Типичные окислители Простые вещества • F2 • CI2 • O2 Сложные вещества • KCIO3 • H2SO4 • HNO3 • KMnO4 • MnO2 • K2Cr2O4 Классификация окислительно-восстановительных реакций. Примеры Окислительно-восстановительные реакции делятся на три вида: · межмолекулярные ОВР - окислителем и восстановителем являются два разных вещества (простые или сложные); · внутримолекулярные ОВР - окислитель и восстановитель находятся в одной молекуле; · реакции диспропорционирования (дисмутации, самоокисления-самовосстановления) - в одном и том же веществе имеется элемент с промежуточной степенью окисления, который в ходе реакции, одновременно, и окисляется, и восстанавливается. Межмолекулярные ОВР Примеры межмолекулярных окислительно-восстановительных реакций между газообразными веществами: H20+Cl20 = 2H+1Cl-1 3H20+N20 = 2N-3H3+1 2N+2O+O20 = 2N+4O2-2 4N-3H3+3O20 = 2N20+6H2O-2 Примеры межмолекулярных ОВР между твёрдыми веществами и газообразными (окисление металлов): 2Mg0+O20 = 2Mg+2O-2 2Sb0+3Cl20 = 2Sb+3Cl3-1 Примеры межмолекулярных ОВР между твёрдыми веществами и растворами: Mn+4O2+4HCl-1 = Cl20+Mn+2Cl2+2H2O 2KMn+7O4+16HCl-1 = 5Cl20+2Mn+2Cl2+2KCl+8H2O Примеры межмолекулярных ОВР между твёрдыми веществами: 2Al0+Fe2+3O3 = Al2+3O3+2Fe0 Примеры межмолекулярных ОВР, протекающих в растворах: 3Na2S+4O3+K2Cr2+6O7+4H2SO4 = 3Na2S+6O4+Cr2+3(SO4)3+K2SO4+4H2O Ионное уравнение: 3SO32-+Cr2O72-+8H+ = 3SO42-+2Cr3++4H2O Реакции коммутации: 2H2S-2+H2S+4O3 = 3S0+3H2O 5HCl-1+HCl+5O3 = 3Cl20+3H2O Внутримолекулярные ОВР Внутримолекулярные окислительно-восстановительные реакции являются реакциями разложения: N-3H4N+3O2 = N20+2H2O N-3H4N+5O2 = N2+1+2H2O 2NaN+5O3-2 = 2NaN+3O2+O20 2KCl+5O3-2 = 2KCl-1+3O20 Реакции диспропорционирования Cl20+H2O ↔ HCl+1O+HCl-1 4KCl+5O3 = 3KCl+7O4+KCl-1 3NaCl+1O = NaCl+5O3+2NaCl-1 4Na2S+4O3 = 3Na2S+6O4+Na2S-2 3HN+3O2 = HN+5O3+2N+2O+H2O
Реакции диспропорционирования могут протекать только в присутствии веществ, которые имеют элементы с промежуточной степенью окисления. Например, марганец в манганате калия K2Mn+6O4 имеет промежуточную степень окисления +6. Поскольку, ион MnO42- имеет изумрудный цвет, то и раствор манганата калия имеет зелёный цвет. Реагируя с водой, манганат калия образует перманганат калия KMnO4, а цвет раствора становится буро-красным, в результате выпадения в осадок оксида магния MnO2. 3K2Mn+6O4+2H2O = 2KMn+7O4+Mn+4O2+4KOH 2Mn+6-2e- = 2Mn+7 (окисление) Mn+6+2e- = Mn+4 (восстановление) Как видно из уравнения реакции, в двух из трёх ионов MnO42-, присутствующих в молекуле манганата калия, атомы марганца отдают по одному электрону, выступая в роли восстановителя, а в третьем ионе атом марганца принимает эти два электрона от своих "братьев", играя роль окислителя. Таким образом, молекула манганата калия в ходе реакции проявляет, как восстановительные, так и окислительные свойства. Метод электронного баланса. Примеры Zn + HNO3 → Zn(NO3)2 + NO + H2O Zn0-2e=Zn2+ ½3 восстановитель N+5+3e=N+2 ½2 окислитель 3Zn + 4HNO3 = Zn(NO3)2 + 2NO + 2H2O Сначала расставляются коэффициенты в веществах, полностью изменяющих степень окисления. Затем по балансу элементов расставляют коэффициенты у всех остальных веществ HCI + MnO2 → CI2 + MnCI2 + H2O 2Cl-1 -2e=Cl20 ½1 восстановитель Mn+4+2e=Mn+2 ½1 окислитель 4HCI + MnO2 = CI2 + MnCI2 + H2O
KMnO4 + HCI → KCI + MnCI2 + CI2 + H2O Mn+7 +5e=Mn+2 ½2 окислитель 2Cl-1-2e=Cl20 ½5 восстановитель 2KMnO4 + 16HCI → 2KCI + 2MnCI2 + 5CI2 + 8H2O Метод электронно-ионного баланса. Примеры 1) в молекулярной схеме реакции находим степени окисления атомов тех элементов, которые её изменяют. Напишем ионно-молекулярную схему реакции, включающую окислитель, восстановитель, продукты их реакции и, если известно, среду; 2) составляем ионно-электронные уравнения отдельно для процессов окисления и восстановления: сначала уравняем частицы в левой и правой частях уравнения, используя для этого молекулы Н20 и, в зависимости от среды, ионы Н+ или ОН-, а затем уравняем заряд добавлением (или вычитанием) электронов в левую часть (из левой части) уравнения; 3) находим наименьшее общее кратное для электронов окислителя и восстановителя, и соответствующие множители;
4) суммируем полуреакции окисления и восстановления с учётом множителей, получаем ионно-молекулярное уравнение, а затем пишем молекулярное уравнение реакции. Пример 1. Бутен-2, СН3-СН=СН-СН3, или С4Н8, окисляется перманганатом калия КМп04 в сернокислой кислой среде до уксусной кислоты СН3СООН, или С2Н402:
Запишем ионно-молекулярную схему:
Схема полуреакции восстановления:
Уравняем кислород, учитывая, что в кислой среде присутствуют ионы водорода Н+ и молекулы воды; присутствие гидроксид-ионов ОН~ исключено. Один несбалансированный атом кислорода связывается в воду двумя ионами Н+. Поэтому в левую часть полуреакции на четыре избыточных атома кислорода добавляем восемь ионов водорода Н+, при этом в правой части образуется четыре молекулы воды:
Недостаток заряда в левой части обозначим через х и определим его по балансу заряда: -1 + 8 + х = +2, отсюда х = -5. Поскольку электрон имеет единичный элементарный отрицательный заряд, это соответствует принятию пяти электронов:
Проверим по заряду: -1 + 8 + 5 • (-1) = +2. Схема полуреакции окисления (левую часть удваиваем для баланса по углероду и водороду):
Свяжем четыре избыточных атома кислорода справа, добавив в правую часть уравнения восемь ионов водорода Н+; в левой части появится четыре молекулы воды:
Недостаток заряда в левой части х = + 8; что соответствует отдаче восьми электронов:
Наименьшее общее кратное числа принятых (5) и отданных (8) электронов равно 40. Суммируем полуреакции восстановления и окисления с учётом множителей:
Подчёркнутые члены уравнения являются подобными, поэтому они сокращаются. После сокращения получим ионно-молекулярное уравнение реакции:
Проверим баланс по заряду: 8 • (-1) + 24 = 16; 8 • 2 = 16. Составим молекулярное уравнение:
уравняв в нем дополнительно ионы К+ и SO^-, не принимавшие участия в процессах окисления и восстановления. Проверим баланс по кислороду: 8-4 + 12-4 = 80; 8-4 + 10-2 + + 12 + 4-4 = 80.
|
||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 168; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.30.253 (0.018 с.) |