
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика процесса горения топлива.
^ Время горения топлива.
tгt= смt+ нt+ х tпроцессы (ф): Процесс горения топлива зависит от физической стадии (смесеобразование и подогрев топлива) и осуществляются реакции горения (хим.). tЕсли фt >х, то этот процесс происходит в кинетической области tи, следовательно, время процесса сгорания определяется в этом случае временем осуществления химических реакций: гt= х. tСтадия ф t>х наступает тогда, когда время транспортировки окислителя значительно превышает время, необходимое для осуществления собственно химических реакций горения. И этот процесс находиться в диффузионной области горения. tКогда ф t@х (если время протекания химических реакций соизмеримо со временем физических стадий), тогда процесс находиться в промежуточной области и полное время сгорания топлива определяется скоростью наиболее медленного процесса. При сжигании газообразного топлива tфизическими стадиями процесса являются: образование горючей смеси из газа и окислителя (воздуха) и подогрев ее до температуры воспламенения. Горение газовоздушной смеси протекает достаточно интенсивно с большим и интенсивным выделением тепла. Поэтому ее подогрев до температуры воспламенения незначителен. Кроме того, подогрев часто сопровождается и происходит параллельно с процессом смесеобразования. Поэтому он не требует дополнительного времени. Таким образом практически из подготовительных этапов физических стадий является процесс смешения и в этом случае х t»см. tсм зависит от способа подачи в топку газообразного топлива и окислителя.
2 – обмуровка камеры сгорания; Вг – топливо (газ); Vo’ – первичный воздух (часть воздуха, необходимая для осуществления процесса сгорания, подаваемая в горелочное устройство для осуществления перемешивания топлива и окислителя); Vo’’ – количество воздуха, вводимое в топочное устройство, необходимое для осуществления полного сгорания. V д = × a Vвo = Vo’+Vo’’ При подаче в топку через горелку предварительно перемешанную газово-воздушную смесь, когда Vд=Vo’ и Vo’’=0, имеет место кинетический принцип организации процесса горения. При раздельной подаче в топку горючего газа и окислителя, когда Vo’=0 и Vд=Vo’’t,см имеет наибольшее значение и в этом случае реализуется диффузионный принцип. В том случае, если Vo’0 и V>o’’0, организуется смешанный принцип горения газообразного топлива.> Процесс сжигания жидкого топлива определяется также, как и газообразного, физическими и химическими стадиями. К физическим стадиям этого топлива относятся процессы тонкодисперсного распыления топлива на мелкие капельки (с помощью форсунки), подогрев испарение и образование горючей смеси. К химической стадии процессов относится этап горения этой смеси. Процесс горения твердого топлива также состоит из ряда последовательных этапов. В первую очередь происходит смесеобразование и тепловая подготовка топлива, включая подсушку топлива и образование летучих. Получающиеся при этом горючие газы и коксовый остаток (углерод) при достаточном количестве окислителя далее сгорают с образованием дымовых газов и минерального остатка – золы. Наиболее длительными оказываются этапы сгорания кокса (углерода), который является основной составляющей горючей массы твердого топлива. Для антрацита содержание углерода – 90-95%, для торфа – 50-60%. Поэтому механизм горения твердого топлива в значительной степени определяется горением углерода. Горение углерода является сложным физико-химическим процессом. При этом можно выделить следующие первичные и вторичные реакции: -первичные C+O2=CO2 (+Q1) 2C+O2=2CO (+Q2) Q1Q>2 -вторичные 2CO+O2=2CO2 (+Q3)
CO2+C=2CO (-Q2) CO2 – продукт полного сгорания; CO – продукт неполного сгорания. Реакции с выделением тепла (+Q) характеризуют окислительную зону горения, а реакции (-Q) – восстановительную. При осуществлении топочного процесса стремятся максимально развить окислительную зону с получением продуктов полного сгорания (CO2). При газификации топлива стремятся по возможности развить восстановительные реакции с получением продуктов неполного сгорания (CO). ^ Скорость процессов горения.
Градиент (разность) концентраций окислителя на поверхности реагирования и в окружающей среде мал. При указанных условиях скорость горения в целом определяется кинетикой химических реакций на поверхности (кинетическая область реагирования). w - скорость частиц (w1w<2w<3w<4) d – диаметр частиц (d1 d<2 d<3d< 4). Согласно закономерности рисунка с увеличением температуры скорость горения растет по экспоненциальному закону. Коэффициент скорости реакции определяем согласно закона Аррениуса: K = Ko × e -E/RT, где К о – предэкспонециальный коэффициент; Е – энергия активизации, кДж/кмоль; Т – абсолютная температура, К; R – универсальная газовая постоянная, кДж/кмоль. Подобное условие, в котором увеличение скорости реакции горения связано с увеличением температуры, длится до тех пор, пока скорость химической реакции не станет соизмеримой со скоростью подвода окислителя к поверхности реагирования для каждого диаметра. При дальнейшем повышении температуры скорость химической реакции становится на столько значительной, что процесс горения лимитируется поступлением окислителя к поверхности реагирования. Весь подведенный окислитель незамедлительно вступает в химическую реакцию с горючим. Поэтому концентрация окислителя на поверхности приближается к 0. В этом случае скорость горения определяется условиями подвода окислителя, т.е. гидродинамическими факторами (относительная скорость потока и размеры частиц). Относительная скорость частицы – скорость потока минус скорость движения частицы. Соотношение кинематической и диффузионной областей реагирования представлено на выше приведенном рисунке. Скорость диффузионного горения растет с увеличением относительной скорости газового потока и уменьшением размера частиц. Кинематическая и диффузионная области в чистом виде являются предельными областями реагирования. Между ними находится промежуточная область, для которой скорость химической реакции и скорость диффузии окислителя к поверхности реагирования соизмеримы.(Диффузия – “проникновение”) При определенных условиях возможно смещение горения из одной области реагирования в другую область. Так уменьшение размеров частичек топлива или увеличение относительной скорости газового потока при неизменной температуре перемещает горние из диффузионной области реагирования в промежуточную и даже в кинетическую. Понижение температуры также сдвигает горние в область кинетического реагирования.
Большинство процессов, осуществляемых в топочных устройствах или промышленных печах, происходит в промежуточной области реагирования. Скорость реакции зависит также от физических свойств топлива. При различных состояниях топлива и окислительной среды, когда имеется поверхность реагирования, процесс называется гетерогенным. Этот процесс при сгорании топлива в среде, которая находится в различных агрегатных состояниях. Когда агрегатное состояние топлива и окислителя одинаковое, то процесс называется гомогенным. Для установившегося гетерогенного процесса количество окислителя, прореагировавшего на поверхности горючего, равняется диффузионному его потоку. Таким образом, скорость горения выражается через скорость химической реакции и скорость диффузии потока реагирующего газа и выражается следующей зависимостью: Ω г = сп · К = αдиф (С – Сп) где wr – скорость горения газа, кг/(м2с);× С n – концентрация окислителя на поверхности реагирования, кг/м3; ^ С – концентрация окислителя в потоке, кг/м3; К – константа химической реакции; a диф – константа скорости диффузии (коэффициент массообмена), м/с. Константа К как было ранее отмечено зависит от температуры и определяется по закону Аррениуса. aКонстанта диф входит в соотношение:
где Nи диф – число Нуссельта для диффузионного потока (безразм.); Д – коэффициент диффузии, м2/с; α диф – м/с; d – характерный размер обтекаемого тела, [м].
где К р – результирующая константа скорости горения, учитывающая химические и физические свойства реагирования. В реальных условиях горение твёрдых веществ значительно сложнее, поскольку в частицах твёрдого топлива имеются поры, и процесс горения не осуществляется на поверхности, а проникает внутрь частиц. Кроме того, частица имеет влажность, которая при нагревании частицы испаряется и образует область водяных паров. Так же из твёрдых частиц при сгорании выделяются летучие вещества, которые образуют вокруг частицы облако. Именно летучие вещества начинают гореть.
Выделение влаги из частицы материала начинается при подогреве топлива до температуры около 100ОС. Начало выделения летучих веществ зависит от возраста топлива и от его химического состава (чем больше возраст, тем меньшая температура приводит к началу выделения летучих веществ). Процесс горения твёрдого топлива заканчивается образованием золы, в которую входят минеральные негорючие примеси ^
|
||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 257; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.124.232 (0.022 с.) |
 ,
, ,
,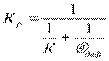 ,
,


