
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Виды топлива и его основные характеристикиСтр 1 из 10Следующая ⇒
Конспект по топливу.doc Виды топлива и его основные характеристики Топливо – органическое соединение, встречающееся в природе в достаточном для его использования количестве, доступное для добычи и его переработки и выделяющее при его сжигании достаточное количество тепла, используемого в теплоэнергетических установках. По органическому составу и агрегатному состоянию топливо подразделяется на твердое, жидкое и газообразное. Эти топлива могут быть естественными и искусственными. Все виды топлива можно сгруппировать в следующую таблицу: В зависимости от расположения месторождения добычи топлива от источника потребления топлива разделяют местное (месторождение вблизи источника потребления) и дальнепривозное. Классификация основных видов твёрдого топлива.
Из твердого топлива, сжигаемого в КУ, представлены следующие виды: торф, бурые угли, горючие сланцы, каменный уголь, антрацит. ^ Бурые угли подразделяют в зависимости от влажности на 3 типа: Б1, Б2, Б3. -Б1 характеризуется влажностью топлива меньше ее 30% -Б2 – 30 – 40 % -Б3 – больше ее 40 % Выход летучих у бурых углей составляет 40 – 50 %. ^ Горючие сланцы: влажность – 13 –17 %. Они не маркируются по категориям; поставляются потребителю с указанием влажности. Торф (фрезерный или порошкообразный): влажность до 50%, зольность до 20%. Марка углей, предназначенных для сжигания, характеризуется содержанием в них летучих и углеродов, по которому определяется теплота их сгорания: -Д – длиннопламенный уголь, у которых выход летучих больше ее 37 %; -Г – газовый уголь – 33 –37 %; -ГЖ – газово-жирный – 31 –35 %; -Ж – жирный – 24 –23 %; -КЖ - коксовый жирный – 25 –30 %; -К – коксовый – до 31 %; -ОС – отощенный спекающийся – около 25 %; -Т – тощий – 17 %; -А – антрацит – меньше ее 9 %; Кроме выхода летучих угли классифицируются по размеру куска: -П – плита – размер куска 100-300 мм; -К – крупный – 50-100 мм; -О – орех – 25-50 мм; -М – мелкий – 13-25 мм; -С – семечка – 6-13 мм; -Ш – штык 0-6 мм; -Р – рядовой 0-300 мм. НАПРИМЕР: ДП – длиннопламенная, плита; КК – коксовый, крупный. АНТРАЦИТ. Основной элементарный состав включает углерод, процентное соединение которого колеблется от 91 до 96 %; выход летучих ~9%, соединение влаги ~3 – 6 %,зольность ~ 4%, Q =25100 – 27200 кДж.
Жидкое топливо.
С – 84 – 86%; H – 12 –14%; O – 0.1 – 0.2%; N – 1.02 – 0.7%; S – 0.01 – 4.5%. Количество серы S, содержащейся в нефти,отрицательно влияет на топливо, получаемое из нее, т.к. S, окисляясь в процессе горения, образует диоксид серы SO2, который, соприкасаясь с влагой, преобразуется в серную кислоту H 2SO4, которая приводит к коррозии. По соединению серы топливо делится на: малосернистое топливо (S до 0.5%); сернистое (S 0.5 – 1.9 %); высокосернистое (S >2%). Физические свойства нефти окр-ся ее плотностью, удельным весом и вязкостью. Вязкость подразделяется на 3 класса:
1. 2. 3.
Температура воспламенения жидкого топлива – температура подогрева жидкой базы топлива, при которой поднесение источника горения воспламеняется поверхность и происходит непрерывный процесс горения топлива. Температура застывания – температура, при которой происходит застывание жидких нефтепродуктов, включая нефть и мазут. При переработке нефти в соответствии с различными температурами получают топливо, используемое в энергетике. Среди получаемого топлива различают:
1. 2. 3. 4.
Основным показателем карбюраторного топлива является октановое число. Это число показывает, сколько процентов изооктана содержится в эталонном топливе, которое по своему свойству (детонационному) равноценно приравниваемому топливу. Эталонное топливо изготавливают из изооктана C8 H18, которое обладает октановым числом 1 или 100, и нормального гептана C 7H16, октановое число которого равно ø.
Соотношение 2-х этих составляющих в % сверяют на опытном двигателе с реальным топливом. Дизельное топливо предназначается для сжигания в двигателях, где создается высокое давление рабочей смеси, т.е. смеси топлива с окислителем. Такие двигатели называются дизельными, характерной особенностью которых является отсутствие системы воспламенения топлива. Топливо воспламеняется за счет температуры рабочей смеси при высоком давлении. Основной характеристикой дизельного топлива является цитановое число. Оно характеризует процентное содержание цитана в смеси эталонного топлива, имеющего одинаковую воспламеняемость с испытываемым дизельным топливом. В качестве цитана используют C16H34 (органическое соединение). Эталонная смесь изготавливается из цитана и метил нафталина (C 10H7-CH3). Установлены следующие виды дизельного топлива: -для тепловых двигателей – Т-3, Т-Л – тепловозное зимнее и летнее; -для двигателей внутреннего сгорания – Д-З, Д-Л. (Цитановое число для З-40, для Л-45) Котельное топливо. В соответствии с ГОСТом для транспортных и стационарных котельных, а также теплотехнических установок установлены следующие марки котельного топлива: Ф - 5, 12 - мазут флотский, вязкость условность 5 и 12 -По содержанию серы – малосернистый. -По содержанию серы мазуты делятся на: -малосернистые (S до 0.5%); -срднесернистые (0.5-2%) -в2%).>ысокосернистые ( Мазуты, используемые в котельных установках и для других целей сжигания в технологических установках, делятся на 2 типа: М-40 и М-100. Газообразное топливо Состав газов и их свойства.
По физико-теплотехническим свойствам газ характеризуется плотностью r = m / V, r(осм = 0.01∑ρirir, где i - плотность i-го компонента газа, входящего в состав газовой смеси; ri- объемная доля компонента (в %) в газовой смеси). rПлотность газа при расчетных параметрах также возможно определить из уравнения состояния (см r=осм РТо /(Ро Т); Р- расчетное давление (текущее), То С), Р°=273 К (0о 10×-=760 мм. рт. ст. = 101.33 Па, Т – температура Т= t+273, К). , мr/m=nс) и кинематическую (×, ПаmВязкость подразделяется на динамическую (2 /с). Для определенной газовой смеси нет вязкости, соответствующей справочной. Но есть динамическая и кинематическая вязкость отдельных компонентов:
где m i – массовая доля данного газа в составе смеси; m i – динамическая вязкость данного компонента. Теплоемкость газовой смеси подразделяется на массовую и объемную и в соответствии с этим определяется по следующим уравнениям термодинамики:
массовые теплоемкости отдельных компонентов газовой смеси. Энтальпия газов смеси
где V i – объем данного компонента в газовой смеси,м3; h i – энтальпия компонента, кДж/м3. Состав газовой смеси
где
Условное топливо.
Чтобы привести различные топлива к одному показателю, вводится понятие уловного топлива. Под условным топливом понимается такое топливо, при сжигании1 кг которого выделяется Qусл.=29300 кДж тепла. Отношение Э = Qнр / Qусл называется коэффициентом пересчета действительного топлива в условное. Время горения топлива.
tгt= смt+ нt+ х tпроцессы (ф): Процесс горения топлива зависит от физической стадии (смесеобразование и подогрев топлива) и осуществляются реакции горения (хим.). tЕсли фt >х, то этот процесс происходит в кинетической области tи, следовательно, время процесса сгорания определяется в этом случае временем осуществления химических реакций: гt= х. tСтадия ф t>х наступает тогда, когда время транспортировки окислителя значительно превышает время, необходимое для осуществления собственно химических реакций горения. И этот процесс находиться в диффузионной области горения. tКогда ф t@х (если время протекания химических реакций соизмеримо со временем физических стадий), тогда процесс находиться в промежуточной области и полное время сгорания топлива определяется скоростью наиболее медленного процесса. При сжигании газообразного топлива tфизическими стадиями процесса являются: образование горючей смеси из газа и окислителя (воздуха) и подогрев ее до температуры воспламенения. Горение газовоздушной смеси протекает достаточно интенсивно с большим и интенсивным выделением тепла. Поэтому ее подогрев до температуры воспламенения незначителен. Кроме того, подогрев часто сопровождается и происходит параллельно с процессом смесеобразования. Поэтому он не требует дополнительного времени. Таким образом практически из подготовительных этапов физических стадий является процесс смешения и в этом случае х t»см. tсм зависит от способа подачи в топку газообразного топлива и окислителя. 2 – обмуровка камеры сгорания; Вг – топливо (газ);
Vo’ – первичный воздух (часть воздуха, необходимая для осуществления процесса сгорания, подаваемая в горелочное устройство для осуществления перемешивания топлива и окислителя); Vo’’ – количество воздуха, вводимое в топочное устройство, необходимое для осуществления полного сгорания. V д = × a Vвo = Vo’+Vo’’ При подаче в топку через горелку предварительно перемешанную газово-воздушную смесь, когда Vд=Vo’ и Vo’’=0, имеет место кинетический принцип организации процесса горения. При раздельной подаче в топку горючего газа и окислителя, когда Vo’=0 и Vд=Vo’’t,см имеет наибольшее значение и в этом случае реализуется диффузионный принцип. В том случае, если Vo’0 и V>o’’0, организуется смешанный принцип горения газообразного топлива.> Процесс сжигания жидкого топлива определяется также, как и газообразного, физическими и химическими стадиями. К физическим стадиям этого топлива относятся процессы тонкодисперсного распыления топлива на мелкие капельки (с помощью форсунки), подогрев испарение и образование горючей смеси. К химической стадии процессов относится этап горения этой смеси. Процесс горения твердого топлива также состоит из ряда последовательных этапов. В первую очередь происходит смесеобразование и тепловая подготовка топлива, включая подсушку топлива и образование летучих. Получающиеся при этом горючие газы и коксовый остаток (углерод) при достаточном количестве окислителя далее сгорают с образованием дымовых газов и минерального остатка – золы. Наиболее длительными оказываются этапы сгорания кокса (углерода), который является основной составляющей горючей массы твердого топлива. Для антрацита содержание углерода – 90-95%, для торфа – 50-60%. Поэтому механизм горения твердого топлива в значительной степени определяется горением углерода. Горение углерода является сложным физико-химическим процессом. При этом можно выделить следующие первичные и вторичные реакции: -первичные C+O2=CO2 (+Q1) 2C+O2=2CO (+Q2) Q1Q>2 -вторичные 2CO+O2=2CO2 (+Q3) CO2+C=2CO (-Q2) CO2 – продукт полного сгорания; CO – продукт неполного сгорания. Реакции с выделением тепла (+Q) характеризуют окислительную зону горения, а реакции (-Q) – восстановительную. При осуществлении топочного процесса стремятся максимально развить окислительную зону с получением продуктов полного сгорания (CO2). При газификации топлива стремятся по возможности развить восстановительные реакции с получением продуктов неполного сгорания (CO). ^ Скорость процессов горения.
Градиент (разность) концентраций окислителя на поверхности реагирования и в окружающей среде мал. При указанных условиях скорость горения в целом определяется кинетикой химических реакций на поверхности (кинетическая область реагирования). w - скорость частиц (w1w<2w<3w<4) d – диаметр частиц (d1 d<2 d<3d< 4). Согласно закономерности рисунка с увеличением температуры скорость горения растет по экспоненциальному закону. Коэффициент скорости реакции определяем согласно закона Аррениуса: K = Ko × e -E/RT, где К о – предэкспонециальный коэффициент; Е – энергия активизации, кДж/кмоль; Т – абсолютная температура, К; R – универсальная газовая постоянная, кДж/кмоль. Подобное условие, в котором увеличение скорости реакции горения связано с увеличением температуры, длится до тех пор, пока скорость химической реакции не станет соизмеримой со скоростью подвода окислителя к поверхности реагирования для каждого диаметра. При дальнейшем повышении температуры скорость химической реакции становится на столько значительной, что процесс горения лимитируется поступлением окислителя к поверхности реагирования. Весь подведенный окислитель незамедлительно вступает в химическую реакцию с горючим. Поэтому концентрация окислителя на поверхности приближается к 0. В этом случае скорость горения определяется условиями подвода окислителя, т.е. гидродинамическими факторами (относительная скорость потока и размеры частиц). Относительная скорость частицы – скорость потока минус скорость движения частицы. Соотношение кинематической и диффузионной областей реагирования представлено на выше приведенном рисунке. Скорость диффузионного горения растет с увеличением относительной скорости газового потока и уменьшением размера частиц. Кинематическая и диффузионная области в чистом виде являются предельными областями реагирования. Между ними находится промежуточная область, для которой скорость химической реакции и скорость диффузии окислителя к поверхности реагирования соизмеримы.(Диффузия – “проникновение”) При определенных условиях возможно смещение горения из одной области реагирования в другую область. Так уменьшение размеров частичек топлива или увеличение относительной скорости газового потока при неизменной температуре перемещает горние из диффузионной области реагирования в промежуточную и даже в кинетическую. Понижение температуры также сдвигает горние в область кинетического реагирования. Большинство процессов, осуществляемых в топочных устройствах или промышленных печах, происходит в промежуточной области реагирования. Скорость реакции зависит также от физических свойств топлива. При различных состояниях топлива и окислительной среды, когда имеется поверхность реагирования, процесс называется гетерогенным. Этот процесс при сгорании топлива в среде, которая находится в различных агрегатных состояниях. Когда агрегатное состояние топлива и окислителя одинаковое, то процесс называется гомогенным. Для установившегося гетерогенного процесса количество окислителя, прореагировавшего на поверхности горючего, равняется диффузионному его потоку. Таким образом, скорость горения выражается через скорость химической реакции и скорость диффузии потока реагирующего газа и выражается следующей зависимостью: Ω г = сп · К = αдиф (С – Сп) где wr – скорость горения газа, кг/(м2с);× С n – концентрация окислителя на поверхности реагирования, кг/м3; ^ С – концентрация окислителя в потоке, кг/м3; К – константа химической реакции; a диф – константа скорости диффузии (коэффициент массообмена), м/с. Константа К как было ранее отмечено зависит от температуры и определяется по закону Аррениуса. aКонстанта диф входит в соотношение:
где Nи диф – число Нуссельта для диффузионного потока (безразм.); Д – коэффициент диффузии, м2/с; α диф – м/с; d – характерный размер обтекаемого тела, [м].
где К р – результирующая константа скорости горения, учитывающая химические и физические свойства реагирования. В реальных условиях горение твёрдых веществ значительно сложнее, поскольку в частицах твёрдого топлива имеются поры, и процесс горения не осуществляется на поверхности, а проникает внутрь частиц. Кроме того, частица имеет влажность, которая при нагревании частицы испаряется и образует область водяных паров. Так же из твёрдых частиц при сгорании выделяются летучие вещества, которые образуют вокруг частицы облако. Именно летучие вещества начинают гореть. Выделение влаги из частицы материала начинается при подогреве топлива до температуры около 100ОС. Начало выделения летучих веществ зависит от возраста топлива и от его химического состава (чем больше возраст, тем меньшая температура приводит к началу выделения летучих веществ). Процесс горения твёрдого топлива заканчивается образованием золы, в которую входят минеральные негорючие примеси ^ Альтернативное топливо Процессы горения топлива
-Подготовка топлива к процессу горения – подсушка топлива, подогрев, выделение летучих веществ. -Смесеобразование – перемешивание летучих веществ с окислителями, воспламенение, гомогенное выгорание и горение летучих веществ. -Образование кокса и его гетерогенное горение. При этом осуществляются следующие реакции горения: С + О2 = СО2 + Q1 2C +O2 = 2CO +Q2 2CO2 + O2 = 2CO2 + Q3 Q1 > Q2 > Q3 СО2 + С = 2СО (-Q4) CO + H2O = CO2 + H2 (-Q5) Основу этих ракциях составляют гетерогенные процессы, наиболее длительные по времени. При сравнительно низких температурах до 800оС скорость химических реакций мала. Поэтому скорость поглощения кислорода во много раз меньше скорости, с которой кислород поставляется к поверхности горения. Скорость процесса горения лимитируется скоростью химической реакции, которая подчиняется закону Аррениуса и может быть определена в виде произведения постоянной скорости горения на концентрацию кислорода у поверхности или в потоке. Период горения, в котором скорость реакции определяется скоростью окисления вещества называется кинетическим периодом горения. При увеличении температуры в пределах 800 - 900оС скорость химической реакции становится соизмеримой и равна скорости доставки кислорода к окисляемой поверхности: v д = aд × (Со – Сs), где aд – коэффициент массообмена, характеризующий скорость переноса кислорода из потока за счёт молекулярной или турбулентной диффузии. В области горения 800 - 900оС происходит как кинетическое, так и диффузионное горение. Ближе к 800оС k > aд и скорость горения определяется скоростью реакции окисления. Ближе к 900оС наблюдается обратный процесс, т. е. скорость горения определяется диффузией поступающей к поверхности частицы окислителя (вторая область процесса горения). При высоких температурах (900 - 1500оС) происходит процесс выхода СО с поверхности частиц, т. е. процесс диссоциации. В результате скорость реакции замедляется из-за развития вторичных реакций. Кроме того, поверхность частицы уменьшается из-за поступления СО через их поры (III период горения). При температурах более 1500оС изменяется характер химической реакции, и начинают преобладать вторичные (восстановительные) реакции. В этом периоде углеродные частицы газифицируются, т. к. кислород не достигает их поверхности, а химическая реакция перемещается в газовый поток. Перемещение процесса горения в газовый поток несколько повышает скорость реакции по сравнению с III периодом горения (IV период горения). С дальнейшим ростом температуры (>2000оС) начинает сказываться нехватка кислорода в зоне вторичных реакций, т. е. происходит торможение горения (V период горения). В натуральном топливе стадия подготовки происходит при 1000С. Водяной пар, выделяющийся при этом, поднимает объём продуктов сгорания и снижает температуру горения. Образование летучих веществ зависит от состава топлива и его возраста. Для торфа выделение летучих веществ начинается при 1000С, бурого угля – 150 – 1700С, газового угля – 2100С, тощего угля и антрацита – 300 – 4000С. Наибольшее количество летучих веществ образуется при температуре 200 – 4000С и продолжается до 1000 – 11000С. Летучие вещества оказывают большое влияние на горение кокса. Зольность топлива снижает Qрн, что требует затрат тепла на его подогрев. Также зашлаковываются поверхности нагрева котлоагрегата. В существующих топочных устройствах температура горения находится в диапазоне до 16000С из-за неравномерного распределения процесса горения. При расчёте топочных устройств эти отклонения учитываются с помощью специальных коэффициентов и эмпирических зависимостей. Конспект по топливу.doc Виды топлива и его основные характеристики Топливо – органическое соединение, встречающееся в природе в достаточном для его использования количестве, доступное для добычи и его переработки и выделяющее при его сжигании достаточное количество тепла, используемого в теплоэнергетических установках. По органическому составу и агрегатному состоянию топливо подразделяется на твердое, жидкое и газообразное. Эти топлива могут быть естественными и искусственными. Все виды топлива можно сгруппировать в следующую таблицу: В зависимости от расположения месторождения добычи топлива от источника потребления топлива разделяют местное (месторождение вблизи источника потребления) и дальнепривозное.
|
|||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 155; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.40.207 (0.08 с.) |
 ,
, К)×/ (кг
К)×/ (кг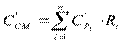 , кДж / (м3К)×
, кДж / (м3К)×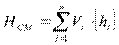 ,
,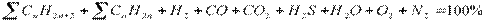
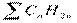 - предельные углеводороды;
- предельные углеводороды; ,
, ,
,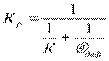 ,
,


