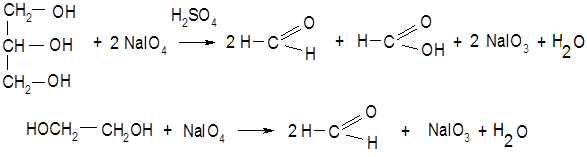Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
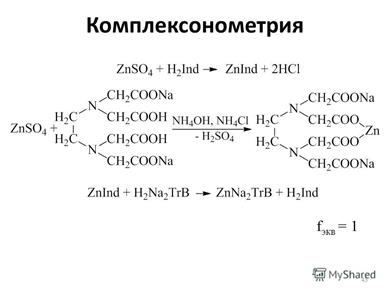
Титрант ЭДТА – динатриевая этилендиаминтетрауксусной кислоты (Na2H2Y).
Метод основан на образовании комплекса алюминия с комплексоном III в кислой среде и последующем титровании избытка комплексона III раствором уксуснокислого цинка в присутствии индикатора ксиленолового оранжевого (pH 5,5—5,8). Мешающие определению железо (III), хром (III), титан, цирконий, медь, марганец, которые также образуют комплексонаты, предварительно отделяют осаждением едким натром.
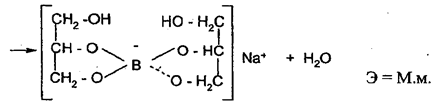
2. Алкалиметрия: варианты нейтрализации, вытеснения, гидролиза, косвенный. Показать на примере кислоты борной, хлоралгидрата Алкалиметрия – титриметрический метод анализа, основанный на измерении количества основания, необходимого для нейтрализации кислот, кислых солей, солей слабых оснований и органических кислот в анализируемом объекте. Вариант нейтрализации Вариант нейтрализации основан на свойстве неорганических и органических кислот взаимодействовать со щелочами с образованием солей. Титрование, за редким исключением, прямое. Конец титрования устанавливают в случае определения слабых кислот (барбитураты, сульфаниламиды), используя тимолфталеин, более сильных – феноловый красный, фенолфталеин или метиловый оранжевый. По этому варианту определяют: Сильные неорганические кислоты, например, кислоту хлористоводородную: HCl+NaOH→NaCl+H2OЭ = М.м. Слабые неорганические кислоты, например, кислоту борную (КДисс= 5,75×10-10). При титровании этой кислоты щелочью образуются сильно гидролизующиеся соли и щелочная реакция в растворе появляется значительно раньше достижения точки эквивалентности. H3BO3+NaOH→NaBO2+ 2H2O NaBO2+ 2H2O Для усиления кислотных свойств кислоты борной используют её свойство реагировать с многоатомными спиртами с образованием более сильных, чем борная, комплексных кислот, которые можно точно титровать по фенолфталеину. С этой целью, как правило, используют нейтрализованный глицирин, при этом образуется более сильная глицероборная кислота:
Вариант вытеснения Вариант вытеснения – основан на свойстве сильных оснований вытеснять слабые основания из их солей. Способ титрования – прямой, индикатор – фенолфталеин. По этому варианту определяют соли алкалоидов и азотистых оснований R×HCl+NaOH→R↓ +NaCl+H2O в органическую фазу где R– органическое основание
Определение проводят в присутствии органического растворителя, который выбирают с учетом рКА≥ 7 (атропина сульфат, новокаин, кодеина фосфат) применяют этанол или спирто-хлороформную смесь; при титровании солей более слабых оснований (папаверина гидрохлорид, дибазол, пилокарпина гидрохлорид) используют, как правило, хлороформ. Кодеина фосфат является солью трехосновной кислоты, однако при взаимодействии его со щелочью образуются либо монозамещенная, либо двузамещенная соли фосфорной кислоты, что зависит от рН в точке эквивалентности и, соответственно, от используемого индикатора. Средняя соль не образуется, т.к. диссоциация фосфорной кислоты по третьей ступени незначительна.
R×H3PO4+ 2NaOH Э = ½ М.м. Некоторые лекарственные вещества этой группы содержат фенольный гидроксил, который обладает слабыми кислотными свойствами и может реагировать с титрантом в случае использования в качестве индикаторов фенолфталеина или тимолфталеина, тогда рекомендуется поступать следующим образом. - Добавлять большой объем спирта, чтобы подавить диссоциацию фенольного гидроксила. Например, мезатон следует титровать в присутствии спирто-хлороформной смеси (3: 1). - Выбрать индикатор, при титровании с которым исключается мешающее влияние фенольного гидроксила. Так, например, поступают в случае титрования пиридоксина гидрохлорида, используя в качестве индикатора бромтимоловый синий. - Использовать экстрагент, извлекающий компонент, содержащий фенольный гидроксил. Например, определение пилокарпина гидрохлорида в присутствии резорцина проводят, добавляя спиртоэфирную смесь. Эфир извлекает резорцин, что позволяет в этих условиях титровать пилокарпина гидрохлорид по фенолфталеину. При алкалиметрическом определении лекарственных веществ, содержащих сложноэфирную группу (атропина сульфат, новокаин) титрование проводят быстро, чтобы исключить возможность гидролитического разложения лекарственного вещества. 2.3.3 Вариант гидролитического разложения Вариант гидролитического разложения – основан на свойстве лекарственных веществ гидролизоваться в щелочной среде.
Применяется в количественном анализе сложных эфиров, амидов. Например, фенилсалицилата, метилового эфира изовалериановой кислоты (в валидоле) и других органических неустойчивых соединений (хлоралгидрат). Реакция гидролитического разложения протекает медленно, поэтому для её ускорения определение проводят при нагревании или кипячении. Используют способ обратного титрования с постановкой контрольного опыта. В качестве индикаторов используют фенолфталеин, бромкрезоловый пурпуровый или смешанный индикатор. При гидролитическом разложении сложных эфиров образуется соль соответствующей кислоты и спирт или фенол. Например, определение метилового эфира изовалериановой кислоты в валидоле или фенилсалицилата.
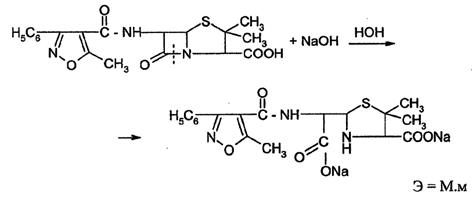
На щелочном гидролизе по β-лактамному циклу основано количественное определение оксациллина натриевой соли (лактам-внутренний амид).
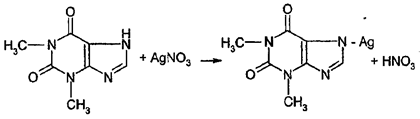
Косвенное титрование Способ алкалиметрического титрования применяется в анализе соединений, взаимодействия которых со вспомогательными реактивами сопровождается выделением эквивалентного количества кислоты. При этом могут использоваться различные типы реакций, наибольшее распространение получили реакции соле- и комплексообразования и конденсации. Соле- и комплексообразование В этом случае определение основано на свойстве соединений, содержащих подвижный атом водорода вступать в реакцию соле- и комплексообразования с ионами некоторых металлов (Ag+,Co2+,Cd2+), что сопровождается выделением эквивалентного количества кислоты, которую определяют алкалиметрически (вариант нейтрализации). По этому способу определяют теобромин, теофиллин в индивидуальном виде и в составе эуфиллина, рибофлавин. При проведении анализа к навеске препарата прибавляют растворы серебра нитрата, образуется соль и эквивалентное количество кислоты, которую оттитровывают щелочью (индикатор – феноловый красный). Например, определение теофиллина:
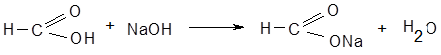
HNO3+NaOH→NaNO3+H2O Э = М.м. Вариант нашел применение в анализе индивидуальных веществ и их лекарственных форм заводского и экстемпорального изготовления. Кислота борная определяется алкалиметрическим методом нейтрализации в присутствии глицерина (нейтрализованного по фенолфталеину). Метод основан на кислотных свойствах кислоты глицеринборной. Индикатор – фенолфталеин. Прямое титрование. Титрант – Naoh. Уравнение метода:
f экв.(кислоты борной) = 1, так как из одной молекулы кислоты борной образуется одна молекула одноосновной кислоты глицеринборной. Образующаяся при титровании натриевая соль кислоты глицеринборной частично может гидролизоваться. В этом случае розовое окрашивание по фенолфталеину может появиться раньше точки эквивалентности. Поэтому после появления розового окрашивания добавляют еще порцию глицерина и, если окраска исчезла, продолжают титровать. Оттитровать кислоту борную раствором натрия гидроксида без добавления глицерина невозможно, так как при этом будут образовываться сильно гидролизующиеся соли. ФС метод обратной алкалиметрии. Метод основан на реакции щелочного гидролитического разложения хлоралгидрата избытком стандартного раствора гидроксида натрия, остаток которого определяется ацидиметрически по фенолфталеину:
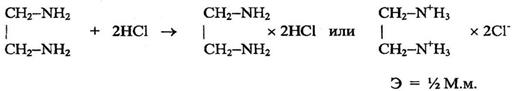
избыток остаток NaOH + HCl → NaCl + H2O fэкв (хлоралгидрата) = 1 Проводят контрольный опыт. 3. Ацидиметрия: варианты нейтрализации, вытеснения, гидролиза, косвенный. Показать на примере натрия тетрабората, магния оксида, метенамина (гексаметилентетрамина), Вариант нейтрализации Вариант нейтрализации – основан на свойстве неорганических и органических оснований вступать во взаимодействии с кислотами с образованием солей. По данному варианту определяют основания, например, аммиак, гексаметилентетрамин, кодеин, цитизин, этилендиамин в эуфиллине. Способ титрования – прямой. Конец титрования устанавливают в случае определения слабых оснований (гексаметилентетрамин), используя смешанный индикатор (метиловый оранжевый + метиленовый синий), при анализе более сильных оснований применяют метиловый красный (кодеин, цитизин) или метиловый оранжевый (аммиак, этилендиамин в эуфиллине). Примеры Этот вариант используется для определения гексаметилентетрамина в лекарственных формах, который реагирует как однокислотное основание. (CH2)6N4+HCl→ (CH2)6N4×HClЭ = М.м. Вариант нейтрализации лежит в основе количественного определения этилендиамина – компонента эуфиллина:
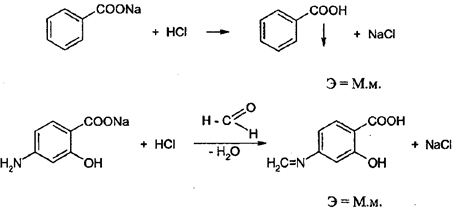
По способу обратного титрования возможно определение магния окиси: MgO+ 2HCl→MgCl2+H2O Э = ½ М.м. HCl+NaOH→NaCl+H2O Индикатор метиловый красный Вариант вытеснения Вариант вытеснения – основан на вытеснении сильной кислотой (титрант) слабой кислоты из её соли. Он применяется для определения солей слабых кислот и сильных оснований (неорганических и органических): натрия гидрокарбоната, натрия тетрабората, калия ацетата, натрия салицилата и бензоата, в том числе в составе кофеин-бензоата натрия, натриевых солей производных барбитуровой кислоты и сульфамидных препаратов, пара-аминосалицилат натрия и др. Определение проводят по способу прямого титрования. В качестве индикатора используют метиловый оранжевый или смешанный индикатор. Примеры NaHCO3+HCl→NaCl+CO2↑ +H2OЭ = М.м.
Формальдегид вводят с целью блокирования аминогруппы, проявляющей основные свойства. Определение натрия бензоата и салицилата проводят в присутствии несмешивающегося с водой органического растворителя (эфир), который извлекает образующиеся кислоты и подавляет их диссоциацию. Титрование натриевых солей барбитуровой кислоты (барбитал натрий, этаминал-натрий, гексенал) и сульфаниламинодов (соли более слабых кислот) проводят без добавления органических растворителей.
На результат титрования таких солей как барбитал-натрий, эуфиллин оказывает влияние углекислота, так как она может вытеснять из этих солей слабые кислоты. Поэтому вода, используемая для растворения навески, должна быть свободной от углекислоты (свежепрокипяченной). Вариант гидролитического разложения По этому варианту, согласно действующей ФС, определяют гексаметилентетрамин. Способ титрования – обратный, индикатор метиловый красный. Параллельно проводят контрольный опыт. Для этого отдельно титруют щелочью тот объем кислоты, который введен в реакцию с определяемым веществом. По разности в объемах щелочи, пошедший на контрольный и основной опыты определяют количество кислоты, связавшейся с анализируемым веществом.
Косвенное титрование Метод Къельдаля К косвенному способу титрования следует отнести метод определения азотсодержащих лекарственных веществ, получивший название метода Къельдаля. Метод Къельдаля сочетает процесс получения из лекарственного вещества летучего амина, перегоняемого с водяным паром, который образует с борной кислотой соль, определяемую затем ацидиметрически (вариант вытеснения). Метод Къельдаля может осуществляться в классическом и модифицированном вариантах.
Вариант присоединения Этот метод является специфичным для формальдегида. Метод основан на свойстве альдегидов вступать в реакции присоединения по карбонильной группе. Присоединение формальдегидом сульфида натрия протекает стехиометрично, в результате образуется сульфитное производное и эквивалентное количество щелочи, которую оттитровывают раствором кислоты хлористоводородной (индикатор – фенолфталеин).
Прямая ацидиметрия (ГФ Х): Титрант – HCl, индикатор – метиловый оранжевый: основан на свойстве слабой угольной кислоты вытесняться из солей при действии сильной минеральной кислоты; вариант прямого титрования, индикатор – метиловый оранжевый. Na2B4O7 ∙10H2O + 2HCl → 4H3BO3 + 2NaCl + 5H2O. f экв(Na2B4O7)=1/2, Ацидиметрический метод нейтрализации (вариант обратного титрования). Используется для количественного определения магния оксида. Метод основан на свойстве магния оксида количественно взаимодействовать с кислотой хлороводородной с образованием соли: MgO + 2HCI → MgCI2 + 2H2O Избыток HCI + NaOH → NaCI + H2O Остаток fэкв (магния оксида) = Ѕ Нейтрализации (прямое титрование) - основан на свойстве неорганических и органических оснований вступать во взаимодействие с кислотами с образованием солей. По данному варианту определяют аммиак (ФС), метенамин (гексаметилентетрамин) (неофицинальный метод, см. дальше сокращенно неоф. метод), кодеин (ФС), этилендиамин в аминофиллине (эуфиллине) (ФС). Метенамин (гексаметилентетрамин) (неоф. метод). (СH2)6N4 + HCl → (СH2)6N4 × HCl
f экв =1 Метод ацидиметрии. Гексаметилентетрамин(метенамин) ввиду наличия в его молекуле третичного атома азота имеет щелочную реакцию, поэтому его можно титровать как одноосновное основание стандартным раствором кислоты хлористоводородной. В качестве индикатора применяют смесь метилового оранжевого и метиленовую синь. Титрование ведут от зеленого окрашивания до фиолетового. (CH2)6N4 + HCI → (CH2)6N4 ∙ HCI F=1 4. Йодометрия: варианты окисления, восстановления, замещения. Показать на примере водорода пероксида, меди сульфата, натрия тиосульфата. Иодид-ион является восстановителем умеренной силы, его применяют для определения большого числа окислителей. Прямое титрование стандартным раствором KI не используют из-за трудностей индикации конечной точки титрования: прекращение образования свободного иода с помощью крахмала заметить нельзя. Поэтому для определения окислителей иодометрическим методом применяют способ титрования по замещению. Прямое титрование окислителей стандартным раствором тиосульфата натрия невозможно в связи с тем, что только I2 в нейтральной среде окисляет ион S2O32- быстро в соответствии со стехиометрией реакции I2 + 2S2O32-→ 2I- + S4O62-. Другие окислители обладают способностью полностью или частично окислять тиосульфат до серы, сульфата или тетратионата, например 4HOI + S2O32- + H2O → 2SO42- + 4I- + 6H+. При титровании иода раствором тиосульфата наиболее благоприятна нейтральная либо слабокислая среда. Высокая кислотность раствора приводит к разложению тиосульфата: S2O32- + 2H+→ H2SO3 + S H2SO3 реагирует с I2 в мольном соотношении 1:1 H2SO3 + I2 + H2O → SO42- + 4H+ + 2I-, тогда как на 1 моль Na2S2O3 расходуется ½ моль I2. В щелочной среде иодометрическое определение также не следует проводить из-за реакции диспропорционирования иода: I2 + 2OH- → IO- + I- +H2O. Косвенная йодометрия. Титрант – Na2S2O3, индикатор – крахмал, среда – H2SO4. H2O2 + 2KI + H2SO4 → I2 + K2SO4 + 2H2O. I2 + 2Na2S2O3 → Na2S4O6 + 2NaI. Водорода перекись восстанавливается до воды: H2O2 + 2H+ + 2ē → 2H2O, f экв(H2O2)=1/2, Йодометрия. Определение массовой доли сульфата меди йодометрическим методом основано на восстановлении Cu2+ вспомогательным реагентом йодидом калия до Cu+ с выделением эквивалентного количества молекулярного йода, который оттитровывается раствором тиосульфата натрия. 2CuSO4 + 4KJ = J2 + Cu2J2 + 2K2SO4 J2 + 2Na2S2O3 = 2NaJ + Na2S4O6 К раствору сульфата меди добавляют разведённую серную кислоту и йодид калия. Выделившийся йод титруют 0,1 М раствором тиосульфата натрия до лимонно-жёлтого окрашивания, прибавляют раствор крахмала и продолжают титрование до обесцвечивания индикатора. Прямая йодометрия (ГФХ): Титрант – раствор йода, индикатор – крахмал: 2Na2S2O3 + I2 → Na2S4O6 + 2NaI, f экв=1/2,
5. Йодатометрический и перйодатный методы в применении к анализу ЛС. Показать на примере и глицерола (глицерина). Иодатометрия, или йодатометрическое титрование - это определение различных восстановителей титрованием раствором иодата калия KIO3. Метод –фармакопейный. Сущность метода. В основе метода лежит полуреакция (1): IO3- +6e + 6H+ = I- + 3H2O (1) Стандартный OB потенциал редокс-пары IO3-,Н+|I- при комнатной температуре равен 1,08 В. т.е. имеет довольно высокое значение. В соответствии с полуреакцией (1) число электронов, принимающих участие в этой полуреакции, равно n = 6;фактор эквивалентности для иодат-иона в подобных ОВ процессах равен М( Молярная концентрация с(KIO3) и молярная концентрация эквивалента с( с( Иодат-ион способен в кислой среде, в зависимости от условий, восстанавливаться также до иода в соответствии с полуреакцией IO3- +5e + 6H+ = 0,5I2 + 3H2O Стандартный ОВ потенциал редокс-пары IO3-,Н+|I2 при комнатной температуре равен 1,195 В. Титрант метода. В качестве титранта метода применяют водный раствор иодата калия KIO3 обычно с молярной концентрацией эквивалента 0,1 моль/л. Титрант можно готовить по точной навеске иодата калия высокой степени чистоты (обычно химически чистого, «х.ч.»). Стандартные растворы иодата калия хранят в сосудах из темного Индикаторы метода. Виодатометрии при визуальном определении 6H+ + I- + IO3- = I2 + 3H2O 2I- - 2e = I2 2I+5 + 10e = I2 В качестве индикаторов используют и некоторые красители. Применение иодатометрии. Методом иодатометрического титрования определяют различные вещества, обладающие восстановительными свойствами, например олово(II), сурьму(III), мышьяк(III), Hg22+, железо(II), иодиды, сульфиты, тиосульфаты, тиоцианаты, аскорбиновую кислоту, гидразин, гидразид изоникотиновой кислоты и др. Способом обратного титрования, с иодатометрическим окончанием.
Перйодатный метод (в основе лежит реакция Малапрада). Фармакопейный метод определения субстанции глицерина. Основан на восстановительных свойствах глицерина. Глицерин как многоатомный спирт окисляется сильными окислителями с разрывом углеводородной цепи. Окислитель – перйодат натрия в кислой среде. HIO4 – йодная кислота, NaIO4 – перйодат натрия HIO3 – йодная кислота, NaIO3 – йодат калия При окислении 1 моль глицерина образуется 2 моль формальдегида и 1 моль муравьиной кислоты.
Перйодат натрия восстанавливается до йодата натрия. Избыток перйодата натрия связывают прибавлением раствора этиленгликоля. Выделившуюся муравьиную кислоту титруют раствором натрия гидроксида. Индикатор – фенолфталеин.
К навеске прибавляют воду, смесь 0,1 М раствора серной кислоты и 0,1 М раствора натрия перйодата (1:20) и перемешивают. Полученный раствор оставляют в защищённом от света месте на 15 мин. Затем прибавляют раствор этиленгликоля, перемешивают, оставляют в защищённом от света месте на 20 мин и титруют 0,1 М раствором натрия гидроксида (индикатор – фенолфталеин). Параллельно проводят контрольный опыт (без глицерина). Условия метода: · Реакция среды должна быть кислая, чтобы выделяющийся формальдегид не окислялся йодом (альдегиды окисляются йодом в щелочной среде, а титрантом является натрия гидроксид) · Время контакта глицерина с NaIO4 – не более 15 мин, т.к. при более длительном взаимодействии образующийся формальдегид и муравьиная кислота могут частично окисляться NaIO4 · Избыток NaIO4 связывают этиленгликолем, чтобы под действием щёлочи (титрант) не происходило окисление формальдегида. 6. Перманганатометрия и цериметрия в применении к анализу ЛС. Показать на примере магния пероксида, железа (II) сульфата. Перманганатометрия – один из наиболее часто применяемых методов окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора. Особенности и возможности метода Наибольшее распространение в аналитической практике получил перманганатометрический метод определения в кислых средах: восстановление МnО4- до Мn2+ проходит быстро и стехиометрично: МnО4- + 8Н+ + 5 е- → Мn2+ + 4Н2О. Особенностью метода является сильное влияние pH на Е о системы (МnО4- + 8Н+ )/Мn2+. При титровании в сильно кислых средах чаще всего используют серную кислоту. Хлороводородную и азотную кислоты применять не следует, так как в их присутствии могут идти конкурирующие окислительно-восстановительные реакции. Восстановление перманганат-иона в щелочной среде протекает последовательно: сначала до мангант-иона МnO42-, а затем до диоксида марганца МnО2: МnО4- + е- → МnО42-, МnО42- + 2Н2О + 2е- → МnО2 + 4ОН-. Количественно восстановление перманганата в щелочной среде до манганата протекает в присутствии соли бария. Ва(МnО4)2 растворим в воде, в то время как ВаМnО4 – нерастворим (ПРВаМnО4 = 2,46.10-10), поэтому дальнейшего восстановления до MnO2 из осадка не происходит. Перманганатометрически в щелочной среде, как правило, определяют органические соединения: формиаты, формальдегид, муравьиную, коричную, винную, лимонную кислоты, гидразин, ацетон и др. Признаком окончания титрования служит бледно-розовая окраска избытка титранта КМnО4 (одна капля 0,004 моль/л раствора титранта придает заметную окраску 100 мл раствора). Поэтому, если титруемый раствор бесцветен, о достижении точки эквивалентности можно судить по появлению бледно-розовой окраски избытка титранта КМnО4 при титровании прямым способом или по исчезновению окраски при обратном титровании. При анализе окрашенных растворов рекомендуется использовать индикатор ферроин. К достоинствам перманганатометрического метода относят: 1) возможность титрования раствором КМnО4 в любой среде (кислой, нейтральной, щелочной); 2) применимость растворов перманганата калия в кислой среде для определения многих веществ, которые не взаимодействуют с более слабыми окислителями; 3) стехиометричность и достаточно высокую скорость большинства окислительно-восстановительных реакций с участием МnО4- при оптимально выбранных условиях; 4) возможность титрования без индикатора; 5) доступность перманганата калия. Наряду с перечисленными достоинствами, метод перманганатометрии имеет ряд недостатков: 1) титрант КМnО4 готовят как вторичный стандарт, поскольку исходный реагент – перманганат калия – трудно получить в химически чистом состоянии; 2) реакции с участием МnО4- возможны в определенных условиях (рН, температура и т.д.); 3) титрование раствором КМnО4 не рекомендуется проводить в присутствии С1-, что затрудняет определение некоторых веществ, поскольку НС1 часто применяют для растворения минеральных объектов.
|
|||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 885; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.105.137 (0.082 с.) |
 NaOH+H3BO3
NaOH+H3BO3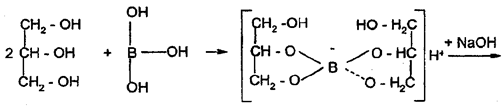
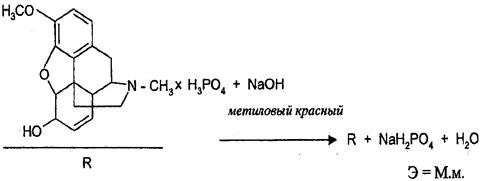
 R+Na2HPO4+ 2H2O
R+Na2HPO4+ 2H2O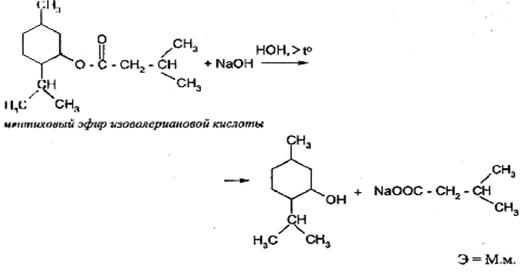


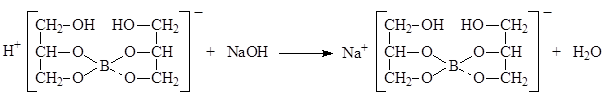
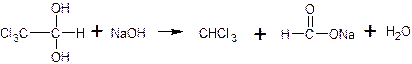

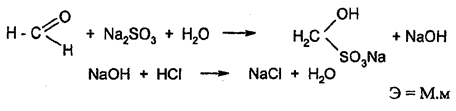

 .
.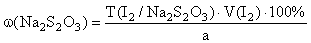
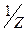 =
=  = 1/6. Молярная масса эквивалента иодата калия равна
= 1/6. Молярная масса эквивалента иодата калия равна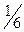 KIO3) = М(KIO3)/6= 35,6668 г/моль.
KIO3) = М(KIO3)/6= 35,6668 г/моль.