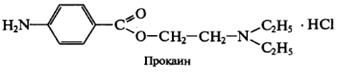Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Натрия йодид и калия йодид методом Мора не определяют, Т. К.
1) йодиды адсорбируются на осадке AgI, окраска появиться до точки эквивалентности (заниженные результаты), 2) окраска осадков серебра йодида и серебра хромата близка по цвету. Метод может быть использован для количественного определения хлоридов и бромидов в ЛП, содержащих ЛB слабо-основного характера (например, натрия бензоат), создающих слабощелочную реакцию среды. Вариант Фаянса (прямое титрование). Титрант: раствор серебра нитрата. Индикаторы - адсорбционные (натрия эозинат, бромфеноловый синий, флюоресциин). Среда разведенной уксусной кислоты необходима, т.к. индикаторы являются слабыми протолитами, а при титровании в уксусной кислоте преобладает ионная форма индикатора. Изменение окраски в т.э. происходит за счет адсорбционных процессов, протекающих на поверхности осадка AgI. Натрия йодид, калия йодид; Титрант: раствор серебра нитрата. индикатор - натрия эозинат. Среда - уксуснокислая (разбавленная CH3COOH). а) NaInd ←→ Ind- + Na+ Эозинат натрия б ) NaI + AgNO3 → AgI↓ + NaNO3 в) Ind- + AgI↓ + AgNO3 → [(AgI)Ag+]Ind-↓ + NO3- Изб.капля Розовый осадок В процессе титрования 0,1н AgNO3 идет осаждение иодид-ионов с образованием коллоидного осадка AgI. Частицы осадка йодида серебра до т.э. будут адсорбировать на своей поверхности вследствие химического сродства одноименные иод-ионы I-. Будет формироваться коллоидная частица AgI · nI- · n К+ Ионы индикатора в этот момент не адсорбируются, а остаются в растворе. В т.э. после полного осаждения йод-ионовI- в избытке Аg+ осадок будет адсорбировать Аg+ и знак заряда частиц осадка будет меняться на положительный AgI·nAg+ Ионная форма индикатора с отрицательным зарядом будет притягиваться положительным зарядом коллоидной частицы и образовывать окрашенное адсорбционное соединение AgI·nAg+·nInd- (от розового в растворе до розового на осадке). Т.о. титрование заканчивается при образовании розового осадка. На точность фиксации т.э. влияет:
Вариант Фаянса может быть применен для определения хлоридов и бромидов. В качестве индикаторов используются бромфеноловый синий или флуоресцеин. Используют для определения НCI и НBr азотистых оснований (новокаин - прокаин).
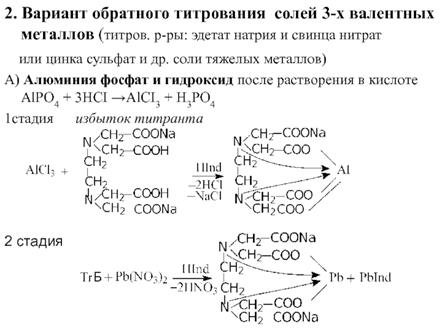
Натрия эозинат не применяют, т.к. он адсорбируется на осадках AgCI и AgBr раньше точки эквивалентности. R ∙ НС1 + AgNO3 → AgCl↓ + R· HNO3 Фольгарда (обратное титрование). Галогены осаждаются избытком титранта серебра нитрата. Не вступивший в реакцию осаждения серебра нитрат, оттитровывается р-ром тиоцианата аммония, индикатор - железоаммонийные квасцы. NaCI +AgNO3(избыток) → AgCI↓ + NaNO3 AgNO3(остаок) +NH4SCN →AgSCN↓ +NH4NO3 Реакция индикации NH4SCN +NH4Fe(SO4)2· 12H2O → Fe(SCN)3 +(NH4)2SO4 + 12H2O красное окр. 1. Комплексонометрия в анализе ЛС. Условия определения и их обоснование: рН среды, способы титрования (прямое, обратное), индикаторы. Показать на примере кальция хлорида, алюминия фосфата. Комплексонометрическое титрование – реакции, основанные на образовании прочных комплексных соединений ионов металлов с комплексоном, при этом изменяются концентрации ионов металлов в титруемом растворе. Кальция хлорид. 1. Комплексонометрический метод (вариант прямого титрования). Метод основан на свойстве ионов кальция образовывать с трилоном Б прочные, бесцветные, растворимые в воде комплексные соединения. Титрант – раствор трилона Б. Индикация – 2 варианта: а) индикатор – хромовый темно-синий; среда – аммиачный буфер с рН 9,5-10,0. Переход окраски от красной к сине-фиолетовой. б) индикатор – кальконкарбоновая кислота; рН среды в конце титрования 12-14. Создается добавлением 30% раствора натрия гидроксида. Переход окраски от розовой к синей. fэкв (кальция хлорида) = 1 Официнальным методом количественного определения кальция хлорида в препарате является комплексонометрический метод с индикатором кислотным хромовым темно-синим (2-(2-оксифенилазо)-1,8-диоксинафталин-3,6-дисульфокислота; относится к группе азокрасителей)
Сущность определения заключается в том, что индикатор в присутствии аммиачного буферного раствора образует с ионом кальция комплексное соединение (розовое окрашивание): Индикатор реагирует с катионом кальция в щелочной среде с образованием вишнево-красного комплексного соединения. При титровании раствором трилона Б в точке эквивалентности происходит изменение окраски раствора на сине-сиреневую. При титровании трилоном Б вначале связываются находящиеся в растворе ионы кальция. Затем Трилон Б связывает ион кальция, содержащийся в менее прочном его комплексе с индикатором. Поэтому в эквивалентной точке раствор приобретает окраску свободного индикатора (сине-фиолетовую). Так как препараты кальция являются фармакопейными препаратами, рассмотрим фармакопейную методику проведения количественного определения кальция хлорида в субстанции. Около 0,8 г (точная навеска) субстанции помещают в мерную колбу вместимостью 100 мл, растворяют в воде и доводят объём раствора водой до метки. К 25,0 мл приготовленного раствора прибавляют 5 мл аммония хлорида буферный раствор pH 10,0, 0,1 г индикаторной смеси хромового тёмно-синего или 0,15 мл раствора хромового тёмно-синего и титруют 0,05 М раствором натрия эдетата до сине-фиолетового окрашивания. 1 мл 0,05 М раствора натрия эдетата соответствует 10,95 мг СаСl2 • 6Н20. Содержание кальция хлорида в препарате должно быть не менее 98,0% [15,16].
Реакция комплексообразования – взаимодействие ионов металла с молекулами или ионными частицами, имеющими по меньшей мере один атом с неподеленной парой электронов, т.е. с веществами, являющимися донорами электронов. Сущность метода комплексонометрии Основан на реакции образования прочных комплексных соединений катионов с органическими реактивами, называемыми комплексонами. Комплексоны являются производными аминополикарбоновых кислот.
|
||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 265; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.198.173 (0.009 с.) |