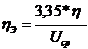Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Красноярский индустриально- металлургический техникумСтр 1 из 9Следующая ⇒
КГБПОУ Красноярский индустриально- металлургический техникум Специальность 22.02.02 Металлургия цветных металлов Учебное пособие для дистанционного обучения студентов По МДК 01.02 Металлургия легких цветных металлов раздел Металлургия алюминия Преподаватель: Баранова Г.Д. Г. Красноярск
Содержание стр. Предисловие 3 1.Сущность процесса электролиза 4 2. Производство фтористых солей 5 3. Производство угольных электродов 8 4. Теоретические основы процесса электролиз 10 4.1Свойства и состав электролита алюминиевых электролизеров 10 4.2 Физико-химические свойства электролита 11 4.3 Напряжение разложения глинозема 14 4.4 Процессы на электродах 15 4.5 Анодный "эффект" при электролизе 15 4.6 Поведение примесей 17 4.7 Поведение примесей при электролизе 18 5. Показатели процесса электролиза алюминия 20 Контрольные вопросы 24
Предисловие В данном пособии приведены краткие сведения о процессе электролитического получения алюминия, необходимые для изучения студентами и выполнения ими контрольных заданий. Рассмотрены темы характеристики сырья и материалов для производства алюминия электролизом, требования, предъявляемые к ним, теория электролиза криолито-глиноземных расплавов, свойства и состав промышленных электролитов, процессы, протекающие вэлектролизере и показатели процесса электролиза.
Изучение этих вопросов позволит студентам получить необходимые знания по междисциплинарному курсу МДК 0.02 и сформировать профессиональные компетенции в соответствии с требованиями ФГОС Данное пособие может быть использовано студентами техникума, обучающихся по специальности 22.02.02 Металлургия цветных металлов 1.Сущность процесса получения алюмини я Сущность электролитического получения алюминия заключается в том, что сырье – глинозем, поступающий на предприятие, развозится по корпусам электролиза и загружается в электролизеры. Он попадает в электролит (расплавленную смесь фтористых соединений, главным из которых является криолит). Криолит 3NaF*AlF3 является единственным растворителем глинозема, поэтому оказавшись в его расплаве, в нем растворяется и под действием электрического тока распадается на ионы (заряженные частицы: + катион, - анион). Al2O3 ↔ Al+3 + AlO2- Образовавшиеся частицы приобретают направленное движение катионы – к катоду, к аноду – анионы. На электродах происходит их разряд: На катод: Al+3 + 3 ē →Al0 На аноде: AlO2- - n ē →O2 + Al+ 3 ион алюминия движется к катоду и там разряжается. На аноде выделяется кислород. Аноды изготовлены из углеродистых материалов, поэтому кислород вступает во взаимодействие с углеродом анода, образуя второй продукт электролиза – анодные газы: СО и СО2 О2 + С -> СО + СО2 Таким образом, в процессе электролиза выделяется жидкий алюминий и отходящие газы. По мере накопления металл выливается из электролизера и перевозится в литейное отделение. Газы после очистки выбрасываются в атмосферу. Теоретические основы электролиза криолито – глиноземных Расплавов Процессы на электродах Анодный процесс при электролизе. Механизм образования анодных газ ов. Глинозем, растворенный в электролите под действием электрического тока диссоциирует (разлагается): Al2О3 → AL+3 + ALO2- К угольному аноду движутся кислород содержащие анионы и разряжаются там
AIO2- - 6 ē → О2 + AI+3 реакция на аноде протекает с участием углерода анода до образования анодных газов СО и СО2 (40 и 60% соответственно). Механизм анодного процесса: при формировании угольного анода углеродистые материалы кристаллизуются в форме гексагональной решетки, в узлах которых находятся атомы углерода. Активность точек на поверхности анода не одинакова. Горение анода происходит через стадию хемосорбции кислорода на активных участках поверхности угля. В результате активированной сорбции на поверхности углерода образуется промежуточное ненасыщенное и не устойчивое соединение СхО переменного состава. Кислород в этих соединениях находится в полу связанном состоянии в результате разложения которых образуются газообразные продукты горения СО и СО2 С+О2 → СхО → СО+СО Катодный процесс. Причины потерь металла. Из всех ионов, находящихся в расплаве на электродах разряжаются те, которые обладают наиболее электро (+) или электро (-) потенциалом. По величинам потенциалов на электродах выделяются ионы алюминия и кислорода. Основным катодным процессом является разряд ионов алюминия: Al+3 + 3e- =Al0 металл выделяется в жидком виде и накапливается на подине ванны, откуда выливается. Основной катодный процесс сопровождается рядом побочных, нежелательных процессов: А) растворение алюминия в электролите Слой расплавленного алюминия, накапливающийся на подине, соприкасается с электролитом, что приводит к его растворению в электролите и потерям алюминия и как следствие снижение выхода по току. Под растворимостью металла в расплавленной соли понимают количество алюминия, которое при данной температуре перешло в расплав и находится в равновесии с ж, катодным алюминием. Меж ↔ Мер-р При наступлении равновесия растворимость прекращается, но если равновесие нарушить, это приведет к растворению новых количеств металла. Определена примерная растворимость А1 в электролите и она составляет 0.35-0.45 %. Растворение А1 в эл-те может протекать 2 путями: 1) металл взаимодействует с собственной солью, это приводит к образованию субсоединения: А1 + AIF3 → AIF или А10 + А1+3 → А1+ 2) металл взаимодействует с расплавленной солью другого металла А1 +NaF → Na+ A1F3 В системе NaF- AIF3 наименьшие потери наблюдаются про КО = 2.3-2.5, т.е при 27% AIF3. С возрастанием содержания AIF3 потери увеличиваются по реакции (1). Вытеснение натрия и растворение алюминия протекает при КО>3, реакция (2). Растворенный алюминий за счет циркуляции электролита выносится при анодное пространство, где окисляется анодными газами, приводит к нарушению равновесия и значительным потерям А1: 3СО2 + 3А1F → А1F3 + 3CО + Al2О3 Повышение температуры приводит к усилению растворимости А1 в эл-те, увеличивая потери. Добавки СаF2 снижают потери, что объясняется увеличением вязкости расплава, а это затрудняет перенос растворенного металла к поверхности расплава и окисления газами. Растворимость А1 уменьшается при повышении поверхностного натяжения на границе металл – электролит. Б) Совместный разряд натрия и алюминия на катоде Катодный процесс может осложняться совместным разрядом ионов Na+ и AI+3 на катоде. А1 является более электро (+), чем натрий металлом. Однако при большой концентрации ионов натрия и высокой температуре может происходить разряд ионов Na++е= Na0 Расход электроэнергии на выделение натрия снижает выход по току А1, поэтому электролиз нужно вести в условиях, исключающих возможность выделение натрия на катоде, к ним относят:
- работа в кисляях электролитах при КО = 2.3-2.5; - избегать перегревов электролита; - не допускать повышения напряжения. Г) Карбидообразование При нормальных условиях выделение А1 на катоде происходит на поверхности расплавленного алюминия, который тоже является катодом. При определенных условиях возможно взаимодействие катодного А1 с угольными блоками подины с образованием карбида: А1 + С → А14 С3 Карбид тугоплавкое соединение и накапливается на подине в виде слоистого осадка, повышая сопротивление и приводит к перерасходу электроэнергии. Наличие карбида увеличивает смачиваемость подины алюминием (поверхностное натяжение А1 падает), что способствует проникновению металла в поры и трещины катодных блоков. Внутри блока металл взаимодействует с углеродом, образуя карбид, а это сопровождается увеличением объема блока на 23%. Подина вспучивается и разрушается. Образование карбида возможно и в объеме электролита из-за взаимодействия растворенного алюминия с углеродом угольной пены. Образующийся карбид оседает на дно ванны или собирается под анодом в виде наростов (грибов). Образованию карбида способствуют: повышение температуры; местные или общие перегревы электролита; повышенное содержание NaF (КО>3); загрязнение электролита угольными частицами (запененность эл-та). Природа карбидообразования до конца не изучена. Для получения карбида из чистых компонентов требуется 20000 С, при электролизе всего 9600С а карбид образуется. Первый закон. Масса вещества, выделившегося на электроде при прохождении постоянного электрического тока через электролит, прямо пропорциональна количеству затраченного электричества, т.е. силе тока и времени его прохождения: m = k * I * τ (1) Коэффициент пропорциональности k называют электрохимическим эквивалентом. Если подставить в уравнение I = 1А, τ = 1 час, то m = k, т.е. электрохимический эквивалент представляет собой массу вещества, выделившегося на электроде при силе тока 1А за 1 час. Значит, он измеряется в: г /(А*ч) или кг /(кА*ч) k =
Второй закон Электрохимические эквивалентывеществ пропорциональны их грамм – эквивалентам: k = где Э - грамм – эквивалент выделившегося вещества на электроде; F – число Фарадея, равно 26,8 А*ч Грамм – эквивалент Э - это масса вещества в граммах, численно равная химическому эквиваленту Х Х = где Ам – атомная масса вещества; n – валентность вещества. Тогда, подставив в уравнение (3) значение Э = Х, получим: k = Отсюда, численные значения электрохимического эквивалента будут для: Al = 0,335 г/(А*ч) Mg = 0,454 г/(А*ч) Cl = 1,323 г/(А*ч) На практике количества металла, который выделяется при электролизе всегда меньше, чем должно было выделиться по закону Фарадея, для определения эффективности работы электролизера (тока) ввели показатель выход по току. Выходом по току η называют отношение массы вещества, фактически полученного при электролизе, к его количеству, теоретически ожидаемому за то же время, согласно закону Фарадея:
где Рпр -производительность электролизера т.е. количество алюминия, фактически наработанное определенным количеством электричества (I*τ); Рт - теоретическое количество алюминия, выделяемое тем же количеством электричества, по закону Фарадея. Производительность электролизера по закону Фарадея пропорционально силе тока, времени и выходу по току: Р = k * I * τ* ηт
Удельный расход электрической энергии является важным показателем работы электролизера, т.к. процесс электролиза является очень энерго затратным. Удельный расход энергии показывает затраты электрической энергии на выпуск единицы продукции (Вт*ч/ кг; кВт*ч/т) Удельный расход электроэнергии W, кВт*ч/т равен: W = где Uср – среднее напряжение на электролизере, В η т –выход по току, % Выход по энергии ηэ, г/(кВт*ч) величина обратная удельному расходу электроэнергии и показывает сколько грамм алюминия выделится при затратах 1 кВт*ч энергии, определяется
КГБПОУ Красноярский индустриально- металлургический техникум Специальность 22.02.02 Металлургия цветных металлов Учебное пособие для дистанционного обучения студентов
|
||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 257; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.149.94 (0.037 с.) |
 (2)
(2) 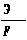 (3)
(3)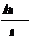 (4)
(4) (5)
(5)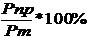 ηт =
ηт =