Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Микроскоп, его устройство и работа с ним ⇐ ПредыдущаяСтр 6 из 6
Готовые окрашенные препараты рассматривают при помощи сложного оптического прибора — микроскопа. Микроскоп служит для изучения малых объектов, невидимых простым глазом. В микробиологии микроскопом пользуются для изучения как живых, так и убитых микробов в окрашенном или неокрашенном виде. В микроскопе различают механическую и оптическую части. Механическая часть микроскопа состоит из штатива, тубуса, предметного столика и системы винтов для настройки изображения: макрометрический винт и микрометрический, один поворот которого поднимает или опускает тубус на 0,1 мм. Микрометрический винт является одной из наиболее хрупких частей микроскопа, и обращение с ним требует особой осторожности. Оптическая часть микроскопа состоит из окуляра, нескольких сменных объективов, закрепленных в револьвере, зеркала и конденсора с диафрагмой. Зеркало служит для отражения световых лучей по направлению к объективу и через него внутрь микроскопа. Одна из сторон зеркала плоская, другая вогнутая. Плоским зеркалом пользуются при дневном рассеянном свете, а вогнутым — при искусственном освещении. Конденсор служит для конденсации пучка световых лучей, что обеспечивает наибольшее освещение исследуемого предмета. При микроскопировании с дневным светом конденсор необходимо поднять до уровня предметного столика; при искусственном освещении конденсор опускают до тех пор, пока при малом увеличении изображение источника света не появится в плоскости препарата. При микроскопировании неокрашенных препаратов конденсор следует также опустить. Между зеркалом и конденсором помещается диафрагма, которая регулирует объем лучей, попадающих в объектив. Состоит диафрагма из стальных лепестков и при помощи рычага может суживаться или расширяться. Окрашенные препараты следует рассматривать при совершенно открытой диафрагме; при рассматривании же неокрашенных препаратов следует сузить отверстие диафрагмы. Объективы составляют наиболее ценную часть микроскопа. Они представляют собой систему двояковыпуклых линз, заключенных в металлическую оправу. Передняя (фронтальная) самая маленькая линза является главнейшей, производящей увеличение. Лежащие за ней линзы называются коррекционными, так как они предназначены для устранения недостатков оптического изображения.
Степень увеличения исследуемого объекта зависит от кривизны линзы объектива, которым мы пользуемся. Чем меньше кривизна линзы, тем меньше увеличение и, наоборот, — чем больше кривизна линзы, тем больше увеличение. Обычно объективы микроскопа имеют цифровое обозначение. В микроскопах старых систем объективы обозначались цифрами: 3, 7, 10,12. Это обозначение длины фокусного расстояния, которое зависит от кривизны линзы. В микроскопах новейших систем на оправе объективов обозначается даваемое ими увеличение: 8, 10, 20, 40, 60, 90. В микроскопах различают два типа объективов: сухие и иммерсионные, или погружные(immergo—погружаю). При исследовании микробов применяется исключительно иммерсионная или погружная система объективов. Эти объективыдают наибольшее увеличение по сравнению с другими объективами. Погружными их называют потому, что при работе с ним прибегают к погружению их в иммерсионную жидкость (кедровое масло). Обычно это делается так: каплю кедрового масла наносят на исследуемый объект, а затем при помощи макрометрического винта объектив погружают в эту капельку. Делается это для того, чтобы пространство между исследуемым объектом и объективом было заполнено кедровым маслом, которое конденсирует лучи, поступающие от препарата в объектив. Кедровое масло имеет примерно такой же коэффициент преломления световых лучей, как и стекло, и этим достигается наименьшее рассеивание световых лучей. РИСУНОК 8 В отличие от иммерсионного объектива все другие объективы называются сухими, так как при работе они не погружаются в масло. Окуляры (от слова oculus — глаз) имеют две линзы: верхняя линза называется глазной, нижняя — собирательной. Расстояние между линзами равно полусумме их фокусных расстояний. Следовательно, по длине окуляра можно приблизительно определить общее фокусное расстояние. А так как с уменьшением фокусного расстояния повышается увеличение окуляра, то более сильными будут короткие окуляры, более слабыми — длинные. В современных микроскопах на окулярах имеются цифры, указывающие на увеличение, которое они дают, например: Х7, Х10 Х15. Общее увеличение микроскопа равняется произведению увеличения объектива на увеличение окуляра. Так, например, комбинация иммерсионного объектива с показателем увеличения 90 и окуляром Х10 дает увеличение объекта в 900 раз.
Микроскопы, которыми мы обычно пользуемся, дают увеличение в 900—1000 раз. При пользовании такими микроскопами пределом видимости являются объекты размером не меньше 0,2 m. Лаборант в своей практической работе должен помнить, что иммерсионный объектив требует особо бережного обращения с ним. Опускать этот объектив нужно осторожно, чтобы не раздавить стекла препарата, что влечет за собой порчу фронтальной линзы. Погружать иммерсионный объектив в каплю масла на предметном стекле надо под контролем глаза, наблюдая за этим сбоку, причем глаз должен находиться на уровне предметного столика. После погружения объектива в каплю масла, глядя в окуляр и пользуясь макрометрическим винтом, осторожно опускают тубус микроскопа еще ниже — до тех пор, пока не находят в поле зрения контуры препарата. Тогда оставляют в покое макрометрический винт и с помощью микрометрического винта устанавливают точное изображение объекта. По окончании микрокопирования сначала поднимают тубус микроскопа, а затем снимают со столика препарат; фронтальную линзу осторожно вытирают мягкой тряпочкой, иногда смачивая ее бензином. Необходимо помнить что иммерсионная жидкость на воздухе образует трудно растворимую пленку, которая может вывести из строя дорогой оптический прибор – иммерсионный объектив.
ИССЛЕДОВАНИЕМИКРОБОВ В ЖИВОМСОСТОЯНИИ Так как методы обнаружения жгутиков трудны, а определение подвижности у микробов служит целям их идентификации, то в повседневной лабораторной практике для определения подвижности пользуются наблюдением бактерий в живом состояния — в раздавленной или висячей капле. Раздавленная капля. На середину предметного стекла наносят петлей или пипеткой каплю исследуемого материала; эту каплю накрывают покровным стеклом, осторожно закладывая его пинцетом, что бы в жидкости не образовалось пузырьков воздуха. Удачно сделанная капля заполняет все пространство между покровным и предметным стеклом, но при этом жидкость не выступает за края покровного стекла. Если требуется рассматривать препарат продолжительное время, то края покровного стекла предварительно смазывают вазелином. Висячая капля. Каплю исследуемого материала наносят на середину обезжиренного покровного стекла. Затем покровное стекло быстро поворачивают каплей вниз и накладывают на предметное стекло с углублением («лункой») в середине. Капля должна свободно свисать в углубление, несоприкасаясь с его дном и краями (рис.17). Края выемки на предметном стекле следует предварительно смазать вазелином, таким образом, капля оказывается герметически закрытой во влажной камере и защищенной от высыхания. Если исследованию подвергается плотный материал, то его предварительно эмульгируют с физиологическим раствором в стерильной пробирке или на стерильном часовом стекле, откуда затем и берут часть материала для приготовления висячей капли. Различают движение поступательное, качательное, вращательное и т. д. При исследовании живых микробов следует отличать активную подвижность бактерий, свидетельствующую о наличии у них невидимых жгутиков, от пассивного молекулярного (броуновского) движения, свойственного всем взвешенным в жидкости мелким частицам (форменным элементам, зернышкам, неорганизованным пылинкам).
РИСУНОК 17 Нативные препараты микроорганизмов очень удобно изучать используя фазово-контрастное микроскопирование. Методика работы с такими микроскопами (или приспособлениями) приведена в некоторых практических руководствах (см. список литературы), а также в инструктивных материалах, прилагаемых к каждому микроскопу. Размеры микрооранизмов можно измерить с помощью объкт- и окуляр-микрометров, технологию работы с которыми можно найти в инструкции по пользованиюэтими приборами.
5. Микрофлора воздуха, воды и почвы. Приготовление последовательных разведений почвенной суспензии. Посев бактериальной суспензии штрихом и методом «сплошной газон».
РАСПРОСТРАНЕНИЕ МИКРОБОВ В ПРИРОДЕ Микробы являются организмами, широко распространенными в природе. Они вездесущи. Мириады их находятся в почве, воде, атмосфере. Живут микробы и в симбиозах с животными, растениями и человеком. Изучение вопроса о распространении микроорганизмов в природе имеет значение с гигиенической и эпидемиологической точки зрения. Биоценотическая значимость микробов известна давно, однако лишь в последние 20 – 30 лет проблемы участия микроорганизмов в функционировании экосистем получили соответствующий приоритет в исследованиях.
МИКРОФЛОРА ПОЧВЫ Наиболее благоприятные условия для своего развития микробы находят в почве и воде. Количество микробов в почве очень велико. В 1 г почвы содержится от нескольких тысяч до нескольких десятков миллионов микробов. Характер этой микрофлоры разнообразный. Наряду с бактериями гнилостного разложения, нитрифицирующими микробами и бродильными грибками, встречаются и болезнетворные виды. Среди последних надо отметить бациллы газовой гангрены, столбняка, сибирской язвы. Многие исследования последних лет показывают что почва является благоприятной средой обитания и для таких возбудителей как бактерии чумы, сальмонеллеза, листериоза и др. Микробы в почве распределяются неравномерно. Меньше их на поверхности, с глубиной количество их увеличивается. Главная масса микробов находится на глубине 10—20 см. По мере дальнейшего углубления количество их становится все меньше и меньше, а на глубине 4 м располагается граница их максимальной концентрации. Ниже мы рассмотрим свойства некоторых групп почвенных микроорганизмов.
МИКРОФЛОРА ВОЗДУХА Несмотря на то, что воздух является неблагоприятной средой для развития микробов, последние находятся в нем постоянно. В воздух микробы попадают с поверхности почвы с пылью и с различными выделениями живых существ. Наиболее частыми обитателями воздуха являются дрожжи, грибки, споровые палочки и пигментные микроорганизмы. В воздухе жилых помещений и в особенности в окружении больных могут находиться и болезнетворные микробы (туберкулезная палочка, палочка дифтерии, возбудитель скарлатины и др.). Количественный и качественный состав микрофлоры воздуха зависит главным образом от количества пыли, которое переносится воздушными течениями. Количество же пыли зависит от ряда причин (высота и широта местности, время года, влажность, населенность и т. д.). Воздух лесов, полей, лугов, а также воздух над водными пространствами вдали от населенных пунктов отличается сравнительной чистотой. Наоборот, в городах с большим уличным движением, в жилых помещениях (особенно в местах большого скопления людей) воздух может содержать большое количество микроорганизмов. Атмосферные осадки способствуют очищению воздуха от микробов. Для ориентировки в относительном содержании микроорганизмов в воздухе можно пользоваться следующим методом. Чашки Петри с застывшим агаром выставляют в открытом виде на разных высотах в помещении на различные сроки (от 1/4 ДО 1 1/2 часов), затем закрывают и ставят в термостат; спустя сутки-двое подсчитывается число выросших колоний. МИКРОФЛОРА ВОДЫ Вода в противоположность воздуху является средой, при годной не только для существования, но и для размножения микробов В силу этого и количество микробов в воде будет значительно больше, чем в воздухе В воду микробы попадаю главным образом из почвы, с отбросами и с выделениями человека и животных, а также из воздуха В воде встречаются самые разнообразные микроорганизмы, главным образом сапрофиты, но в некоторых случаях встречаются и болезнетворные микробы (палочки брюшного тифа, холерный вибрион и др.) Оценка годности воды для употребления осуществляется рядом физических, химических и биологических методов. Мутные и окрашенные воды, воды, пахнущие сероводородом, аммиаком и другими веществами, не могут быть использованы без соответствующей обработки. Примесь в воде различных химических веществ: (аммиак, сероводород, соли азотной к азотистой кислоты), свидетельствует о том, что данный водоем загрязнен органическими веществами, и в первую очередь в таком случае надо иметь в виду испражнения или промышленные отходы. В санитарно-гигиенической практике не только качественный, но и количественный учет микроорганизмов в воде помогает определить пригодность ее к употреблению. Так, вода, содержащая до 500 микробов в 1 мл, считается хорошей, до 1 000 микробов — посредственной, а при наличии нескольких тысяч микробов — плохой.
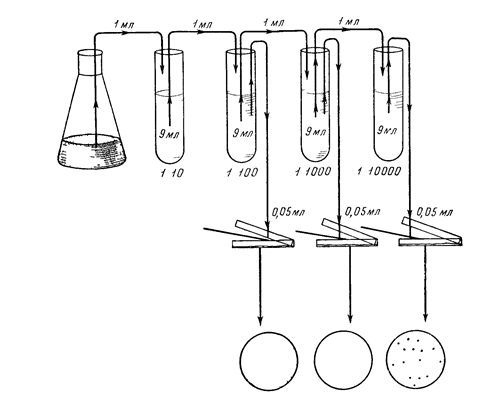
Исследования природных субстратов, таким образом, предполагает определение количества клеток, содержащихся в том или ином объеме субстрата. Число клеток в единице объема можно посчитать различными методами. Иногда, для определения абсолютного числа, проводят прямой счет клеток в исследуемой среде. Однако это отнимает много времени и сил. Часто достаточно относительной количественной оценки. Одним из методов такой оценки является метод высева на плотные среды. Определение количества клеток методом высева на плотные среды (чашечный метод). Сущность метода заключается в высеве определенного объема исследуемой суспензии микроорганизмов на плотную среду в чашки Петри и последующем подсчете выросших колоний. При этом исходят из того, что каждая колония является результатом размножения одной клетки. Чашечный метод особенно широко используется для определения количества микроорганизмов в почве и других естественных субстратах. Однако следует учитывать, что для микроорганизмов, образующих цепочки или другие скопления клеток, результаты по определению их числа будут всегда несколько занижены. Работа этим методом включает три этапа: - приготовление разведений, - посев на плотную среду в чашки Петри, - подсчет выросших колоний. Приготовление разведений. Чтобы получить изолированные колонии, культуру или материал, содержащий микроорганизмы, как правило, разводят. Обычно разведения проводят в стерильной водопроводной воде, пользуясь некоторым постоянным коэффициентом разведения, чаще всего равным 10. Таким образом, получают серию разведений, в которых концентрации клеток образуют геометрическую прогрессию. В ходе одного опыта целесообразно использовать один и тот же коэффициент разведения, так как в этом случае при большом числе подсчетов уменьшается вероятность ошибки. Для приготовления разведении стерильную водопроводную воду разливают по 9 мл в стерильные сухие пробирки. Затем 1 мл исходной суспензии, взятый стерильной пипеткой, переносят в пробирку с 9 мл стерильной воды—это 1-е разведение, 1: 10. Полученную в 1-м разведении суспензию с помощью новой стерильной пипетки тщательно перемешивают, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру выполняют 3—5 раз, что обеспечивает перемешивание суспензии и уменьшает адсорбцию клеток на стенках пипетки. Затем этой же пипеткой берут 1 мл полученного разведения и переносят его во 2-ю пробирку—это 2-е разведение, 1: 100. Таким же образом готовят и последующие разведения. Если используется другой коэффициент разведения, например, 3, тогда 1-е разведение будет 1: 3, 2-е— 1: 9, 3-е—1: 27 и т. д. Степень разведения определяется плотностью исходной суспензии микроорганизмов и соответственно число разведении тем больше, чем больше плотность исходной суспензии. Для приготовления каждого разведения следует обязательно использовать отдельную пипетку. Пренебрежение этой предосторожностью может привести к получению ошибочного результата, иногда в 100 и более раз превышающего истинный. Ошибка связана с адсорбцией микроорганизмов на стенках пипетки, в результате чего не все клетки удаляются из пипетки при каждом разведении. Часть клеток, оставшаяся на стенках пипетки, может затем попасть в одно из последующих разведении, что и явится причиной получения завышенного результата. Посев в чашки. Высевать суспензию можно поверхностным или глубинным способом. Перед посевом суспензии поверхностным способом (рис.) в стерильные чашки Петри разливают расплавленную плотную, чаще всего агаризованную, питательную среду. Среду обычно разливают из большой колбы последовательно в ряд чашек Петри по 15—20 мл в каждую, и чашки оставляют на горизонтальной поверхности, пока агаризованная среда не застынет. Поверхность агаровых сред рекомендуется подсушивать, чтобы образующиеся колонии не расплывались по поверхности агара. Для этого чашки с застывшей средой помещают открытыми в сушильный шкаф, нагретый до 70—80°С. Шкаф предварительно необходимо простерилизовать. Среду подсушивают до появления на ее поверхности муаровой пленки. При этом с крышек чашки Петри удаляется конденсационная вода. В некоторых случаях агаризованную среду подсушивают, помещая чашки в термостат на 2—3 суток крышками вниз. Когда среда готова, на ее поверхность стерильно пипеткой наносят строго определенный объем (0, 05—0, 2 мл ) cooтветствующего разведения.
Этот объем распределяют стерильным стеклянным шпателем по поверхности агаризованной среды в первой чашке Петри.(Метод посева – "сплошной газон") Затем тем же шпателем проводят по поверхности плотной среды во 2-й и 3-й чашках Высевы па плотную среду производят обычно из трех последних разведении Из каждого разведения делают 2—4 параллельных высева Посевы из разведении можно делать одной пипеткой, но начинать следует обязательно с большего разведения Для каждого разведения используют новый стерильный шпатель Засеянные чашки Петри помещают в термостат крышками вниз
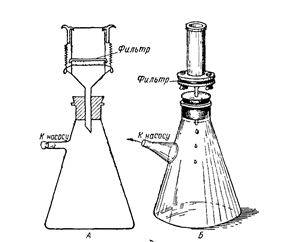
Выросшие колонии подсчитывают, определяя концентрацию клеток в определенном объеме того или иного разведения. Трудно не заметить возможность использования этого метода и для выделения чистых культур микроорганизмов. Изолированные колонии – прекрасная возможность отсеять небольшое количество клеток на скошенный стерильный МПА. В качестве исследуемого субстрата в данном случае может быть не только вода или почва, но и воздух. Для этого на стерильный бумажный фильтр (предварительно взвешенный) осаждают клетки, прокачивая определенное количество воздуха. Принципиальная схема такого исследования показана на рисунке ХХ. Затем фильтр помещают в стерильную воду, где клетки смывают в раствор. Приготовленную суспензию исследуют, как было описано выше.
Рис. ХХ. Схема осаждения на фильтр микрофлоры воздуха.
6. Физиологические особенности микроорганизмов. (среды гисса, пбде, сиб, жидкие среды, антибиотики)
Процесс идентификации микроорганизмов предполагает изучение различных физиолого-биохимических свойств. Среди таких параметров микробов наиболее часто изучают - способность клеток утилизировать или трансформировать разные субстраты: углеводы, аминокислоты, спирты и др. (ферментативные реакции); - наличие на поверхности клеток специфических молекулярных структур (серологические реакции); - соотношение количества разных нуклеотидов в ДНК (геносистематика); - способность поражать тот или иной организм (биопробы).
Для изучения ферментативной активности используют дифференциально-диагностические среды (см. выше). Как правило, это жидкие среды, разлитые в пробирки. Исследуемую культуру обычно засевают в пробирки со скошенного МПА. Чтобы сделать пересев из одной пробирки в другую, обе пробирки, т. е. ту, из которой производится посев, и ту, которая подлежит засеву, захватывают вместе и держат большим и остальными пальцами левой руки. Вынимают сначала пробки из обеих пробирок, набирают материал из пробирки с культурой и вносят в пробирку с жидкой средой, тщательно стерилизуют края пробирок в пламени горелки и закрывают их. (рис. 13). Работая с жидкими средами внимательно следить за тем, чтобы они не вылились из пробирок. РИСУНОК 13 Пересев из жидкой среды можно делать также при помощи стерильной пастеровской пипетки. Использование классических диагностических сред, каковыми являются среды Гисса, трудоемко и дорого, так как они готовятся из большого количества натуральных продуктов. Кроме того, культивирование на таких средах занимает много времени, из-за их значительного объема. В связи с этим, в лабораторной практике постоянно стоит проблема удешевления и ускорения процесса биохимической идентификации. В числе концептуальных предложений, позволяющих, так или иначе, решать названную проблему, можно назвать разработки отечественных авторов. В Нижегородском НИИ эпидемиологии и микробиологии были разработаны и внедрены так называемые системы бумажные индикаторные – СИБ. системы бумажные представляют собой диски или полоски бумаги, пропитанные соответствующими диагностическими питательными средами в строго определенном количестве. Диски помещают в определенный объем физиологического раствора, где среда растворяется. В образовавшийся микрообъем жидкой среды засевают исследуемую культуру микроорганизма. Результат фиксируют по изменению окраски среды. Другой отечественной тест-системой для идентификации является, изготовленная в том же институте пластина биохимическая дифференцирующая (ПБД). Тест-ситема представляет собой панель, изготовленную из нейтральной полимерной пленки с лунками, на дно которых внесены соответствующие субстраты – диагностические среды. Субстраты вносят в лунки в жидком виде, а затем высушивают и стерилизуют. Панель закрывается крышкой и удобна для транспортировки. В лаборатории готовят бактериальную суспензию в физ. растворе, несколько капель которой вносят в каждую лунку, где образуется, таким образом, микрообъем питательной среды, засеянной микроорганизмами. Результаты учитывают по изменяющейся окраске среды. Серологическое исследование основано на специфическом взаимодействии иммунной сыворотки с соответствующим антигеном (взвесью микробов в физиологическом растворе). Реакция иммунных сывороток зависит от наличия в них специфических иммунных антител Форма проявления взаимодействия антигена с антителом различна и зависит от структуры антигена и от среды, в которой происходит их соединение. Внешнее проявление реакции может быть в виде склеивания микробов, т. е. агглютинации, преципитации или осаждения, растворения микробов (бактериолиза) и т. д. Указанные иммунологические реакции специфичны и весьма чувствительны, поэтому серологический метод исследования получил широкое применение. Реакции иммунитета широко применяются с диагностической целью и при производстве лечебных сывороток и вакцин. Методы постановки серологических реакций, как правило, вполне посильны и опубликованы в инструкциях по использованию агглютинирующих сывороток. Методика постановки биопроб сложна не только технологически, но и в связи с необходимостью работать с разными животными, что допускается после специальной подготовки.
7. Антибиотикорезистентность. Методы определения. Рациональное использование антибиотиков. Классификация. Механизмы. Продуценты.
Одним из важных физиологических свойств микроорганизмов является способность синтезировать различные биологически значимые соединения. Среди них антибиотики. Термин «антибиотик», предложенный С. А. Ваксманом в 1942 году, используют для определения веществ, образуемых микроорганизмами и обладающих антимикробным действием. Вместе с тем, разные авторы по-разному определяют этот термин. По мнению З. В. Ермольевой (1946) и других, антибиотиками следует называть продукты обмена любых организмов, способные избирательно убивать микроорганизмы или подавлять их рост. С. М. Навашин И. П. Фомина антибиотиками называют химиотерапевтические вещества, образуемые микроорганизмами или полученные из иных природных источников, а также их производные и синтетические продукты, обладающие способностью избирательно подавлять в организме больного возбудителей заболевания или задерживать развитие злокачественных опухолей. Очевидно, что недостатка в определениях нет. Мы полагаем, что на первом этапе знакомства нас устроит такое: антибиотики – это вещества подавляющие или полностью прекращающие рост и развитие микроорганизмов. Классификация антибиотиков основана на разных свойствах этих веществ. Их можно различать по источнику происхождения: - естественные - искусственные. Продуцентами естественных антибиотиков могут выступать организмы самых разных групп: бактерии - полимиксины (Bacillus polymyxa), грамицидин (Bacillus brevis), левомицетин (Streptococcus venezuelae) и др. актиномицеты – неомицин, канамицин, мономицин, стрептомицин, нистатин и др. (p. Streptomyces); грибы – пеницилин, гризеофульвин (р.Penicillium); растения – аллицины (лук, чеснок); животные – лизоцим. Антибиотики можно дифференцировать на основании их химической структуры: - b - лактамные (пенициллины) - тетрациклины (тетрациклин, олететрин, метациклин); - макролиды (эритромицин, олеандомицин, линкомицин); - аминогликозиды (сизомицин, гентамицин, канамицин); - пептиды (полимиксины, грамицидин). Широкое применение в практике приобрела классификация антибиотиков по спектру действия: - широкого спектра действия, - действующие на грамположительные микробы, - действующие на грамотрицательные бактерии. В связи с распространением антибиотикорезистентности бактерий особый интерес представляет разделение антибиотиков по механизму действия на бактериальную клетку: - подавляющие синтез пептидогликана; - подавляющие синтез нуклеиновых кислот; - ингибиторы синтеза белка; - нарушающие физиологическую активность микроорганизмов. Существуют и другие принципы классификации, с которыми можно познакомится в специальной литературе (Л. Е. Бриан, 1984; Н.С. Егоров, 1994) Упоминавшаяся выше антибиотикорезистентность микроорганизмов вызвала к жизни процедуры контроля за этим свойством у клинически значимых штаммов микробов. Сегодня для успешной борьбы с антибиотикоустойчивыми возбудителя необходимо четко знать их антибиотикограммы – картину чувствительности возбудителя к разным антибиотикам. Обнаружить чувствительность можно разными методами, среди которых для нас наиболее доступным, хотя и не самым репрезентативным, является метод бумажных дисков.
Определение чувствительности микроорганизмов к антибиотикам При определении чувствительности желательно иметь чистые культуры возбудителя и лишь при необходимости срочного получения ответа используют смешанные культуры, содержащие всю микрофлору, имевшуюся в исследуемом материале. Наиболее прост и доступен метод определения чувствительности с помощью дисков, пропитанных антибиотиками. В стерильные чашки Петри, расположенные на горизонтальной поверхности, разливают по 15 мл. плотной питательной среды (чаще всего 2% мясопептонный агар). На поверхность застывшего и слегка подсушенного агара наливают 1 мл суспензии суточной культуры микроба-возбудителя или, если чистая культура не выделена, взятого для исследования патологического материала (гной, экссудат и т. п.), слегка разведенного изотоническим раствором хлорида натрия. Бактериальную взвесь равномерно распределяют по поверхности агара, а ее избыток удаляют пастеровской пипеткой. На поверхности засеянного агара пинцетом раскладывают диски с антибиотиками — по 5—6 дисков на каждую чашку на расстоянии 25 мм от центра чашки. Чашки выдерживают при 37°С 16—18 ч, после чего учитывают результаты опыта путем измерения зон задержки роста микробов вокруг дисков, включая диаметр самого диска. Размер зон зависит от степени чувствительности возбудителя к данному антибиотику. При зоне диаметром до 10 мм штамм расценивается как устойчивый, 11— 15 мм —как малочувствительный, 15—25 мм—как чувствительный. Зоны, превышающие 25 мм, свидетельствуют о высокой чувствительности микроорганизма к данному антибиотику. Однако этот метод нельзя считать количественным. Более точные результаты можно получить, применяя метод серийных разведений в жидкой среде. Бульон Хоттингера (или другую среду, пригодную для роста данного микроорганизма) разливают по 2 мл в пробирки, расставленные в штативы по 10 в каждом ряду. Готовят раствор антибиотика, содержащий 100 ЕД. в 1 мл, и добавляют 2 мл этого раствора в первую пробирку. После тщательного перемешивания новой стерильной мерной пипеткой переносят 2 мл из этой пробирки в следующую и т. д. до девятой пробирки, из которой 2 мл выливают. Десятая пробирка, не содержащая антибиотика, служит контролем роста культуры. Для постановки этого опыта вместо стандартов антибиотиков можно с успехом использовать имеющиеся в продаже препараты, на этикетке которых указано количество единиц во флаконе. Например, если флакон содержит 500000 ЕД. пенициллина, то, добавив в него 10 мл дистиллированной воды, получают раствор, содержащий в 1 мл 50000 ЕД. при дальнейшем разведении в 100 раз получают раствор с концентрацией пенициллина 500 ЕД./мл. Для получения требуемой концентрации 100 ЕД./мл нужно развести этот раствор еще в 5 раз; это разведение делают при помощи бульона и 2 мл. полученного раствора вносят в первую пробирку. Таким образом, в первой пробирке концентрация пенициллина 50 ЕД./мл., во второй — 25 ЕД./мл. и т. д. Если на этикетке препарата дозировка указана в весовых единицах, следует иметь в виду, что для большей части антибиотиков 1 г. активного вещества соответствует 1000000 ЕД. Из этого расчета и следует разводить антибиотик. Если порошок антибиотика расфасован не мерно и на этикетке указано количество единиц активности в 1 мг, необходимо к точной навеске препарата (20—25 мг.), сделанной на аналитических весах, добавить равный объем растворителя, т. е. получить раствор мг./мл., в 1 мл. которого содержится столько единиц, сколькоихбыло указано на этикетке. Из этого основного раствора делают дальнейшие разведения по указанной выше схеме. Суточную агаровую культуру испытуемого микроба смывают изотоническим раствором хлорида натрия и, определив густоту взвеси по стандарту мутности, разводят до густоты 10000 микробов в 1 мл. Полученную взвесь по 0, 2 мл. вносят во все пробирки ряда, начиная с контрольной. Таким образом, во всех пробирках содержится в 1 мл. 1060 микроорганизмов. Результаты опыта учитывают после инкубации при 37°С в течение 18—20 ч. Последняя пробирка с прозрачным бульоном при наличии густого роста в контроле определяет минимальную, подавляющую рост данного микроорганизма концентрацию антибиотика. Для определения чувствительности микробов к сульфаниламидам может быть применен любой из указанных методов, причем во внимание принимается только степень разведения навески препарата. Общую чувствительность к сульфаниламидам, как и к антибиотикам, можно определить методом канавки. На агаре в чашке Петри по ее диаметру прорезают канавку, в которую вносят определенное разведение изучаемого препарата. Перпендикулярно к канавке засевают штрихом изучаемые культуры микроорганизмов. После инкубации при 37°С 18—20 ч отмечают наличие участков задержки роста микроорганизмов, если последние чувствительны к данному препарату. Выделение и практическое использование веществ антибиотической природы основано на взаимоотношениях между микроорганизмами разных видов. В настоящее время обнаружены также антимикробные вещества, действующие внутри одного вида, что и отличаетих от антибиотиков. Микроорганизмы вступают в самые различные взаимоотношения как с другими группами организмов, так и между собой. Одним из таких типов взаимоотношений характерных для микробов является МЕТАБИОЗ. Такой тип взаимоотношений предполагает последовательное использование продуктов жизнедеятельности одних видов другими. В результате микроорганизмы образуют сложные ассоциации, последовательно утилизирующие сложные органические субстраты Наглядным примером такой ассоциации являются микробы участвующие в процессах превращения соединений азота. Эта группа микроорганзмов интересна и своей важнейшей биосферной ролью. 8) Физиологические группы микробов. Синтетические среды. Круговорот азота. Приготовление сред.
Азот – один из главных компонентов атмосферы. Все организмы так или иначе соприкасающиеся с воздухом, соприкасаются и с азотом. Вместе с тем растения постоянно испытывают недостаток минерального азота, что затрудняет синтез новых клеточных структур, прежде всего белковой природы. Несмотря на бескрайние запасы молекулярного азота в атмосфере, растениям доступен лишь связанный азот почвы. КРУГОВОРОТ АЗОТА Рис. 21. Круговорот азота. Окисление азота показано сплошными стрелками, восстановление — точечными, а реакции без изменения валентности — пунктирными стрелками. РИСУНОК 21 Связанный азот в форме аммиака, нитрата и органических соединений относительно дефицитен в почве и воде и часто представляет собой фактор, ограничивающий развитие живых организмов. По этой причине циклическое превращение азотистых соединений играет первостепенную роль в снабжении необходимыми формами азота различных по пищевым потребностям организмов биосферы. Основные этапы циклического превращения азота схематически показаны на рис.21. ФИКСАЦИЯ АЗОТА Подсчитано, что количество азота, участвующего в круговороте, составляет 108—109 т в год. Тот факт, что в атмосфере имеется неисчерпаемый запас газообразного азота (N2), тогда как на земной поверхности наблюдается относительный дефицит связанного азота, позволяет предположить, что этапом, ограничивающим скорость круговорота, является процесс фиксации азота. Это в основном биологический процесс, и единственными организмами, способными его осуществлять, являются бактерии. Некоторое количество азота фиксируется при грозовых разрядах, под действием ультрафиолетовых лучей, при работе электрического оборудования и двигателей внутреннего сгорания; однако небиологические процессы такого рода несущественны в количественном отношении, так как все вместе они дают не более 0, 5% всего фиксированного азота. Даже вклад промышленного производства азотных удобрений по методу Хабера составляет лишь около 5%. Таким образом, свыше 90% общей фиксации азота обусловлено метаболической активностью определенных бактерий. Биологическая фиксация азота в природе осуществляется частично свободноживущими бактериями (несимбиотическая фиксация азота), а частично бактериями, существующими в сообществе с растениями (симбиотическая фиксация азота). Наиболее важными и изученными микроорганизмами, способными к симбиотической фиксации азота, являются бактерии рода Rhizоbium, внедряющиеся в корневые волоски бобовых растений и развивающиеся в образованных на корнях клубеньках, где и происходит фиксация азота. Ферментативный аппарат для фиксации азота синтезируется бактерией; растение-хозяин обеспечивает условия, благоприятствующие проявлению этого св
|
|||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 125; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.18.220.243 (0.095 с.) |