Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Врожденный изолированный трахеальнопищеводный свищСтр 1 из 13Следующая ⇒ Глава 8. Редкие синдромы
ГАСТРОЭНТЕРОЛОГИЯ
Врожденный изолированный трахеальнопищеводный свищ
Код по МКБ-10 Q39.2. Врожденный трахеально-пищеводный свищ без атрезии.
Врожденное изолированное соединение трахеи и пищевода - трахеально-пищеводный свищ (ТПС) - составляет 1-4% всех заболеваний пищевода в детском возрасте, чаще встречается у мальчиков.
Классификация
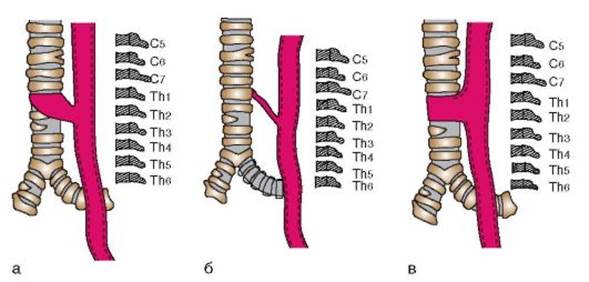
Встречаются три основных анатомических варианта ТПС (по Баирову Г.А., 1968): • короткий и широкий (рис. 8-1, а); • длинный и узкий (рис. 8-1, б); • соединение трахеи и пищевода без свищевого канала (рис. 8-1, в).
Рис. 8-1. Анатомические варианты ТПС (пояснения в тексте)
Ход свища обычно косой - от трахеи вниз, к пищеводу, его отверстие в пищеводе открывается на передней стенке также на достаточно высоком уровне, в шейном или верхнегрудном отделе, в пределах позвонков CVI - ТhIII.
Клиническая картина
У многих больных клиническая картина ТПС характеризуется классической триадой основных симптомов: • кашлем и поперхиванием при приеме пищи; • явлениями аспирационной пневмонии; • вздутием живота, которое возникает в результате прямого попадания воздуха из трахеи в пищевод и желудок. Про данное заболевание образно говорят: «Ребенок со свищом дышит в свой живот». Особенно вздутие увеличивается при кашле и плаче. Однако выраженность этих признаков может быть различной как по интенсивности, так и по сочетанию.
Диагностика
Для подтверждения диагноза необходимы рентгенологическое и эндоскопическое исследования больного. К рентгенологическим методам относятся обзорная рентгенография грудной и брюшной полостей, контрастная эзофагоскопия и эзофагография, контрастная эзофагоскопия с использованием электронно-оптического преобразователя.
Лечение
Лечение только оперативное.
Прогноз
Прогноз благоприятный при своевременном хирургическом лечении.
Врожденный стеноз пищевода
Код по МКБ-10 Q39.3. Врожденные стеноз и стриктура пищевода.
Среди всех заболеваний пищевода врожденные сужения составляют у детей от 2 до 6%.
Классификация
Врожденный стеноз пищевода (ВСП) подразделяется на две формы: циркулярные сужения, в большей или меньшей степени напоминающие песочные часы, и мембранозные сужения с центральным или эксцентрически расположенным отверстием. Его возникновение связано с задержкой процесса рассасывания эпителиальных масс, заполняющих просвет пищевода, что может привести к образованию стеноза.
Клиническая картина
Наиболее частыми симптомами ВСП у детей любого возраста являются рвота, срыгивания, регургитация, дисфагия, дефицит массы тела и расстройства дыхания (одышка, цианоз и др.), связанные с приемом пищи. В дальнейшем формируется хроническая пневмония, а также могут обнаруживаться инородные тела в пищеводе.
Диагностика
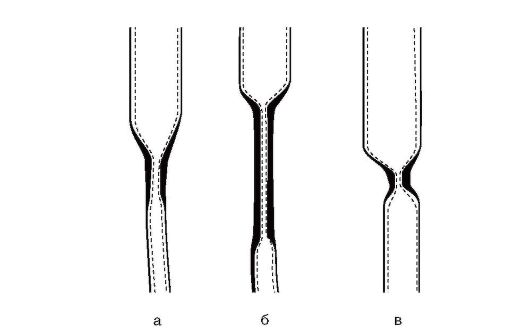
Рентгеноскопия пищевода является высокоинформативным методом при ВСП. Выделяют три наиболее часто встречаемых варианта рентгенологической картины ВСП: • короткий циркулярный (рис. 8-2, а); • длинный циркулярный (рис. 8-2, б); • циркулярный в форме песочных часов (рис. 8-2, в).
Рис. 8-2. Рентгенологические варианты ВСП (пояснения в тексте)
В связи с тем, что многие дифференциально-диагностические вопросы решаются с помощью рентгенографии, а также тщательным выяснением анамнеза заболевания, эзофагоскопию применяют только в случаях, когда происхождение сужения остается неясным.
Лечение
Лечение ВСП возможно консервативными методами или с помощью операции. До настоящего времени не определены четкие показания к каждому из них. Независимо от возраста больного и формы ВСП начинать лечение следует с бужирования. Операция показана только тем больным, у которых полностью отсутствовал эффект от консервативного лечения или наблюдалось временное улучшение после трех курсов бужирования. Разработаны новые методы оперативного вмешательства, что увеличило выживаемость детей с данной врожденной патологией.
Прогноз
Прогноз благоприятный при своевременных диагностике и лечении.
Синдром Маллори-Вейсса
Код по МКБ-10 Этиология и патогенез
Повышение внутрижелудочного давления, перерастяжение и разрыв слизистой оболочки возникают вследствие дискорреляции замыкательной функции кардиального и пилорического сфинктеров, а также выпадения слизистой оболочки желудка в просвет пищевода и ущемления ее в кардиальном жоме. Предрасполагающими факторами разрывов считаются: • малая растяжимость слизистой оболочки кардиальной части желудка вследствие фиксации ее внежелудочными связками и продольного расположения складок; • наличие скользящей грыжи пищеводного отверстия диафрагмы, которую обнаруживают более чем у 50% больных; • трофические изменения слизистой оболочки вследствие хронических заболеваний ЖКТ.
Классификация
Изолированная пищеводная локализация трещин встречается в 8% случаев, желудочная - в 44%, почти в половине всех случаев синдрома Маллори-Вейсса разрыв слизистой оболочки переходит с желудка на пищевод. Следует различать свежие трещины, когда от момента разрыва прошло не более 1-2 сут, и поздние. По глубине разрывов выделяют три стадии: • I - повреждение только слизистой оболочки, когда возможно самоизлечение или образование субкардиальной язвы; • II - разрыв слизистого и подслизистого слоев, при котором повреждаются кровеносные сосуды и возникает кровотечение; • III - разрыв всех слоев желудка или пищевода, при котором развиваются перитонит, медиастинит или пневмоторакс.
Клиническая картина
Синдром Маллори-Вейсса проявляется частой рвотой на фоне имеющихся заболеваний, таких как хронический гастрит, хронический холецистит и др. У детей эти заболевания могут сопровождаться лихорадкой, что, как известно, способствует гиперемии слизистых оболочек и повышенной хрупкости сосудов. Перед проявлением синдрома дети могут страдать респираторными заболеваниями, быть оперированы по поводу острого аппендицита; также синдром может развиться после лечения салицилатами в связи с ревматической инфекцией и может быть связан с нарушениями диеты, когда вначале возникает рвота пищей, а затем - кровью. Распознать синдром Маллори-Вейсса при внешнем осмотре и пальпации желудка удается очень редко.
Диагностика
Диагностика синдрома Маллори-Вейсса остается сложной и проводится с учетом современных методов исследования. Эзофагогастроскопию можно считать основным методом диагностики, так как ничто не может быть достовернее, чем визуальное обнаружение разрыва слизистой оболочки в типичном месте. Диагноз устанавливают в 94-97% случаев. Эндоскопическая картина при этом заболевании довольно характерна. На высоте кровотечения в кардиальном отделе желудка или в пищеводе обнаруживают продольные одиночные или множественные трещины (рис. 8-3, а). Края разрывов отечны, пропитаны кровью, покрыты сгустками крови и фибрином. Глубину трещин определить трудно, дном их часто является мышечный слой. Со дна разрыва из-под сгустков крови иногда отмечается подтекание свежей крови. Однако даже при эндоскопии о природе обнаруженной патологии не всегда можно говорить с уверенностью, идет ли речь о кровоточащей трещине, язве или эрозии (см. рис. 8-3, а). В то же время эзофагогастродуоденоскопия позволяет выявить сопутствующие заболевания желудка и ДПК, которые имеют место почти у 50% больных с синдромом Маллори-Вейсса. Значение рентгенологического исследования в диагностике синдрома Маллори-Вейсса незначительное, так как поверхностные разрывы не видны, а глубокие обычно заполняются сгустками крови и никак не проявляются. В последнее время диагностическое значение при синдроме Маллори-Вейсса приобретает селективная ангиография, которая может превратиться и в лечебную процедуру за счет эмболизации сосудов желудка.
Лечение
Лечение синдрома Маллори-Вейсса с годами претерпело большие изменения. Вначале больных подвергали хирургическому лечению, летальность при этом составляла 50-59%. С внедрением в практику эндоскопии и более эффективных способов консервативной терапии хирургическое лечение (ушивание трещин, рис. 8-3, б) проводят у 30-35% больных, при этом летальность снизилась до 14%. В настоящее время около 90% больных лечат консервативно, а летальность составляет 3%. Операционная летальность сохраняется на уровне 15%, что объясняется более тяжелым контингентом больных, у которых консервативное лечение оказалось неэффективным. Консервативное лечение: холод, антациды, стимуляторы свертывающей системы крови, ε-аминокапроновая кислота в/в и внутрь и т.д. Прогноз
Отдаленные результаты лечения больных с синдромом Маллори-Вейсса зависят главным образом от сопутствующих заболеваний желудка, ДПК и пищевода. В отдельных случаях наблюдаются повторные разрывы слизистой оболочки пищеводно-кардиальной области и рецидивы кровотечения.
Рис. 8-3. Синдром Маллори-Вейсса: а - трещины слизистой оболочки пищеводно-желудочного соустья (эндоскопическая картина); б - схема ушивания трещин
Код по МКБ-10 Клиническая картина
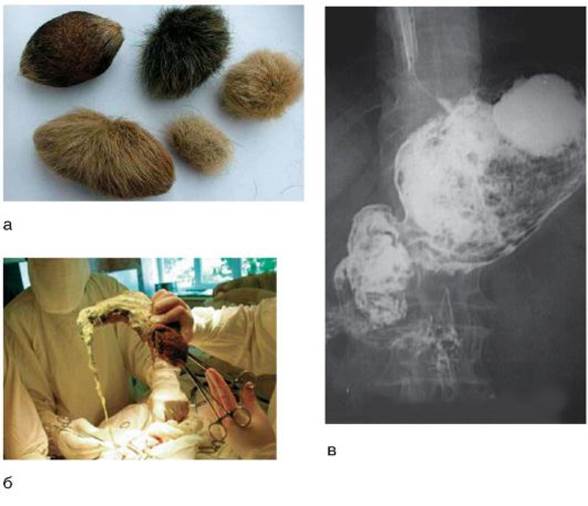
Проявления безоаров желудка и ДПК зависят от природы, размера, массы, локализации и давности их образования, а также от нервно-психического состояния больного и осложнений, связанных с безоаром. В диагностике имеют значение анамнестические данные о вредных привычках пациента. Наиболее частыми симптомами являются боли в эпигастральной области, тошнота, тухлая отрыжка, рвота. Боли чаще тупые, но могут быть схваткообразными, распространяясь на низ живота, что бывает обусловлено частичной или полной закупоркой тонкой кишки. Иногда больные ощущают «перекатывание мяча» в желудке. Многие больные жалуются на общую слабость, быстрое насыщение, плохой аппетит, похудение. При исследовании крови выявляется анемия. Заболевание может протекать волнообразно, периодически обостряясь по мере накопления безоаров в желудке и затихая после эвакуации их из желудка в ДПК или с рвотными массами наружу. При достаточной величине безоара в эпигастральной области можно прощупать опухолевидное образование, безболезненное и легко смещаемое. Общее состояние и показатели лабораторных исследований у подростков меняются мало, в то время как у детей младшего возраста появляются отеки, гипопротеинемия, анемия, обусловленные метаболическими нарушениями, недостаточной абсорбцией фолиевой кислоты и витамина B12, бурным размножением бактерий в верхнем отделе тонкой кишки. Безоары могут способствовать образованию ЯБ желудка и ДПК, что может быть связано с трофическими нарушениями в слизистой оболочке и нарушениями желудочной секреции. Частота образования язв при фитобезоарах составляет 25%, при трихобезоарах - 10%. Безоары значительно отягощают течение ЯБ. Перфорация желудочной язвы чаще наблюдается при трихобезоарах. Имеются случаи малигнизации язвы желудка при безоарах, а также сочетания безоаров желудка с карциномой. Безоары могут вызывать непроходимость желудка, двенадцатиперстной и тонкой кишки. Диагностика
Большое место в обнаружении безоаров желудка и ДПК отводится рентгенологическому исследованию (рис. 8-4, в). При безоарах желудка и ДПК наиболее информативным является эндоскопическое исследование, которое позволяет не только поставить правильный диагноз, но и установить природу безоара и оценить состояние слизистой оболочки желудка и ДПК.
Рис. 8-4. Безоары желудка и ДПК: а - безоары эмбрионального происхождения; б - этап операции: выведение трихобезоара из желудка; в - рентгеноконтрастное исследование: безоар в желудке
Лечение
Лечение безоаров в каждом отдельном случае индивидуальное. При небольших и мягких безоарах, при отсутствии осложнений следует проводить консервативное лечение, включающее питье натощак теплых минеральных вод, молока и 10% раствора гидрокарбоната натрия, массаж живота, лечебную гимнастику, прием слабительных средств. В последние годы получил распространение метод размельчения и удаления безоаров при эзофагогастродуоденоскопии с последующим вымыванием содовым раствором и удалением специальной петлей. При трихо-, шеллако-, миксо-, пиксобезоарах, при крупных фитобезоарах, а также при отсутствии эффекта от консервативного лечения показано хирургическое вмешательство (см. рис. 8-4, б).
Прогноз
Непосредственные и отдаленные результаты хирургического лечения безоаров желудка и ДПК при отсутствии осложнений, как правило, хорошие.
Код по МКБ-10 Этиология и патогенез
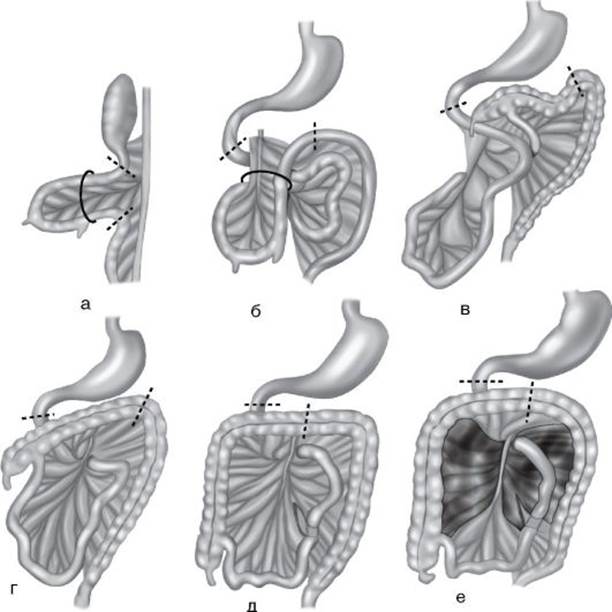
Возникновение аномалий кишечника во время вращения первичной трубки плода (рис. 8-5) связано с влиянием неблагоприятных факторов в конкретные сроки гестации. Периоды вращения первичной кишки плода • I период вращения начинается на 5-й неделе гестации, когда первичная кишка висит в сагиттальной плоскости на брыжейке (рис. 8-5, а), а с 8-й недели петля средней кишки, находящаяся в пупочном канатике, поворачивается на 90° против часовой стрелки из сагиттальной в горизонтальную плоскость (рис. 8-5, б). • II период вращения начинается на 10-й неделе внутриутробного развития. Происходит поворот кишки на следующие 180° и одновременное самопроизвольное вправление пупочной грыжи (рис. 8-5, в). В итоге на 11-й неделе слепая кишка оказывается в правом верхнем квадранте, кишечник повернулся на 270° (рис. 8-5, д). • III период вращения - слепая кишка опускается в свое обычное положение - правый нижний квадрант, но брыжейка еще не фиксирована на задней брюшной стенке (рис. 8-5, д). Окончательный поворот первичной кишки заканчивается фиксацией брыжейки на задней стенке брюшной полости (рис. 8-5, е).
Рис. 8-5. Схематическое изображение нормального поворота первичной трубки плода: а, б - I период; в, г - II период; д, е - III период вращения
Классификация
Расстройства поворотов первичной кишки плода: - I периода вращения - грыжа пупочного канатика; - II периода вращения - несостоявшийся поворот кишечника, непроходимость ДПК, внутренняя грыжа, поворот в обратном направлении, синдром Ледда; - III периода вращения - высокое расположение, подвижная слепая кишка, ретроцекальное положение аппендикса.
Клиническая картина
Дуоденальная непроходимость у детей старшего возраста наблюдается редко и обычно не диагностируется, так как клиническая картина напоминает ЯБ, холецистит, панкреатит и другие заболевания этой зоны. Порок заключается во внутриутробном нарушении вращения средней кишки вокруг общей брыжейки, высоком расположении слепой кишки и наличии тяжей брюшины, которые сдавливают просвет ДПК. Сдавление происходит чаще в верхней половине нисходящей ее части. При нарушении проходимости ДПК появляются ощущение тяжести после еды, боли в эпигастральной области, тошнота, рвота с примесью желчи. В ряде случаев частичная закупорка ДПК сочетается с заворотом тонкой кишки, создавая клиническую картину острой высокой кишечной непроходимости. Этот синдром получил название «синдром Ледда».
Диагностика
При рентгенологическом исследовании в вертикальном положении обнаруживают неравномерное распределение газа по кишечнику, горизонтальные уровни в желудке и кишках. Отделы ДПК выше препятствия удлинены, расширены и могут образовывать дополнительные изгибы. Контур вдавления, как правило, четкий, протяженностью до 1 см. Дуоденоскопия в сочетании с рентгеноскопией позволяют исключить ЯБ ДПК. При непроходимости, вызванной нарушением поворота ДПК, переход ее в тонкую кишку находится справа от позвоночника. Для синдрома Ледда характерно смещение слепой кишки кверху, однако нормальное положение толстой кишки не исключает аномалии вращения ДПК. Дооперационная диагностика данной патологии затруднена.
Лечение
Лечение больных с незаконченным поворотом кишечника хирургическое.
Прогноз
Прогноз не всегда благоприятный из-за поздней диагностики и несвоевременного оперативного вмешательства.
Болезнь Гиршпрунга
Код по МКБ-10 Q43.1. Болезнь Гиршпрунга.
Болезнь Гиршпрунга - аномалия развития толстой кишки, приводящая к нарушению иннервации фрагмента кишки (врожденному аганглиозу) и проявляющаяся упорным запором. Болезнь названа по имени датского педиатра H. Hirshprung, описавшего ее в 1887 г. По данным разных авторов, частота болезни Гиршпрунга колеблется от 1:1000 до 1:20 000. Мальчики болеют в 4-5 раз чаще девочек.
Этиология и патогенез
Болезнь возникает из-за врожденного нарушения иннервации кишечника, приводящего к снижению (вплоть до отсутствия) перистальтики аганглионарного сегмента. На определенном его участке, чаще ампулярной части прямой кишки или дистальном отделе сигмовидной кишки, отсутствует нормальная структура нервных мейсснеровых и ауэрбаховых сплетений. Возможно наличие аганглиоза и в вышележащих отделах толстой кишки. Крайне редко поражается подвздошная кишка. Чем выше начало зоны аганглиоза, тем тяжелее протекает болезнь, поскольку в вышележащих отделах скапливается кишечное содержимое и возникает упорный запор. Аганглиарный участок кишки сужен, а выше места сужения кишка растянута (рис. 8-5, а).
Классификация
Различают следующие анатомические формы болезни Гиршпрунга: • ректальную, с поражением части прямой кишки (25% случаев); • ректосигмоидальную, с поражением части прямой кишки и дистальной трети сигмовидной кишки (70%); • сегментарную, с поражением одного сегмента сигмовидной кишки и более (1,5%); • субтотальную, с поражением левой половины и распространением процесса на правую половину толстой кишки (3%); • тотальную, с поражением всей толстой кишки и иногда части тонкой кишки (0,5%). Клиническая картина
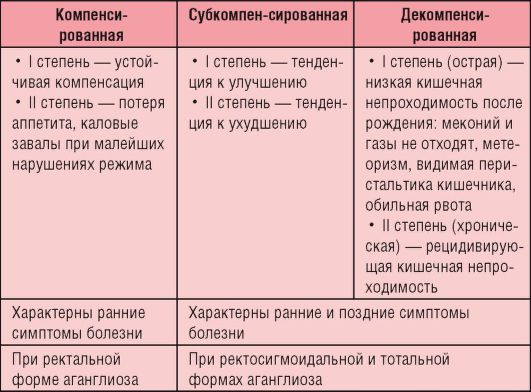
У новорожденных и детей грудного возраста клиническая картина своеобразна и разнообразна, что связано с протяженностью и высотой расположения зоны аганглиоза по отношению к анальному отверстию. Чем протяженнее зона аганглиоза и чем выше она расположена, тем острее и ярче проявляются симптомы заболевания. В раннем возрасте заболевание включает триаду симптомов: • запор; • увеличение живота; • повторный илеус (кишечная непроходимость). У детей старшего возраста характерны ранние и поздние проявления. Запор с первых дней (недель) жизни усиливается при введении плотной пищи; стул - только после клизмы, метеоризм - с первых дней жизни, отмечается «лягушачий» живот (рис. 8-5, б). Поздние проявления включают анемию, гипотрофию, рахитоподобную деформацию грудной клетки, каловые камни (рис. 8-5, в), каловую интоксикацию. Выделяют следующие клинические стадии заболевания: компенсированную, субкомпенсированную и декомпенсированную (табл. 8-1).
Таблица 8-1. Стадии болезни Гиршпрунга
Окончание табл. 8-1
Рис. 8-5. Болезнь Гиршпрунга: а - схематическое изображение увеличенной сигмовидной кишки; б - внешний вид больной; в - преимущественная локализация каловых масс; г - этап оперативного вмешательства
Диагностика
Диагностика тем сложнее, чем младше ребенок, так как такие симптомы, как задержка стула и вздутие живота, часто встречаются у младенцев. Обязательные диагностические процедуры: • УЗИ кишечника; • обзорная рентгенография брюшной полости в вертикальном положении больного (наличие расширенных петель толстой кишки с горизонтальными уровнями или без них); • ирригография; • боковая рентгенограмма после опорожнения кишки (определение ширины ретроректального пространства); • биопсия; • аноректальная манометрия; • гистохимический и морфометрический методы (в специализированных учреждениях). Лечение
При явлениях непроходимости кишечника, связанных с энтероколитом, применяют антибактериальную терапию и ежедневные клизмы с изотоническим раствором. Купирование явлений энтероколита приводит к исчезновению непроходимости. Радикальной и обязательной операции (рис. 8-5, г) предшествует консервативное лечение: послабляющая диета, очистительные и сифонные клизмы, симптоматическая терапия. Прогноз
Прогноз благоприятный при ректальной форме и своевременном оперативном вмешательстве.
Спаечная болезнь брюшины Код по МКБ-10 Этиология и патогенез
Хирургические вмешательства на брюшной полости являются непосредственной причиной образования спаек. Любой воспалительный процесс в брюшной полости как результат травмирования брюшины и воздействия инфекционного агента приводит к активации иммунного ответа с участием медиаторов воспаления, цитокинов, иммунных клеток, в результате чего образуются патологические иммунные комплексы. Эти комплексы прикрепляются к клеткам здоровых тканей и вызывают активацию системы комплемента. Цитотоксические реакции, вызванные их активацией, приводят к повреждению ткани и упорному течению воспалительного процесса, сопровождающегося пролиферацией соединительной ткани, способствуя тем самым усилению спаечного процесса в брюшной полости. Классификация
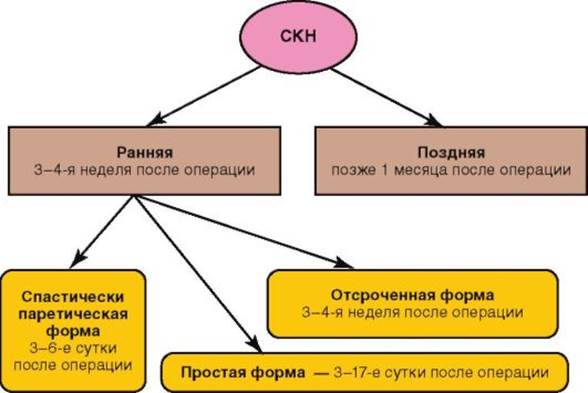
Классификация СББ (Гатауллин Н.Г., 1978) основана на клиническом течении заболевания с учетом его тяжести и позволяет определить наиболее удобную тактику ведения больных. В ней выделены 4 формы заболевания: • латентная бессимптомная форма СББ; • спаечная болезнь с преобладанием болевого синдрома; • спаечная болезнь с преобладанием дискомфорта в ЖКТ; • СКН (рис. 8-6). Таблица 8-2. Основные формы и клинические проявления СББ
Рис. 8-6. Формы СКН у детей (по Баирову Г.А., 1983) Клиническая картина
Клиническая картина спаечной болезни и спаечных сращений брюшной полости вариабельна. Она складывается из симптомов, обусловливающих тяжесть общего состояния больного, и местных проявлений (табл. 8-2). Правильно собранный анамнез, в котором особое значение отводится выявлению перенесенных ранее воспалительных процессов и оперативных вмешательств на органах брюшной полости, а также давность заболевания, являются ведущими в постановке диагноза. Важно правильно провести пальпацию живота в целях выявления некоторых характерных симптомов, механизм которых основан на принципе висцеросенсорных рефлексов и связан с появлением болевых ощущений при растяжении спаек: - симптом Блинова - боль в рубце при наклоне туловища вперед; - симптом Андросова - боль в эпигастрии при глубокой пальпации гипогастральной области; - симптом Хунафина - появление болей при искусственном надувании живота (при спайках любой локализации). При развитии острой СКН, помимо острых, схваткообразных болей, рвоты застойным содержимым, вздутия живота, задержки стула и газов, при осмотре выявляют асимметрию живота, видимую перистальтику кишечных петель на передней брюшной стенке, шум плеска, шум падающей капли. В поздние сроки присоединяются перитонеальные явления, лихорадка, нейтрофильный лейкоцитоз, резкое повышение СОЭ. Диагностика
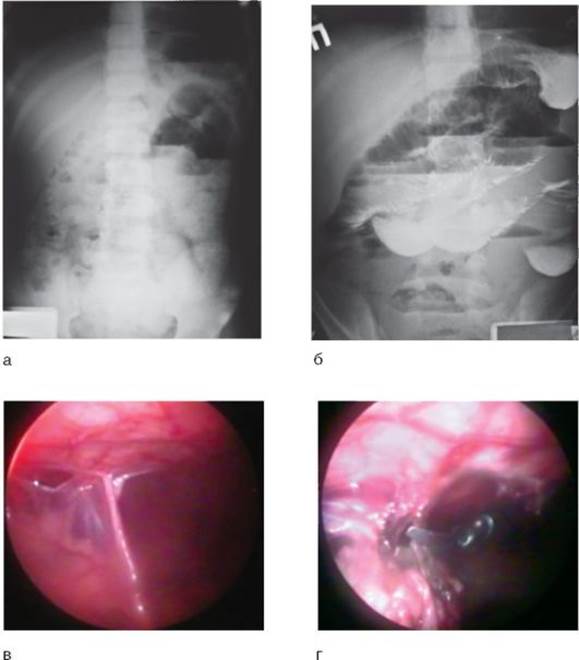
Ведущая роль в диагностике принадлежит рентгенологическому исследованию. Основные симптомы СББ, выявляемые при обзорной рентгенографии органов брюшной полости (рис. 8-7, а): • неравномерное распределение газов в петлях кишечника; • чаши Клойбера и арки, позволяющие определить уровень кишечной непроходимости. Однако прямых признаков, позволяющих определить размеры, вид, локализацию спаек, при данном методе исследования нет. Более информативной признана методика рентгенологического исследования ЖКТ с контрастированием сернокислым барием. Время появления контрастного вещества в слепой кишке в норме - 3-4 ч с момента приема бариевой взвеси per os. Выявляют косвенные признаки спаечного процесса (рис. 8-7, б): • фиксацию петель кишечника к передней брюшной стенке, послеоперационному рубцу или другим органам; • конгломераты петель тонкой кишки с неравномерной скоростью эвакуации контрастного вещества; • сужение сегментов тонкой кишки, расширение и утолщение стенки кишки выше спаек, образование ложных дивертикулов в тонкой кишке за счет тракции ее спайками. Перспективным и наиболее информативным методом диагностики СББ является диагностическая лапароскопия (рис. 8-7, в). Лечение
Борьба с уже сформированными спайками брюшной полости до настоящего времени остается сложной и до конца не решенной задачей абдоминальной хирургии. На практике большую часть операций выполняют в экстренном порядке при возникновении ситуации, угрожающей жизни больного.
Рис. 8-7. СББ: а - обзорная рентгенограмма органов брюшной полости; б - рентгеноконтрастное исследование ЖКТ в прямых проекциях; в - лапароскопическая картина; г - рассечение коагулированной спайки
В зависимости от клинических проявлений заболевания (от изолированного болевого синдрома до выраженной картины СКН) применяют декомпрессию ЖКТ путем введения назогастрального зонда и промывания желудка, блокады, гипертонические компрессы на переднюю брюшную стенку, медикаментозную стимуляцию кишечника путем введения антихолинэстеразных средств, очистительные и гипертонические клизмы, снижение болевого синдрома путем введения спазмолитиков. Данные мероприятия позволяют купировать кишечную непроходимость без оперативного вмешательства. Сроки консервативного лечения определяются в пределах 10-12 ч, а при улучшении общего состояния могут быть продлены до 24-36 ч. При неэффективности консервативного лечения и ярко выраженной картине СКН вопрос о хирургическом вмешательстве решается однозначно. При диагностической лапароскопии она может перейти в лечебную при подтверждении наличия спаек в брюшной полости. Данная операция называется лапароскопическим адгезиолизисом. Она мало инвазивна, позволяет максимально снизить травматичность оперативного вмешательства и улучшить отдаленные результаты лечения СББ. Суть операции состоит в визуализации спаек брюшной полости и их коагуляции с последующим рассечением (рис. 8-7, г).
Профилактика
В ежедневной хирургической практике необходимо соблюдение принципов неспецифической интраоперационной профилактики спайкообразования, т.е. уменьшение инвазивности вмешательства, травмы, ишемии тканей. Специальные (частные) методы профилактики предусматривают назначение препаратов, действующих в разных направлениях: • фибринолитических ферментов (стрептокиназы, урокиназы, коллагеназы и др.); • протеолитических ферментов (трипсина, химотрипсина и др.); • антикоагулянтов (низкомолекулярного гепарина); • противовоспалительных препаратов (антибиотиков); • неспецифических десенсибилизирующих средств (антигистаминных препаратов); • препаратов гиалуронидазы (лидазы). Кроме того, в послеоперационном периоде пациенты группы риска развития СББ нуждаются в назначении препаратов, замедляющих синтез коллагена и усиливающих его утилизацию. В комплексе с обычной противовоспалительной терапией им необходимо назначение пеницилламина (купренила*) внутрь с 3-х суток после операции в течение 10-14 дней в следующих дозировках: до 5 лет - 0,15 г; 5-12 лет - 0,3 г; старше 12 лет - 0,45 г. В целях разрушения и утилизации коллагеновых волокон одновременно проводят фонофорез коллализина со 2-3-го дня после операции по 10-15 сеансов. Для предупреждения развития послеоперационного пареза кишечника используют электростимуляцию, иглорефлексотерапию, пролонгированные блокады рефлексогенных зон брюшной полости, гипербарическую оксигенацию.
Профилактика
Важным моментом является осведомленность больных и их родителей в отношении клинического течения СББ и необходимости врачебной консультации в целях ранней диагностики заболевания и предупреждения СКН и других осложнений. После перенесенного оперативного лечения и выписки из стационара все больные должны быть взяты на диспансерный учет с регулярными осмотрами не реже 2 раз в год. Рекомендуют проведение реабилитационных мероприятий, направленных на повышение общей резистентности организма, на профилактику воспалительных заболеваний.
Прогноз
Прогноз неблагоприятный в случае позднего оперативного вмешательства при СКН, летальность при которой может составить 5-7%. В ходе длительного течения спаечного процесса с частыми рецидивами кишечной непроходимости может развиться стойкая инвалидизация больных.
ГЕПАТОЛОГИЯ Болезнь Вильсона-Коновалова Код по МКБ-10 Этиология и патогенез
Заболевание обусловлено низким или аномальным синтезом церулоплазмина - белка, транспортирующего медь (ATP7B); его структура представлена на рис. 8-8, а. Ген ATP7B, мутации которого вызывают заболевание, расположен на хромосоме 13.
Рис. 8-8. Болезнь Вильсона-Коновалова: а - структура церулоплазмина (белка ATP7B); б - кольцо Кайзера-Флейшера
Основную роль в патогенезе играют нарушение обмена меди, ее накопление в нервной, почечной, печеночной ткани и роговице, а также токсическое повреждение медью данных органов. Нарушение метаболизма выражается в нарушении синтеза и снижении в крови концентрации церулоплазмина, участвующего в процессе выведения меди из организма. Для проявления заболевания имеют значение экзогенные воздействия, поражающие печень, - интоксикация и инфекции.
Клиническая картина
Болезнь начинается в детском возрасте и имеет хроническое прогрессирующее течение. Во многих случаях появлению симптомов поражения нервной системы предшествуют висцеральные расстройства в виде нарушения деятельности печени и желудочно-кишечных расстройств. ХГ с развитием цирроза, портальной гипертензии клинически проявляется гепатоспленомегалией, отеками, гемолитической анемией, тромбоцитопенией, лейкопенией. Неврологическая патология: экстрапирамидные симптомы в виде мышечной ригидности, гиперкинезов, нарушений координации. Могут быть дизартрии, пирамидные симптомы, чувствительность обычно не нарушена. Расстройства психики в виде депрессий, фобий у подростков; астенизация, повышенная утомляемость у детей младшего возраста. Типичный симптом - кольцо Кайзера-Флейшера - желтовато-зеленая или зеленовато-коричневая пигментация по периферии роговицы, содержащая зеленовато-бурый пигмент меди. Более выражен при поздних формах заболевания, когда кольцо становится полным (рис. 8-8, б). Также могут отмечаться желтовато-коричневая пигментация кожи туловища и лица, геморрагические явления (кровоточивость десен, носовые кровотечения, положительные пробы щипка и жгута), мраморность кожи, акроцианоз. Редко отмечаются поражения сердца (кардиомиопатия, аритмии), костей (остеомаляция, остеопороз), почечный тубулярный ацидоз (глюкозурия, аминоацидурия, фосфатурия, уратурия, протеинурия).
Диагностика
При наличии признаков поражения печени, нервной системы и кольца Кайзера-Флейшера диагноз болезни Вильсона- Коновалова не вызывает сомнения. Для диагностики используют осмотр с помощью щелевой лампы, при котором обнаруживают зеленое кольцо Кайзера-Флейшера на роговице у лимба. Диагноз подтверждается результатами следующих исследований: • содержанием меди в сыворотке крови (выше 80 мкг/100 мл, или 9,4 ммоль/л); • концентрацией церулоплазмина (ниже 20 мг/100 мл, или 1 мкмоль/л); • экскрецией меди с мочой (более 100 мк/сут, или 1,6 мкмоль); • определением меди в биоптате печени - золотой стандарт (содержание меди более 50 мкг в 1 г сухого вещества печени).
Патоморфология
Печень вследствие формирования крупноузлового или смешанного цирроза бугристая, участки нормальной ткани чередуются с зонами дегенерации и некроза, островками регенерации; обильное новообразование сосудов приводит к появлению анастомозов между ветвями воротной и нижней полой вены. В головном мозге поражаются чечевицеобразное ядро с образованием мелких кист, хвостатое ядро, глубокие слои коры, мозжечок, в частности зубчатые ядра, подбугорные ядра. В почках поражаются в основном проксимальные канальцы.
Лечение
Патогенетическое лечение направлено на увеличение выведения меди из организма. Для выведения меди из организма применяют комплексоны (тиоловые соединения). Препаратом выбора является пеницилламин (купренил*) - комплексообразующее соединение, которое оказывает дезинтоксикационное и иммунодепрессивное действие, образует хелатные комплексы с ионами меди. Начальная доза - 250 мг, затем ее постепенно увеличивают до 0,75-1,5 г/сут. Доза считается эффективной, если суточное выведение Cu2+ с мочой (после 1-й недели лечения) превышает 2 мг. В дальнейшем адекватность дозы определяют на основании измерения содержания свободной Cu2+ в сыворотке крови (оно должно быть <10 мкг/мл). В отдельных случаях суточная доза может составлять 2 г и более.
Лечение пеницилламином сопровождается заметным улучшением состояния больных или даже приводит к полной ликвидации симптомов. Вполне удовлетворительные результаты получены и при применении унитиола*. Димеркаптопропансульфонат натрия (унитиол*) увеличивает выведение меди из металлосодержащих ферментов клеток; препарат выпускается в 5% растворе в ампулах по 2 и
|
||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 154; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.129.100 (0.005 с.) |