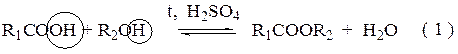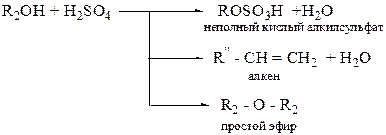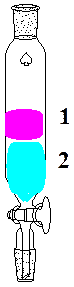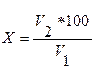Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 4. Кислотные свойства карбоновых кислот
Реактивы и материалы: 1. Уксусная кислота (СН3СООН) 2. Щавелевая кислота (НООССООН) 3. Бензойная кислота (С6Н5- СООН) 4. Лакмусовая бумага 5. Фенолфталеин Порядок проведения опыта: В пробирку № 1 помещают небольшое количество щавелевой кислоты, добавляют 3-4 мл дистиллированной воды, перемешивают до полного растворения. В пробирку № 2 помещают небольшое количество бензойной кислоты, добавляют 3-4 мл дистиллированной воды, перемешивают до полного растворения. В пробирку № 3 помещают небольшое количество уксусной кислоты (3-4 мл). В каждую пробирку опускают полоску лакмусовой бумаги, по изменению цвета судят о рН среды. В каждую пробирку добавляют 1-2 капли фенолфталеина, отмечают изменение окраски. Результаты наблюдений заносят в таблицу.
Выводы: …………………………………………………………………………… ……………………………………………………………………. ОПЫТ 5. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА УКСУСНУЮ КИСЛОТУ И ЕЕ СОЛИ Реактивы и материалы: 1. Уксусная кислота (СH3COOH) 3. Гидроксид натрия (10% раствор) 2. Сода (NaHCO3) 4. Хлорид железа (1% раствор). Проведение опыта: 1. В пробирку наливают 2-3 мл уксусной кислоты. Затем шпателем добавляют небольшое количество соды. Наблюдения: ………………………………………………………………………… Уравнение реакции солеобразования (получение ацетата натрия):
2. В пробирку наливают 3 мл конц. СН3СООН и 3 мл воды. Полученный раствор нейтрализуйте 2-3 каплями 10%-ного раствора NaOH, используя для контроля универсальную индикаторную бумагу. Затем к полученной соли добавьте по каплям (2-3 капли) раствора хлорида железа (III) до появления желто-красной окраски ацетата железа. Наблюдения: ………………………………………………………………………… Реакции: Выводы: ……………………………………………………………………… ……………………………………………………………………………….
ОПЫТ 6. ВЗАИМОДЕЙСТВИЕ КИСЛОТ СО СПИРТАМИ (РЕАКЦИЯ ЭТЕРИФИКАЦИИ) Реактивы и материалы: 1. Уксусная кислота; 2. Изоамиловый спирт; 3. Серная кислота (Н2SO4) конц.
Проведение опыта: 1. В сухую пробирку наливают 3 мл изоамилового спирта. 2. Добавляют (осторожно по стенке!) 2 мл уксусной кислоты, затем 0,5 мл серной кислоты. 3. Пробирку закрывают пробкой с газоотводной трубкой. 4. Нагревают пробирку (осторожно!) до кипения и кипятят в течение 30-40 сек, опуская конец газоотводной трубки в приемник с дистиллированной водой. 5. По окончании нагрева, пробирку охлаждают и выливают ее содержимое в приемник. Отмечают запах образовавшего эфира……………………………………………… 6. По аналогии проводят опыт с этиловым спиртом. Уравнение реакции образования сложного эфира (изоамилацетата):
Выводы: …………………………………………………………………… ……………………………………………………………………………….. Лабораторная работа № 4 ЭТЕРИФИКАЦИЯ Цель работы – изучение свойств карбоновых кислот и спиртов, проведение реакции этерификации, с последующим анализом сложных эфиров. Реактивы: 1. Уксусная кислота (СН3СООН); 2. бутиловый спирт (С4Н9ОН), изобутиловый спирт ((СН3)2СН-СН2ОН), изоамиловый спирт ((СН3)2СН - СН2 – СН2 – ОН); 3. серная кислота (Н2SO4); 4. гидрокарбонат натрия NaHCO3 (5 %); 5. сульфат натрия безводный (Na2SO4). Химическая посуда и материалы:
1 – круглодонная колба; 2 – ловушка Дина-Старка; 3 – Холодильник Либиха; 4 – делительная воронка; 5 – химический стакан емкостью 150 – 200мл; 6 – коническая колба; электроплитка; стеклянная палочка; шпатель; рефрактометр, пипетка, «кипелки». Выполнение работы: 1. Записывают основное уравнение реакции для своего спирта:
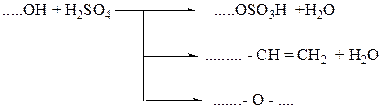
2. Записывают уравнения побочных реакций для своего спирта:
(2)
3. Заполняют таблицу 1 в соответствии с вариантом, выданным преподавателем. Справочные материалы, варианты, пример расчета приведены в табл. 1 и 2 (приложение 1). Приложение 1 следует скачать с сайта кафедры.
Таблица 1 Расчетные данные для проведения синтеза
4. Собирают установку для синтеза сложного эфира (рис. 1), согласно схеме: 1 – электронагреватель; 2 – колба круглодонная; 3 – ловушка Дина - Старка; 4 – холодильник Либиха; 5 – «кипелки». 5. Проводят синтез, получая сложный эфир: 5.1. В колбу заливают расчетное количество спирта, уксусной кислоты и 2 мл серной кислоты. Осторожно перемешивают, вносят «кипелки». 5.2. Затем собирают и запускают установку. Контроль за реакцией, осуществляют по объему выделившейся воды в ловушке. Количество воды в ловушке должно быть приблизительно равным «расчетному». Обычно синтез заканчивают при прекращении поступления воды в ловушку насадки Дина – Старка.
Рис.1. Установка для синтеза эфира Рис. 2. Делительная воронка с Ткип. Выше 100˚С
По окончании синтеза замеряют воду в ловушке насадки, содержимое ловушки и реакционной колбы переносят в делительную воронку (рис. 2). Далее, добавляют 30-40 мл воды, встряхивают, дают расслоиться, нижний слой, содержащий уксусную и серную кислоты, удаляют. Затем, промывают 30-50 мл раствора углекислого натрия (Na2CO3) и 30-50 мл воды. При промывке смесь в делительной воронке энергично встряхивают для лучшего перемешивания эфира и промывочного раствора, дают расслоиться и нижний промывочный слой удаляют. Эфир переносят в коническую колбу, выливая через (верхнюю!!!) часть делительной воронки. 5.3 Полученный эфир сушат безводным кристаллическим сернокислым натрием (Na2SO4), для чего в колбу вносят небольшими порциями соль и встряхивают. После просветления эфира, замеряют объем полученного эфира и определяют показатель преломления на рефрактометре. 5.4. Рассчитывают по формуле выход эфира в % от расчетного (Х):
V2 -объем полученного эфира, мл, V1 – расчетное к-во эфира. 5.5. Данные заносят в таблицу 2.
Таблица 2. Результаты проведения синтеза
Выводы: ……………………………………………………………………………… ……………………………………………………………………………… …………………………………………………………………………….. ……………………………………………………………………………. Лабораторная работа № 5 Окси- аминокислоты Цель работы – познакомиться с химическими свойствами алифатических и ароматических окси- и аминокислот.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 384; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.243.184 (0.018 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 СН3СООН + NaHCO3
СН3СООН + NaHCO3 
 СН3СООН + (СН3)2СН – СН2 – СН2ОН (Н2SO4)
СН3СООН + (СН3)2СН – СН2 – СН2ОН (Н2SO4)