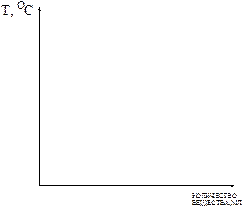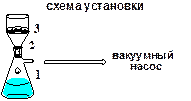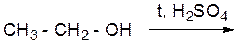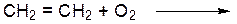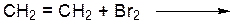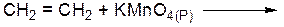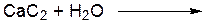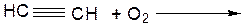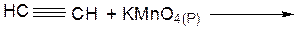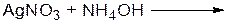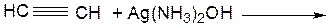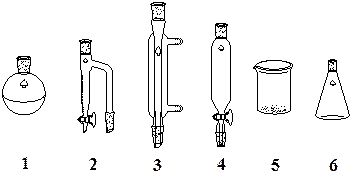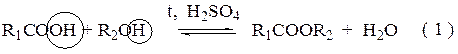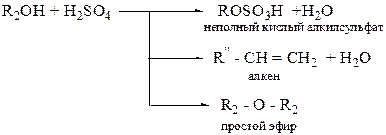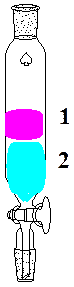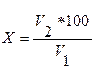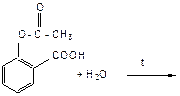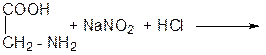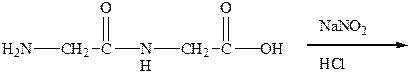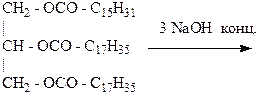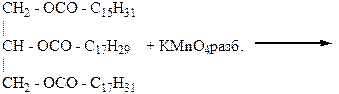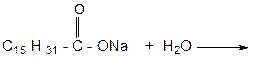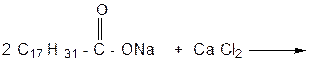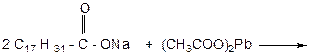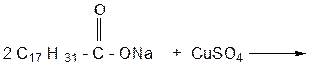Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фгбоу впо «кемеровский технологический институт пищевой промышленностиСтр 1 из 8Следующая ⇒
ФГБОУ ВПО «Кемеровский технологический Институт Пищевой промышленности Кафедра органической химии Лабораторные работы по органической химии Учетный лист студента гр.__________ ___________________________________
КЕМЕРОВО 2015
Лабораторная работа № 1 Методы очистки органических соединений (перегонка, перекристаллизация) ПЕРЕГОНКА Цель работы – знакомство с одним из методов очистки и разделения жидкостей - перегонкой. Перегонка - процесс разделения жидкой смеси на составляющие компоненты путем нагревания ее до кипения и конденсации паров в виде дистиллята в холодильнике, основанный на различии давления паров и, как следствие, температур кипения разделяемых веществ. Реактивы: 1. Смеси для перегонки (определяются преподавателем); 2. Стандартные растворители (четыреххлористый углерод ССl4, гексан С6Н14, ацетон (СН3)2С=О); Химическая посуда и приборы:
1 – термометр; 2 – колба Вюрца; 3 – холодильник Либиха; 4 – алонж; 5 – приемная колба (коническая); 6 – мерный цилиндр (в количестве 2). 7 – электрическая плитка или колбонагреватель; прибор для определения показателя преломления (рефрактометр). Выполнение работы: 1. Собирают установку для простой перегонки при атмосферном давлении согласно схеме (в случае перегонки больших количеств мерный цилиндр заменяют конической колбой – приемником).
1 – электроплитка (колбонагреватель); 2 – колба Вюрца; 3 – термометр; 4 – холодильник Либиха; 5 – алонж; 6 – мерный цилиндр (приемная колба); 7 – «кипелки».
2. В колбу Вюрца помещают 25 мл исследуемой смеси или известного растворителя, добавляют «кипелки» (для обеспечения равномерного нагрева) и начинают перегонку. 3. Колбу с жидкостью нагревают до кипения. Определяют температуру первой капли и далее, по указанию преподавателя, температуру кипения при определенных объемах перегоняемой жидкости. Полученные значения заносят в таблицу № 1 и строят график.
4. Перегонку заканчивают, когда в колбе остается некоторое количество жидкости (перегонка досуха категорически запрещается!). 5. По окончании перегонки установку разбирают. 6. Замеряют объем перегнанной жидкости. 7. Определяют показатель преломления перегнанного вещества (до четвертого знака после запятой), сверяют с «табличным». Результаты заносят в табл.№ 2. 8. Рассчитывают выход вещества, используя пропорцию: V1 – 100%; где V1 – объем исходного вещества, мл (25 мл); V2 – Х %; где V2 – объем перегнанного вещества, мл. 9. По окончании работы делают вывод. Таблица 1. Изменение температуры кипения в процессе перегонки
Таблица № 2. Результаты перегонки
Рис. 1 График зависимости изменения температуры кипения в зависимости от объема перегоняемого вещества. Выводы: ………………………………………………………………………………………… ………………………………………………………………………………………. ПЕРЕКРИСТАЛЛИЗАЦИЯ Цель работы – очистка одного из твердых веществ путем перекристаллизации. Кристаллизация – один из простейших методов разделения и очистки твердых веществ. Для того чтобы достичь высокой степени чистоты, может потребоваться неоднократная перекристаллизация. Реактивы: 1. Загрязненная бензойная кислота (С6Н5СООН) или мочевина ((NH2)2C=O); 2. Стандартные растворители (четыреххлористый углерод (ССl4), этиловый спирт (С2Н5ОН), вода); 3. Активированный уголь. Химическая посуда:
1 – колба Бунзена; 2 – воронка Бюхнера; 3 – химический стакан емкостью 100 – 250 мл. Приборы и материалы: электроплитка, вакуумный насос, весы технические; фильтры бумажные. Выполнение работы:
1. Выбор растворителя Растворитель должен удовлетворять следующим требованиям: А) растворять вещество при нагревании и не растворять примеси (или наоборот), а при охлаждении вещество должно кристаллизоваться из данного растворителя; Б) не должен химически взаимодействовать с веществом; В) должен быть доступен и по возможности нетоксичен. 1.1. В три пробирки помещают одинаковое количество исследуемого вещества. 1.2. В каждую из них наливают по 2-3 мл растворителя, затем добавляют: в пробирку № 1 – воду; в пробирку № 2 – этиловый спирт; в пробирку № 3 – четыреххлористый углерод. 1.3. смесь хорошо встряхивают и визуально отмечают растворимость. 1.4. смеси (осторожно!) нагревают и визуально отмечают растворимость 1.5 смеси охлаждают и отмечают начало кристаллизации. 1.6. Данные заносят в таблицу 1 и по результатам эксперимента выбирают растворитель. Таблица 1 Выбор растворителя
2. Перекристаллизация ВНИМАНИЕ!!! Предварительно готовят 3 бумажных фильтра размер которых совпадает с внутренним диаметром воронки (2 – для фильтрования, 1 – запасной).
2.1. Собирают установку для фильтрования согласно схеме.
1 – колба Бунзена; 2 – воронка Бюхнера; 3 – бумажный фильтр.
2.2. В химический стакан, емкостью 100-150 мл помещают 2,0 – 2,5 г бензойной кислоты. Растворение производят при постоянном перемешивании, как можно в меньшем количестве растворителя, чтобы получился насыщенный раствор. Смесь осторожно нагревают.
2.3. Перед фильтрованием колбу Бунзена и воронку Бюхнера ополаскивают (осторожно!) горячей водой в объеме 100 мл. В воронку Бюхнера помещают бумажный фильтр и хорошо смачивают водой (для более плотного прилегания), излишки воды отгоняют с помощью вакуумного насоса.
2.4. Горячий раствор быстро (осторожно!) фильтруют на установке, по окончании фильтрования стакан промывают небольшим количеством растворителя, который добавляют к фильтрату.
2.5. Фильтрат из колбы Бунзена переносят в чистый стакан, колбу Бунзена ополаскивают небольшой порцией растворителя (для уменьшения потерь при фильтровании), эту порцию растворителя также добавляют к фильтрату. Бумажный фильтр выбрасывают. Воронку тщательно промывают. 2.6. Стакан с раствором и частично образовавшимися кристаллами помещают в емкость со снегом. Охлаждение производят до тех пор, пока не закончится процесс кристаллизации. 2.7. Собирают установку вновь, используя новый бумажный фильтр. Образовавшиеся кристаллы отфильтровывают и промывают небольшим количеством холодного чистого растворителя. 2.8. Очищенное кристаллическое вещество аккуратно с фильтра переносят на лист фильтровальной бумаги и сушат до постоянной массы.
2.9. Рассчитывают выход вещества, используя пропорцию: М1 – 100%; где М1 – масса исходного вещества, г; М2 – Х %; где М2 – масса очищенного вещества, г. X = M2 ∙ 100 / M1, % Выводы: ……………………………………………………………………………… ……………………………………………………………………………… ……………………………………………………………………………..
Лабораторная работа № 2 Углеводороды Цель работы – ознакомиться со способами получения, физическими и химическими свойствами углеводородов – алканов, алкенов, алкинов. ОПЫТ 1. Химические свойства алканов Реактивы и материалы: гексан, пентан, циклогексан, бромная вода, раствор перманганата калия (KMnO4 2%) а) Реакция с бромной водой Проведение опыта: В пробирку с алканом (3-4 мл) по каплям добавляют бромную воду. (Внимание! Опыт проводить в вытяжном шкафу!)
Результаты опыта:................................................................................................................
…………………………………………………………………………
………………………………………………………………………… б) Реакция с перманганатом калия Проведение опыта В пробирку с алканом (3-4 мл) по каплям добавляют раствор перманганата калия. Результаты опыта: …………………………………………………………………………
………………………………………………………………………… Вывод: …………………………………………………………………………
………………………………………………………………………… ОПЫТ 2. ПОЛУЧЕНИЕ ЭТИЛЕНА И ЕГО СВОЙСТВА Реактивы и материалы: 1. этанол (С2Н5ОН) 2. бромная вода 3. серная кислота конц. (Н2SO4) 4. раствор перманганата калия (2%) 5. песок 6. газоотводная трубка 7. держатель пробирки 8. спиртовка а) получение этилена Проведение опыта: ВНИМАНИЕ!! Предварительно готовят пробирки с бромной водой и раствором перманганата калия. В сухую пробирку наливают (осторожно!) 2 мл этанола и 4 мл серной кислоты, добавляют несколько крупинок песка, закрывают пробкой с газоотводной трубкой, хорошо прогревают всю пробирку над спиртовкой, затем нижнюю часть – над пламенем спиртовки. При появлении признаков кипения поджигают газ, выделяющийся из конца газоотводной трубки. Результаты опыта: ЦВЕТ ПЛАМЕНИ: ………………………………………. УРАВНЕНИЕ РЕАКЦИИ ПОЛУЧЕНИЯ ЭТИЛЕНА:
УРАВНЕНИЕ РЕАКЦИИ ГОРЕНИЯ ЭТИЛЕНА:
б) реакция с бромной водой Проведение опыта: Предварительно готовят пробирку с бромной водой (высота слоя 4-5 см). После того, как этилен получен, конец газоотводной трубки помещают в пробирку с бромной водой на несколько секунд. Результаты опыта: УРАВНЕНИЕ РЕАКЦИИ ЭТИЛЕНА С БРОМНОЙ ВОДОЙ:
………………………………………………………………………… в) Реакция с перманганатом калия Проведение опыта О пыт проводят аналогично, используя вместо бромной воды перманганат калия.
Результаты опыта: УРАВНЕНИЕ РЕАКЦИИ ЭТИЛЕНА С ПЕРМАНГАНАТОМ КАЛИЯ:
………………………………………………………………………… Вывод …………………………………………………………………………
………………………………………………………………………… ОПЫТ 3. ПОЛУЧЕНИЕ АЦЕТИЛЕНА И ЕГО СВОЙСТВА Реактивы и материалы: 1. карбид кальция (CaC2) 2. нитрат серебра (AgNO3 1%) 3. раствор аммиака (NH4 ОН 5%) 4. бромная вода 5. серная кислота конц. (Н2SO4)
а) получение ацетилена Проведение опыта: ВНИМАНИЕ!! Предварительно готовят пробирки с бромной водой и раствором перманганата калия. В сухую пробирку помещают несколько кусочков карбида кальция, доливают 1 мл воды, закрывают пробкой с газоотводной трубкой. Поджигают газ, выделяющийся из конца газоотводной трубки. Результаты опыта: ЦВЕТ ПЛАМЕНИ: ……………………………………….
УРАВНЕНИЕ РЕАКЦИИ ПОЛУЧЕНИЯ АЦЕТИЛЕНА:
УРАВНЕНИЕ РЕАКЦИИ ГОРЕНИЯ АЦЕТИЛЕНА:
б) реакция с бромной водой Проведение опыта: Предварительно готовят пробирку с бромной водой (высота слоя 4-5 см). После того, как ацетилен получен, конец газоотводной трубки помещают в пробирку с бромной водой на несколько секунд. Результаты опыта: УРАВНЕНИЕ РЕАКЦИИ АЦЕТИЛЕНА С БРОМНОЙ ВОДОЙ:
в) Реакция с перманганатом калия Проведение опыта О пыт проводят аналогично, используя вместо бромной воды раствор перманганата калия. Результаты опыта: УРАВНЕНИЕ РЕАКЦИИ ЭТИЛЕНА С ПЕРМАНГАНАТОМ КАЛИЯ:
г) реакция с реактивом Толленса Проведение опыта Предварительно готовят реактив Толленса. Для этого в пробирке смешивают нитрат серебра и раствор аммиака до исчезновения осадка оксида серебра, объем реактиваТолленса 4 мл. О пыт проводят аналогично, используя вместо бромной воды реактив Толленса. Результаты опыта: УРАВНЕНИЕ РЕАКЦИИ ПОЛУЧЕНИЯ РЕАКТИВА ТОЛЛЕНСА
УРАВНЕНИЕ РЕАКЦИИ ПОЛУЧЕНИЕ АЦЕТИЛЕНИДА СЕРЕБРА:
Вывод:
……………………………………………………………………………………………. …………………………………………………………………………………………….
……………………………………………………………………………………………….. Лабораторная работа № 3 Вывод ……………………………………………………………………………………… ……………………………………………………………………………………… ОПЫТ 2. РЕАКЦИЯ С РЕАКТИВОМ ФЕЛИНГА Реактивы и материалы: 1.глюкоза (C6H12О6) 5% 2.ацетон ((СН3)2С = О) 3. реактив Фелинга 4. пробирка объемом 15-20 мл 5. держатель для пробирки 6. спиртовка Проведение опыта: В две пробирки наливают по 2 мл реактива Фелинга. В одну добавляют несколько капель глюкозы, в другую ацетона. Смесь (осторожно!) нагревают. Результаты опыта:
УРАВНЕНИЕ РЕАКЦИИ АЛЬДЕГИДА С РЕАКТИВОМ ФЕЛИНГА:
Вывод ……………………………………………………………………………………………………………………………………………………………………….
ОПЫТ 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЗАДАЧА С ПИЩЕВЫМИ ПРОДУКТАМИ
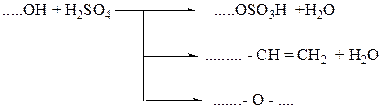
(по усмотрению преподавателя) Проведение опыта: Студент получает задание определить оксо-группу в одном из продуктов ……………………………………………………………………………………………….. Карбоновые кислоты Лабораторная работа № 4 ЭТЕРИФИКАЦИЯ Цель работы – изучение свойств карбоновых кислот и спиртов, проведение реакции этерификации, с последующим анализом сложных эфиров. Реактивы: 1. Уксусная кислота (СН3СООН); 2. бутиловый спирт (С4Н9ОН), изобутиловый спирт ((СН3)2СН-СН2ОН), изоамиловый спирт ((СН3)2СН - СН2 – СН2 – ОН); 3. серная кислота (Н2SO4); 4. гидрокарбонат натрия NaHCO3 (5 %); 5. сульфат натрия безводный (Na2SO4). Химическая посуда и материалы:
1 – круглодонная колба; 2 – ловушка Дина-Старка; 3 – Холодильник Либиха; 4 – делительная воронка; 5 – химический стакан емкостью 150 – 200мл; 6 – коническая колба; электроплитка; стеклянная палочка; шпатель; рефрактометр, пипетка, «кипелки». Выполнение работы: 1. Записывают основное уравнение реакции для своего спирта:
2. Записывают уравнения побочных реакций для своего спирта:
(2)
3. Заполняют таблицу 1 в соответствии с вариантом, выданным преподавателем. Справочные материалы, варианты, пример расчета приведены в табл. 1 и 2 (приложение 1). Приложение 1 следует скачать с сайта кафедры.
Таблица 1 Расчетные данные для проведения синтеза
4. Собирают установку для синтеза сложного эфира (рис. 1), согласно схеме: 1 – электронагреватель; 2 – колба круглодонная; 3 – ловушка Дина - Старка; 4 – холодильник Либиха; 5 – «кипелки». 5. Проводят синтез, получая сложный эфир: 5.1. В колбу заливают расчетное количество спирта, уксусной кислоты и 2 мл серной кислоты. Осторожно перемешивают, вносят «кипелки». 5.2. Затем собирают и запускают установку. Контроль за реакцией, осуществляют по объему выделившейся воды в ловушке. Количество воды в ловушке должно быть приблизительно равным «расчетному». Обычно синтез заканчивают при прекращении поступления воды в ловушку насадки Дина – Старка.
Рис.1. Установка для синтеза эфира Рис. 2. Делительная воронка с Ткип. Выше 100˚С
По окончании синтеза замеряют воду в ловушке насадки, содержимое ловушки и реакционной колбы переносят в делительную воронку (рис. 2). Далее, добавляют 30-40 мл воды, встряхивают, дают расслоиться, нижний слой, содержащий уксусную и серную кислоты, удаляют. Затем, промывают 30-50 мл раствора углекислого натрия (Na2CO3) и 30-50 мл воды. При промывке смесь в делительной воронке энергично встряхивают для лучшего перемешивания эфира и промывочного раствора, дают расслоиться и нижний промывочный слой удаляют. Эфир переносят в коническую колбу, выливая через (верхнюю!!!) часть делительной воронки. 5.3 Полученный эфир сушат безводным кристаллическим сернокислым натрием (Na2SO4), для чего в колбу вносят небольшими порциями соль и встряхивают. После просветления эфира, замеряют объем полученного эфира и определяют показатель преломления на рефрактометре. 5.4. Рассчитывают по формуле выход эфира в % от расчетного (Х):
V2 -объем полученного эфира, мл, V1 – расчетное к-во эфира. 5.5. Данные заносят в таблицу 2.
Таблица 2. Результаты проведения синтеза
Выводы: ……………………………………………………………………………… ……………………………………………………………………………… …………………………………………………………………………….. ……………………………………………………………………………. Лабораторная работа № 5 Окси- аминокислоты Цель работы – познакомиться с химическими свойствами алифатических и ароматических окси- и аминокислот.
КИСЛОТЫ (АСПИРИНА) Реактивы и материалы: ацетилсалициловая кислота; хлорид железа (III) (FeCl3) 1 %; держатель для пробирки; спиртовка. Проведение опыта: В каждую из 2 пробирок вносят несколько кристаллов ацетилсалициловой кислоты (аспирина) и добавляют по 1,5-2,0 мл воды. Пробирки хорошо встряхивают. В пробирку № 1 вносят одну каплю раствора хлорида железа (III). Пробирку № 2 нагревают и кипятят в течение минуты, затем, добавляют раствор хлорид железа (III). Результаты опыта: (укажите цвет раствора):
УРАВНЕНИЕ РЕАКЦИИ ГИДРОЛИЗА АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ: Вывод: ………………………………………………………………………………………
К ИНДИКАТОРАМ Реактивы и материалы: раствор аминоуксусной кислоты (глицина) 2%; метиловый оранжевый;фенолфталеин. Проведение опыта: В каждую из 2 пробирок вносят по 2 мл аминоуксусной кислоты. В пробирку № 1 добавляют2 капли метилового оранжевого; В пробирку № 2 добавляют2 капли фенолфталеина. Результаты опыта: НАБЛЮДЕНИЯ: В пробирке №1 ………………………………………………………..
В пробирке № 2 ……………………………………………………….. Вывод: ……………………………………………………………………………………………… ……………………………………………………………………………………………..
ОПЫТ 8. РЕАКЦИЯ АМИНОКИСЛОТ С АЗОТИСТОЙ КИСЛОТОЙ Реактивы и материалы: раствор аминоуксусной кислоты (глицина) 2%; раствор соли глутаминовой кислоты 2%; раствор дипептида глицилглицина, 5% нитрит натрия (NaNO2) 10%; соляная кислота (НСl) 10 %; Проведение опыта: В пробирку внести 1 мл раствора аминоуксусной кислоты, 1,5 мл раствора нитрита натрия и 1,5 мл соляной кислоты. Осторожно встряхнуть! Проделайте этот опыт с солью глутаминовой кислоты и глицилглицином. Напишите реакции. Результаты опыта: НАБЛЮДЕНИЯ:
УРАВНЕНИЕ РЕАКЦИИ АМИНОУКСУСНОЙ КИСЛОТЫ (ГЛИЦИНА) С АЗОТИСТОЙ КИСЛОТОЙ:
УРАВНЕНИЕ РЕАКЦИИ ГЛИЦИЛГЛИЦИНА С АЗОТИСТОЙ КИСЛОТОЙ:
Вывод: ………………………………………………………………………………….. ……………………………………………………………………………………… ОПЫТ 3. ОКИСЛЕНИЕ УГЛЕВОДОВ РЕАКТИВОМ ФЕЛИНГА Реактивы и материалы: 1. мальтоза (С12Н22О11) раствор 5%; 2. глюкоза (С6Н12O6) раствор 5%; 3. сахароза (С12Н22О11) раствор 5% 4. фруктоза (С6Н12О6) раствор 5 %; 5. реактив Фелинга. Проведение опыта: В 4 пробирки помещают: 1,5-2 мл раствора глюкозы, 1,5-2 мл раствора фруктозы, 1,5-2 мл раствора мальтозы, 1,5-2 мл раствора сахарозы, затем в каждую из пробирок наливают 1,5-2 мл реактива Фелинга. Пробирки осторожно нагревают (верхнюю часть) растворов на спиртовке или помещают их на водяную баню. Результаты опыта:
УРАВНЕНИЕ РЕАКЦИИ ГЛЮКОЗЫ С РЕАКТИВОМ ФЕЛИНГА:
УРАВНЕНИЕ РЕАКЦИИ МАЛЬТОЗЫ С РЕАКТИВОМ ФЕЛИНГА:
Выводы:
……………………………………………………………………………………………………………… Лабораторная работа № 7 ЖИРЫ, МАСЛА (ЛИПИДЫ) Цель работы – познакомиться с физическими и химическими свойствами жиров и масел. ОПЫТ 2. ОМЫЛЕНИЕ ЖИРОВ Реактивы и материалы: твердый жир; конц. раствор едкого натра; насыщ. раствор поваренной соли; фарфоровая чашка; шпатель; стеклянная палочка; плитка. Проведение опыта: В фарфоровую чашку шпателем помещают кусочек жира и 6-7 мл концентрированного раствора NaOH. Смесь нагревают на плитке около 15 минут при перемешивании. По мере выкипания раствора в чашку подливают дистиллированную воду. Для проверки полноты омыления в пробирку отбирают небольшое количество омыляемой массы и добавляют 4-5 мл горячей воды, пробирку встряхивают: если проба растворилась и появилась мыльная пена- процесс окончен. Чашку снимают с плитки, добавляют 10 мл горячего насыщенного раствора поваренной соли и смесь охлаждают. Результаты опыта: НАБЛЮДЕНИЯ: ………………………………………………………………………………………………. НАПИШИТЕ РЕАКЦИЮ ОМЫЛЕНИЯ ДЛЯ ПАЛЬМИТОДИСТЕАРАТА ГЛИЦЕРИНА:
Выводы: ………………………………………………………………………………………………………
………………………………………………………………………………………………………………….
ОПЫТ 3. ОКИСЛЕНИЕ ЛИПИДОВ ПЕРМАНГАНАТОМ КАЛИЯ Реактивы и материалы: раствор перманганата калия (КMnO4) 5%; раствор соды (Na2CO3) 10 %; растительные масла, жиры, косметические средства; пипетки; шпатели или стеклянные палочки. Проведение опыта: В каждую пробирку наливают по 0,5 мл масла или помещают аналогичное количество косметического средства, добавляют 1 мл раствора соды и в каждую пробирку по каплям добавляют раствор перманганата калия, до тех пор, пока окраска раствора перманганата не будет меняться. После каждой капли пробирки встряхивают. Отмечают, сколько капель перманганата ушло на каждый образец. Результаты опыта: НАБЛЮДЕНИЯ: Пробирка № 1 ………………………………………………………………
Пробирка № 2 ……………………………………………………………… Закончите реакцию: Вывод: …………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………. Реактивы и материалы: растительное масло; хлороформ; КОН (0.3%); фенолфталеин; пипетка. Проведение опыта: В пробирку наливают 0.5 мл масла, 0.5 мл хлороформа, 1 каплю фенолфталеина, а затем из пипетки добавляют по каплям разбавленный раствор КОН до появления розового окрашивания, не исчезающего при встряхивании. Результаты опыта: НАБЛЮДЕНИЯ: …………………………………………………………………………………………… УРАВНЕНИЕ РЕАКЦИИ:
………………………………………………………………………………………………………... Вывод:
……………………………………………………………………………………………………….. ОПЫТ 6. СВОЙСТВА МЫЛА а) ГИДРОЛИЗ МЫЛА Реактивы и материалы: мыльная стружка; этиловый спирт; фенолфталеин. Проведение опыта: 1. Приготовить спиртовой раствор мыла в пробирке № 1: немного мыльной стружки, заливают 3 мл этилового спирта. Смесь хорошо перемешивают. Добавляют 2 капли фенолфталеина. 2. В пробирку № 2 наливают 5 мл дистиллированной воды и (по стенке) приливают 1 мл спиртового раствора мыла с фенолфталеином из пробирки №1. Результаты опыта: НАБЛЮДЕНИЯ:
……………………………………………………………………………………………………………….. ………………………………………………………………………………………………………………. УРАВНЕНИЕ РЕАКЦИИ ГИДРОЛИЗА МЫЛА:
Вывод: ………………………………………………………………………………….………………………………
б) ОБРАЗОВАНИЕ НЕРАСТВОРИМЫХ СОЛЕЙ ВЫСШИХ ЖИРНЫХ КИСЛОТ Реактивы и материалы: мыльная стружка; раствор хлорида кальция (5 %); раствор ацетата свинца Проведение опыта: 1. Приготовить водный раствор мыла в пробирке № 1: немного мыльной стружки, заливают 9 мл дистиллированной воды. Смесь хорошо перемешивают. Раствор равномерно распределить по 3 пробиркам. 2. В пробирку № 2 добавить 1 мл раствора хлорида кальция; В пробирку № 3 добавить 1 мл раствора ацетата свинца; В пробирку № 4 добавить 1 мл раствора сульфата меди. Результаты опыта: НАБЛЮДЕНИЯ:
Пробирка № 2………………………………………………………………..
Пробирка № 3……………………………………………………………… Пробирка № 4 ……………………………………………………………….
УРАВНЕНИЕ ОБРАЗОВАНИЯ КАЛЬЦИЕВОЙ СОЛИ:
УРАВНЕНИЕ ОБРАЗОВАНИЯ СОЛИ СВИНЦА:
УРАВНЕНИЕ ОБРАЗОВАНИЯ СОЛИ МЕДИ:
Вывод: ………………………………………………………………………………………………………………..
………………………………………………………………………………………………………………
………………………………………………………………………………………………………………
[1] Проба с пищевым продуктом (по согласованию с преподавателем). [2] Проба с пищевым продуктом (по согласованию с преподавателем. ФГБОУ ВПО «Кемеровский технологический Институт Пищевой промышленности Кафедра органической химии Лабораторные работы по органической химии Учетный лист студента гр.__________ ___________________________________
КЕМЕРОВО 2015
Лабораторная работа № 1
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 91; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.184.90 (0.353 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
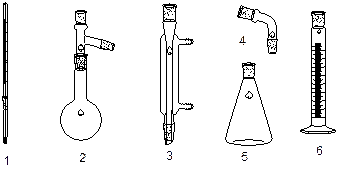

 , %
, %