Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Белки. Строение и структура молекулы белка.
Белки – это природные биополимеры, состоящие из цепочки мономеров – аминокислот, которые соединяются друг с другом пептидными связями. Белковые молекулы устроены определённым образом, каждая молекула имеет уникальную структуру, позволяющую молекуле выполнять определённые функции в клетке. Первичная структура характеризуется порядком (последовательностью) чередования аминокислот в полипептидной цепи. Даже одинаковые по длине и аминокислотному составу пептиды могут быть разными веществами потому, что последовательность аминокислот в цепи у них разная. Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка.
Классификация белков. Белки разделяют на простые и сложные. Простые белки состоят только из аминокислот, а сложные белки содержат небелковую часть. В зависимости от химической природы небелковой части сложные белки подразделяют на следующие группы: Фосфопротеины, Металлопротеины, Гликопротеины, Хромопротеины, Липопротеины, Нуклеопротеины
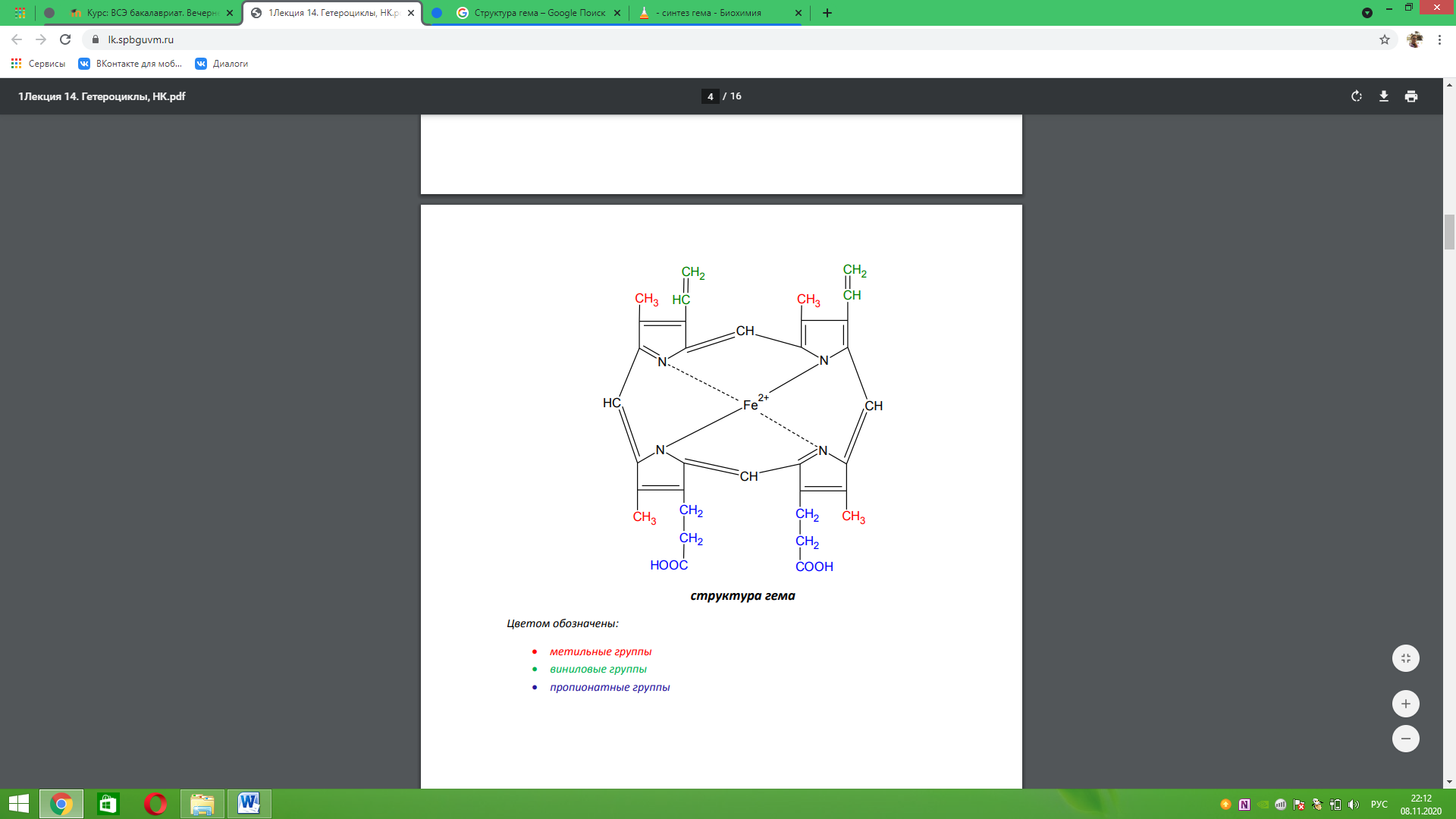
Структура гема. Циклы, в состав которой входят четыре пиррольных цикла, объединены метиновыми мостиками в один большой цикл, который в совокупности с боковыми группировками и ионом железа является гемом. Боковые группы при пиррольных циклах представлены четырьмя метильными, двумя виниловыми группами и двумя протионатными группами.
60.Пространственная изомерия, примеры. Пространственная изомерия (стереоизомерия) — вид изомерии, при котором молекулы веществ, обладающие одинаковым составом и одинаковым химическим строением, отличаются различным расположением заместителей в пространстве.
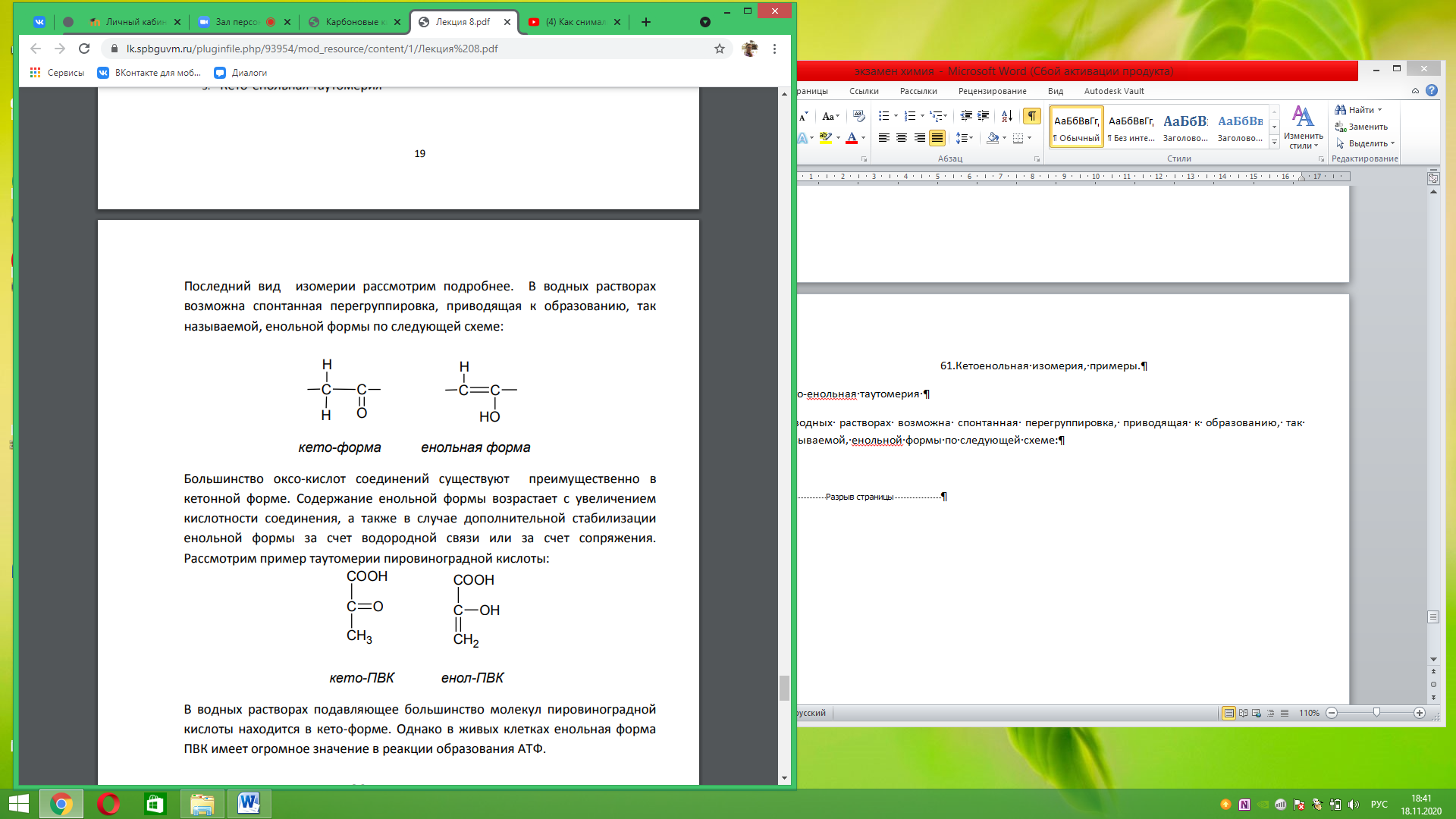
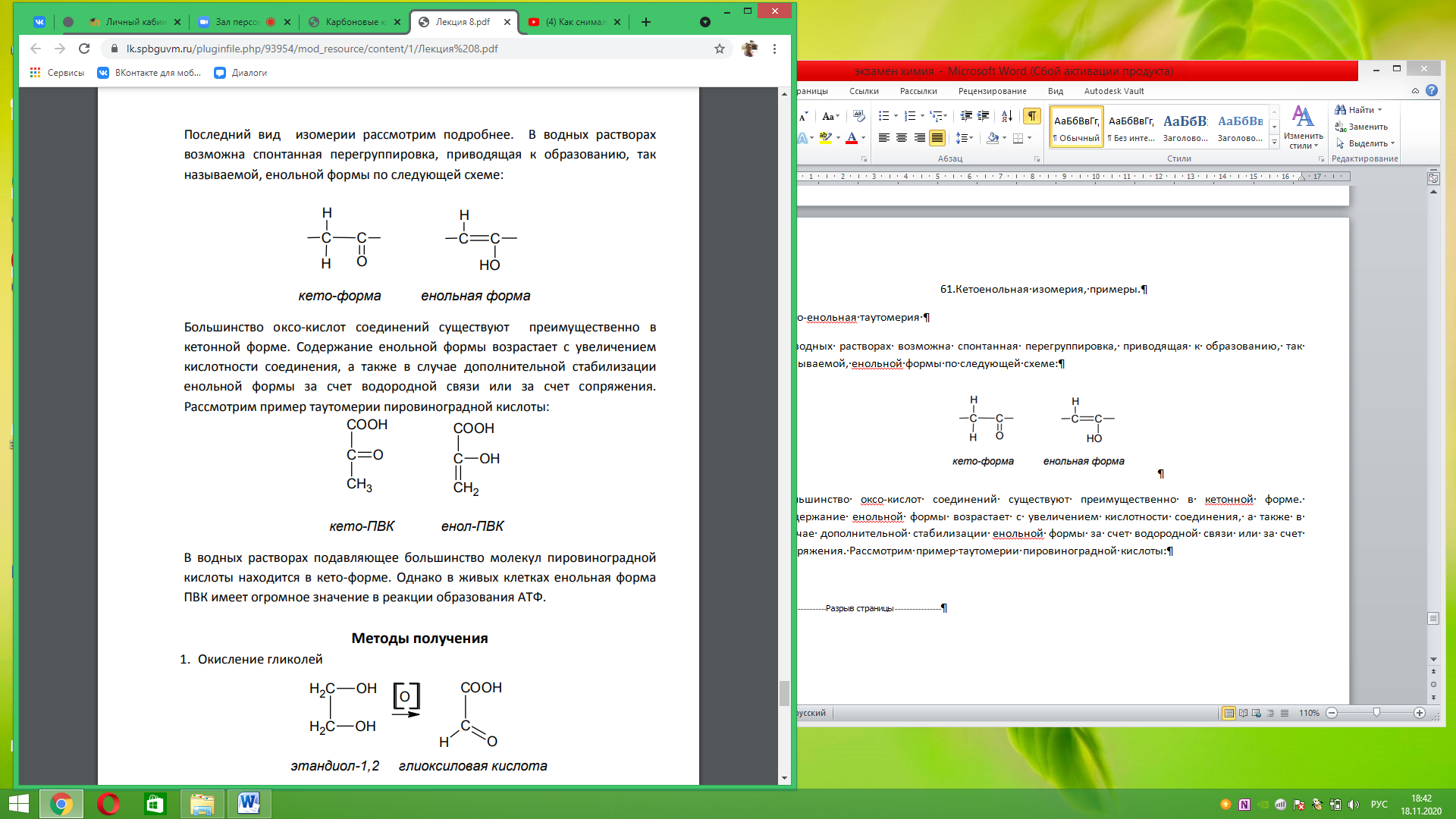
61.Кетоенольная изомерия, примеры. Кето-енольная таутомерия В водных растворах возможна спонтанная перегруппировка, приводящая к образованию, так называемой, енольной формы по следующей схеме:
Большинство оксо-кислот соединений существуют преимущественно в кетонной форме. Содержание енольной формы возрастает с увеличением кислотности соединения, а также в случае дополнительной стабилизации енольной формы за счет водородной связи или за счет сопряжения. Рассмотрим пример таутомерии пировиноградной кислоты:
В водных растворах подавляющее большинство молекул пировиноградной кислоты находится в кето-форме. Однако в живых клетках енольная форма ПВК имеет огромное значение в реакции образования АТФ.
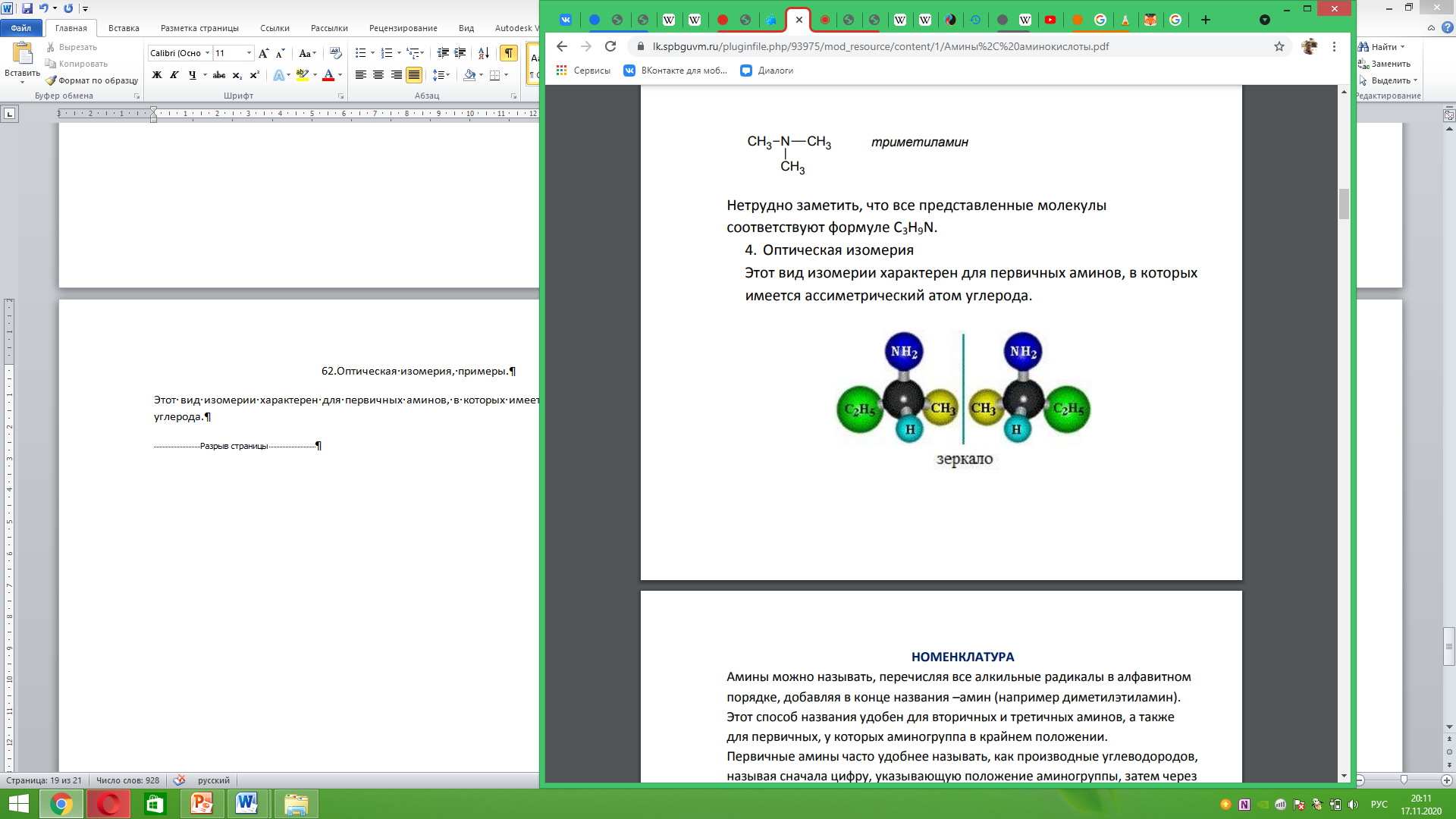
62.Оптическая изомерия, примеры. Этот вид изомерии характерен для первичных аминов, в которых имеется ассиметрический атом углерода.
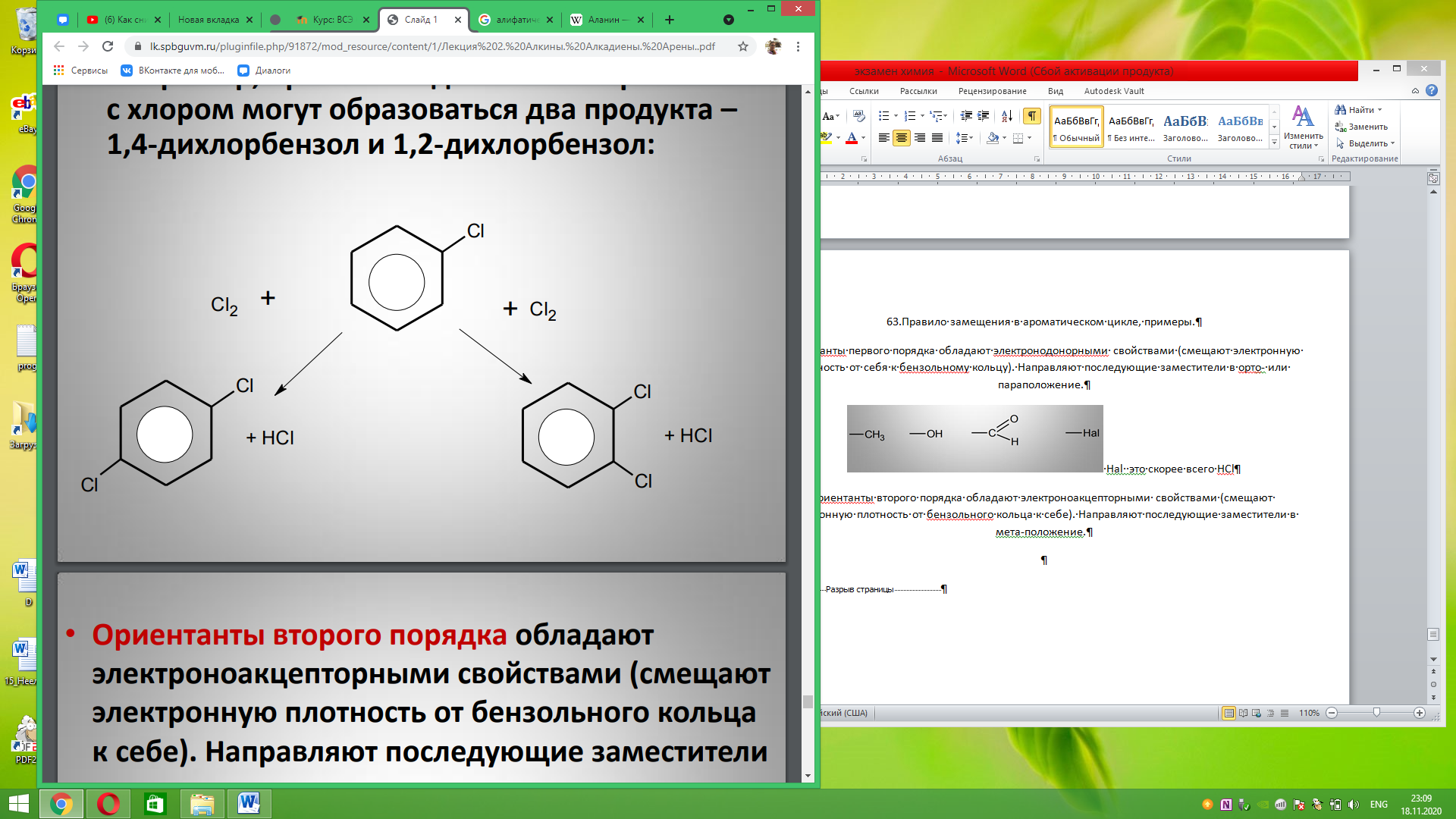
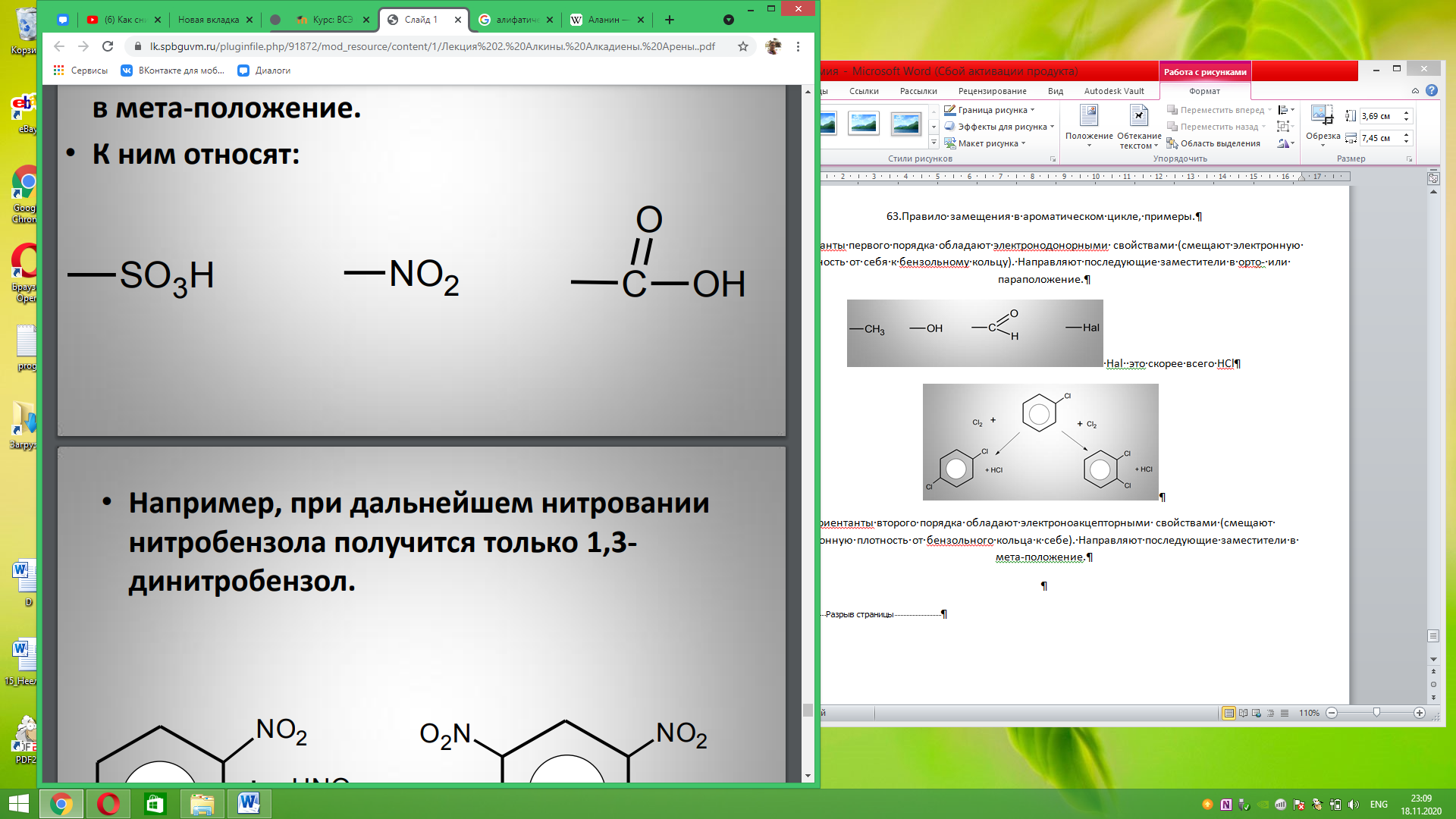
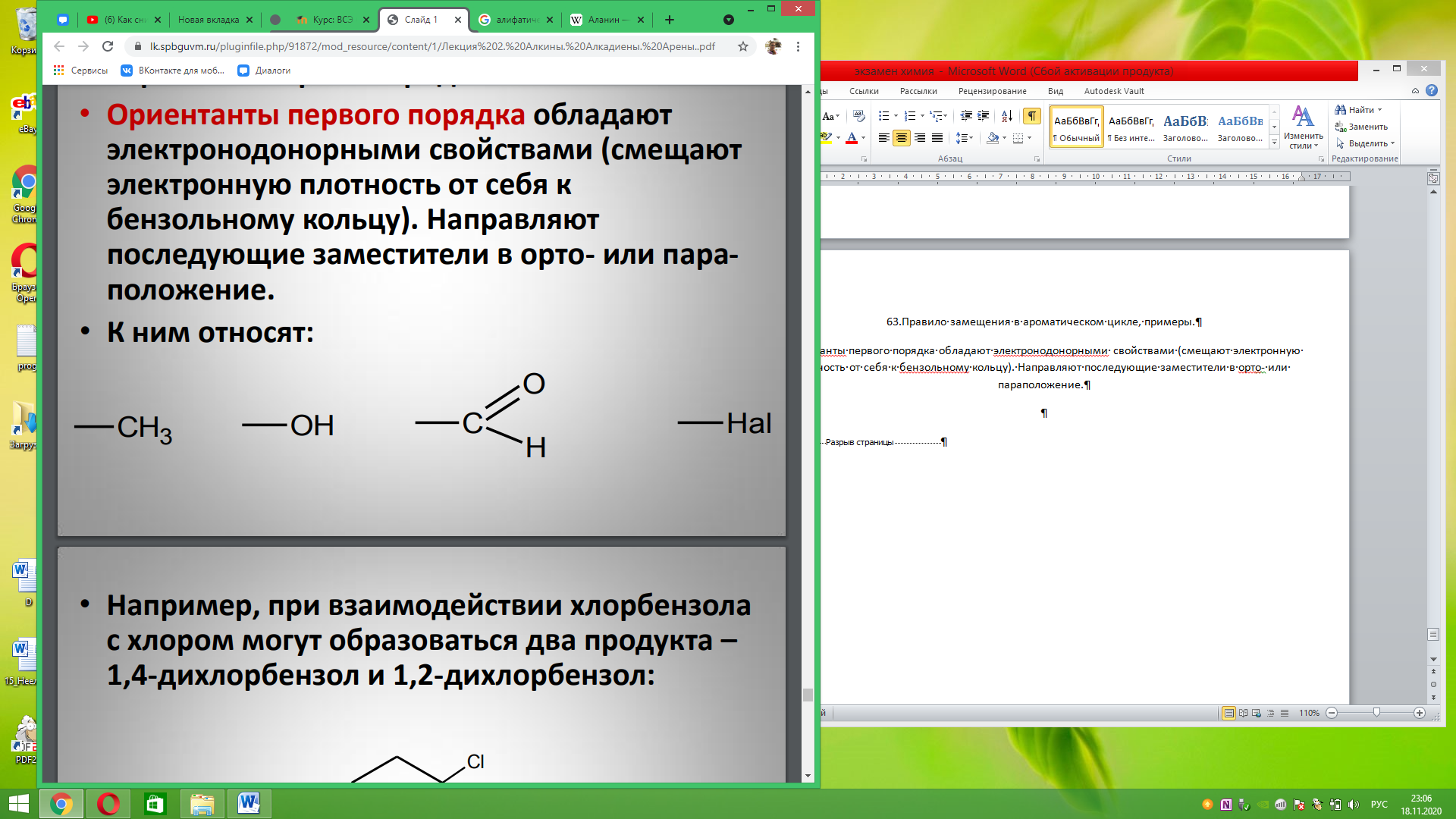
63.Правило замещения в ароматическом цикле, примеры. Ориентанты первого порядка обладают электронодонорными свойствами (смещают электронную плотность от себя к бензольному кольцу). Направляют последующие заместители в орто- или параположение.
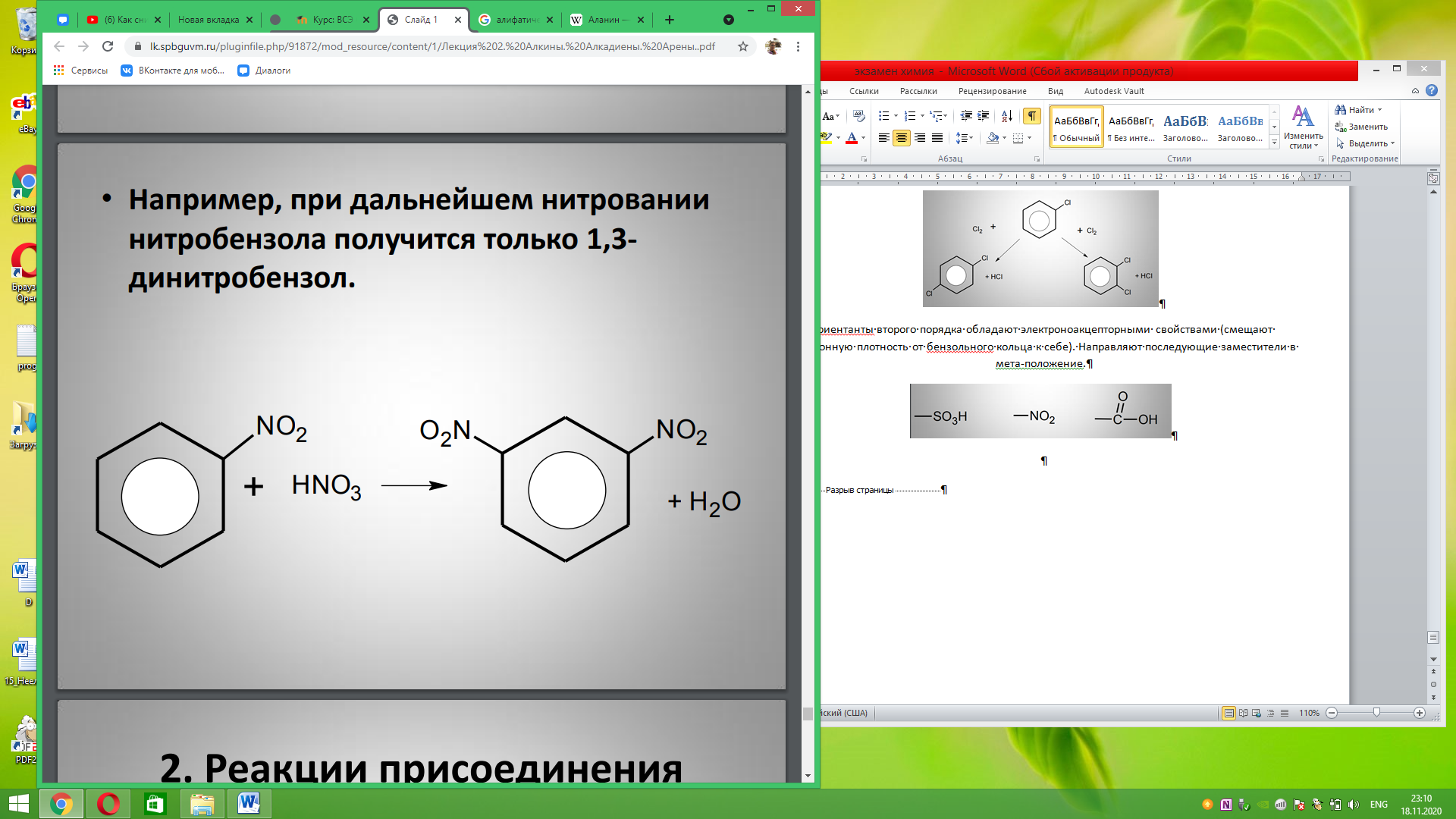
Ориентанты второго порядка обладают электроноакцепторными свойствами (смещают электронную плотность от бензольного кольца к себе). Направляют последующие заместители в мета-положение.
|
||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 106; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.77.195 (0.01 с.) |
 Hal это скорее всего HCl
Hal это скорее всего HCl