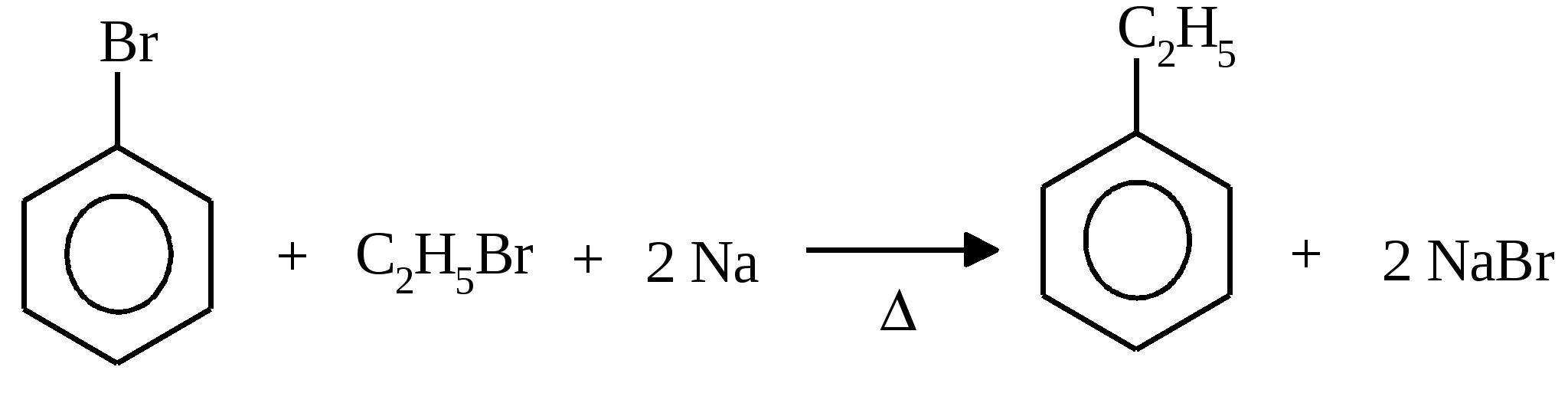Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алкадиены. Изомерия, сравнительная характеристика свойств.
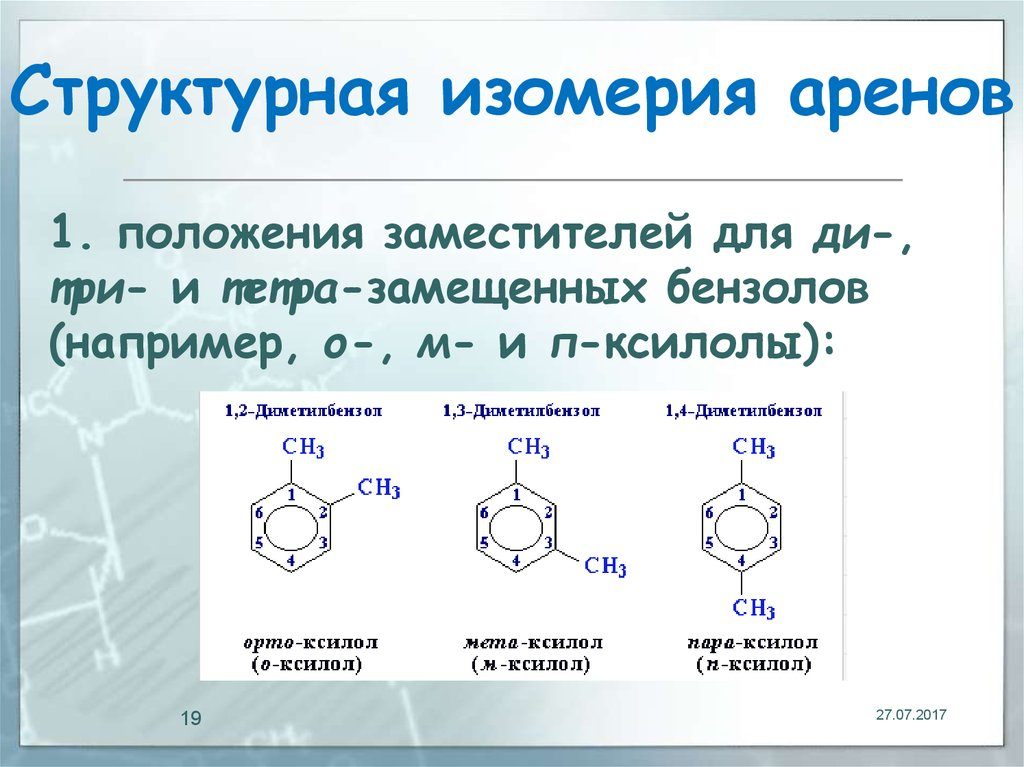
Алкадиены – это углеводороды, имеющие в своём составе две двойные связи. Общая формула для всех диеновых углеводородов такая же, как у алкинов: CnH2n-2 Для алкадиенов характерны следующие виды изомерии: • Изомерия углеродного скелета; • Изомерия положения двойных связей; • Геометрическая изомерия; • Межклассовая изомерия (с алкинами и циклоалкенами). Сравнительная характеристика свойств. ЧТО ОТ НАС ХОТЯТ? НЕПОНЯТНО Бывают аклкадиены С кумулированными связями. У таких алкадиенов двойные связи занимают соседнее расположение: H2C =C =CH2 Пропадиен-1,2 (аллен) Такие алкадиены крайне неустойчивы и быстро перестраиваются в изомерные им алкины. С изолированными связями. В этом случае между двойными связями расположено две или более одинарных. H2C =CH -CH2 -CH= CH- CH3 Гексадиен-1,4 Алкадиены с изолированными двойными связями ведут себя, как обычные алкены. С сопряжёнными связями. Сопряжённые двойные связи располагаются через одну одинарную. H2C =CH -CH= CH -CH3 Пентадиен-1,3 Алкадиены с сопряж двойными связями вступают в реакции присоединения 2 типов: 1) В положении 1,2 CH2=CH-CH=CH2+H2 –> CH3 - CH2 -CH=CH2 2) В положении 1,4 CH2=CH-CH=CH2+H2-> CH 3-CH=CH- CH3 Алкадиены с сопряженной системой хорошо полимеризуются 10.Изопреновые производные. Основные представители, их значение. Вроде тоже самое что и 11 11.Терпены. Основные представители, их значение. Арены. Изомерия. Арены – это ароматические углеводороды, в которых циклическая структура образована системой сопряжённых двойных связей.
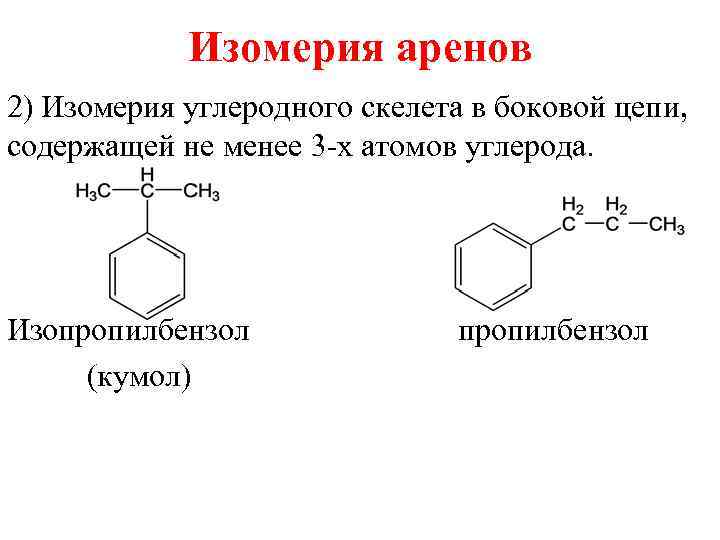
3.Количество боковых радикалов (пробилбензол и 1-метил-2-этилбензол)
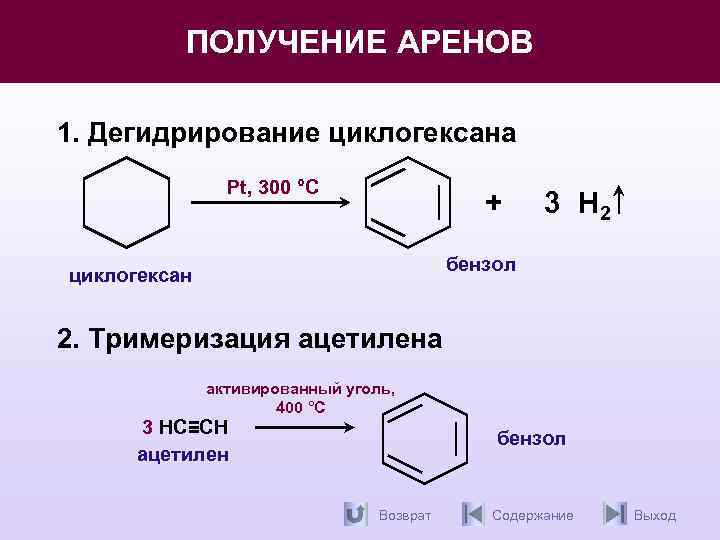
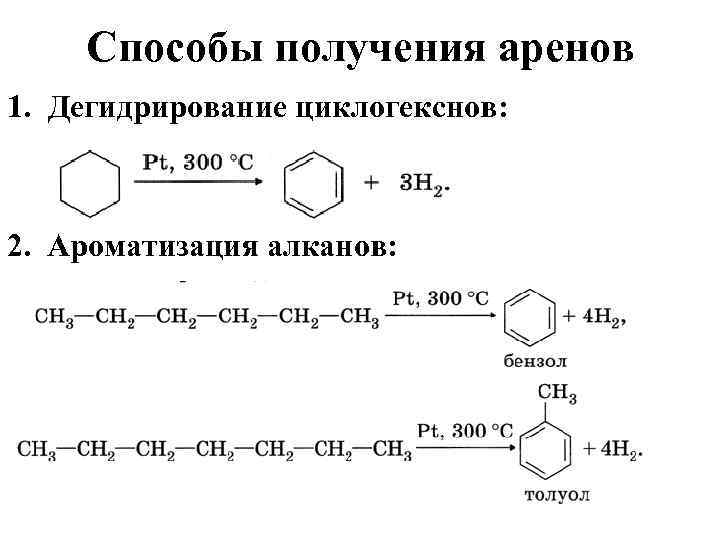
Арены. Методы получения.
Получение гомологов бензола Реакция Вюрца-Фиттинга
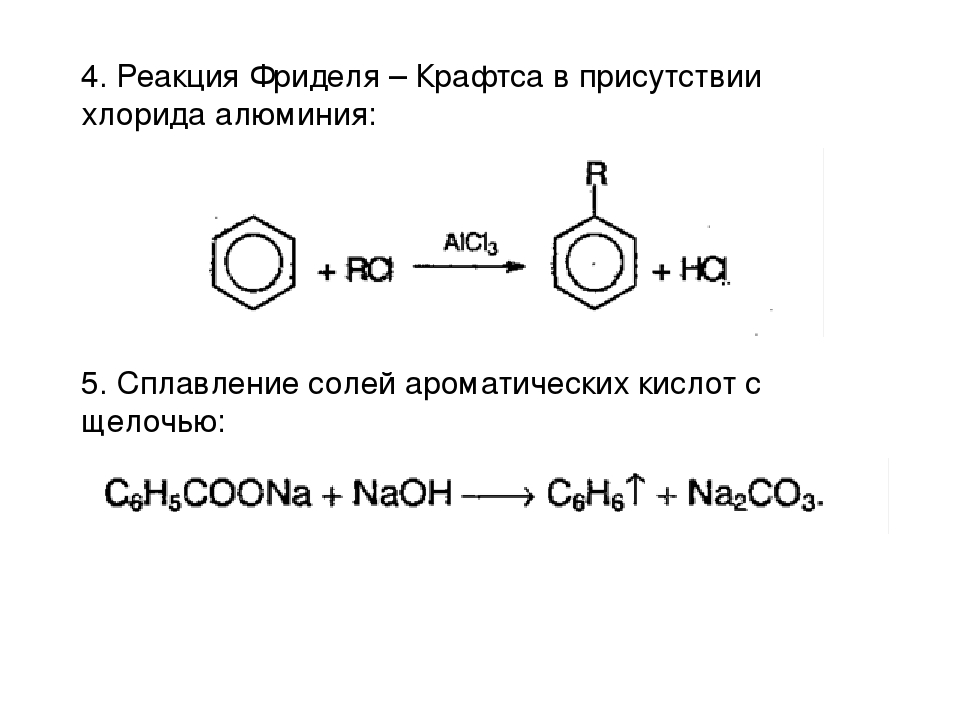
Реакция Фриделя-Крафтца
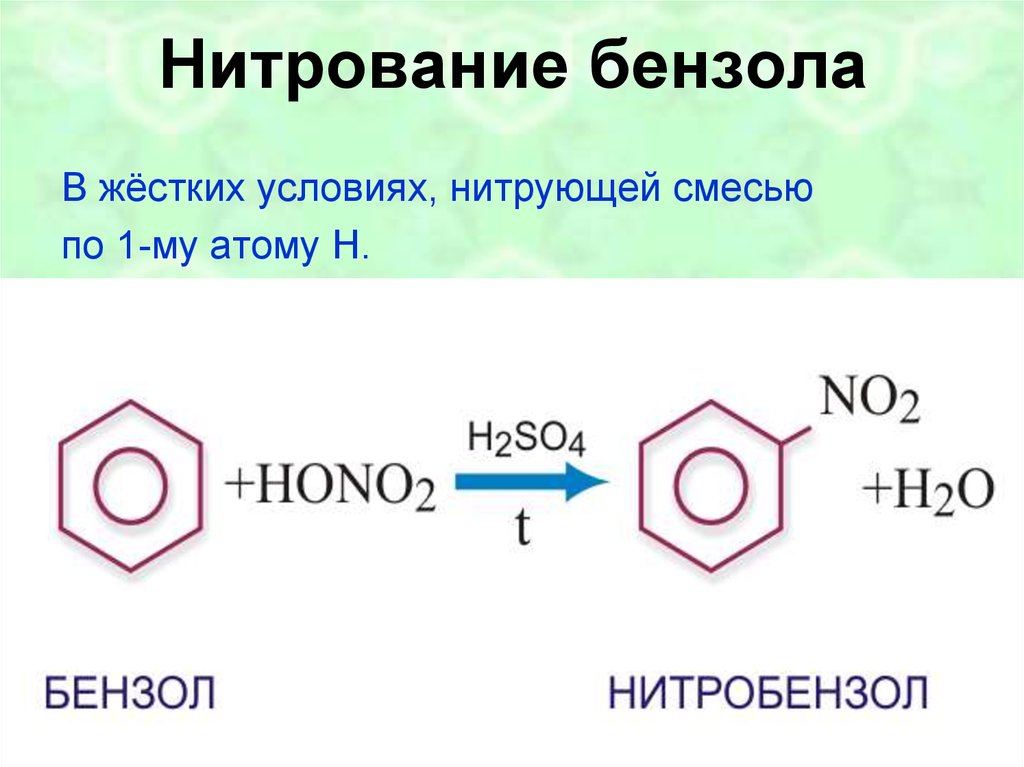
14.Арены. Химические свойства. Бензол в ХР проявляет инертность. По бензольному кольцу легче идут реакции замещения, чем присоединения
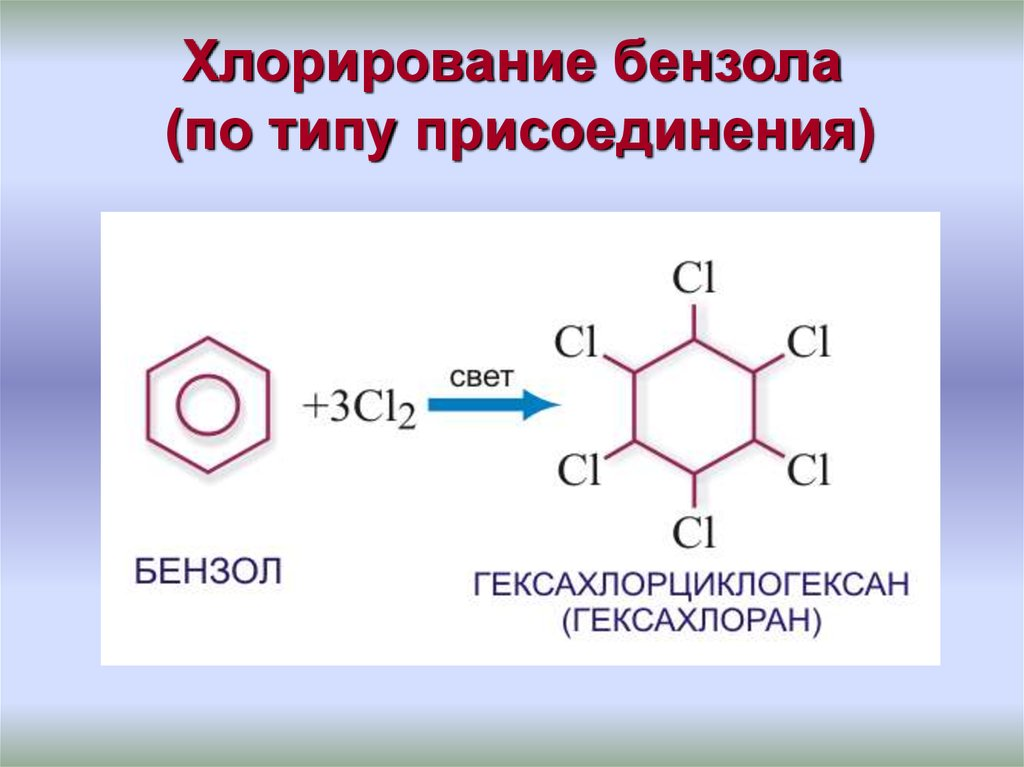
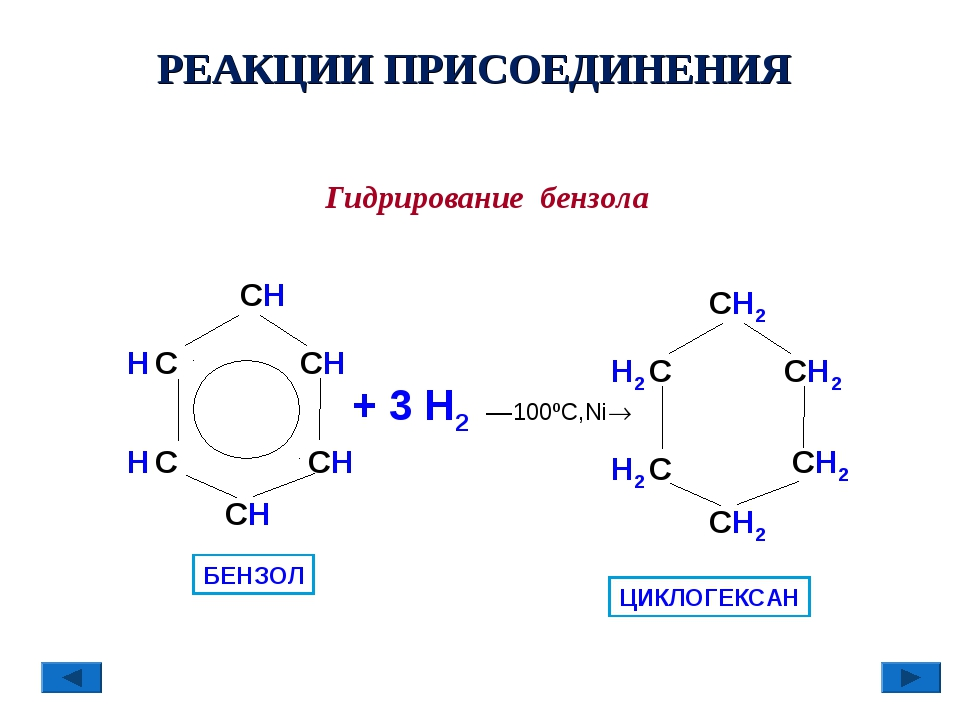
Реакции присоединения. Эти реакции не характерны для бензола, поэтому идут с большим трудом. Однако в жёстких условиях (высокая температура, облучение или присутствие катализатора) бензол проявляет слабовыраженный непредельный характер и может присоединять водород или хлор. Воду и галогеноводороды бензол не присоединяет.
Реакции присоединения Сама по себе молекула бензола весьма устойчива к действию окислителя. Обычные окислители не дйствуют на бензол, а под влиянием сильных окислителей (например, оксида ванадия (V) происходит разрыв кольца с образованием малеиновой кислоты.
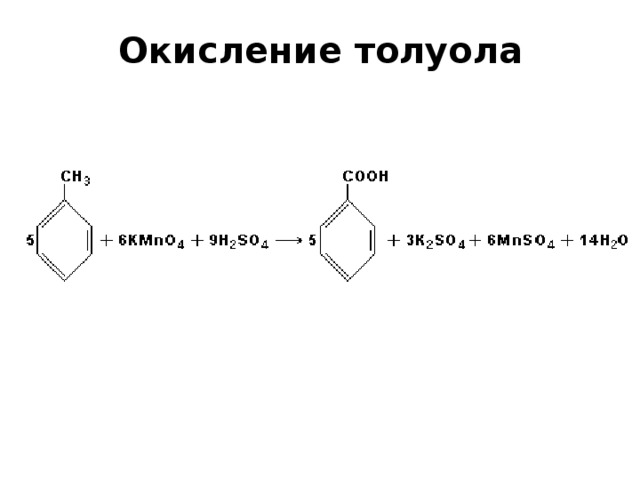
Гомологи бензола окисляются легко. При этом окисляется не кольцо, а боковая цепь. Вместо неё образуется карбоксильная группа.
|
|||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 383; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.80.45 (0.006 с.) |