
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ТЕМА 7: Химическая кинетика и равновесие
Кинетика — учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакций является неравенство ΔGР,Т < 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, ∆G
Н2(г) + ½О2(г) = Н2О(г)
2Аl (кр) + 3I2 (кр) = 2АlI3(кр)
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платины для первой и воды для второй). Катализатор как бы снимает кинетический "тормоз", и тогда проявляется термодинамическая природа вещества. Скорость химических реакций зависит от многих факторов, основные из которых — концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе. Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
2SO2(г) + O2(г) = 2SO3(г),
если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Решение. Обозначим концентрации реагирующих веществ: [SO2] = а; [O2] = b; [SO3] = с. Согласно закону действия масс скорости V прямой и обратной реакции до изменения объема
Vпр = k·а2·b; Vобр = k1·с2;
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а; [O2] = 3b; [SO3] = 3с. При новых концентрациях скорости V прямой и обратной реакции изменились
V`пр = k·(3а)2·3b = 27∙k·а2·b; V`обр = k1·(3с)2 = 9∙К1·с2;
Отсюда
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной — только в девять раз. Равновесие системы сместилось в сторону образования SO3. Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70° С, если температурный коэффициент реакции равен 2. Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант‒Гоффа по формуле:
Где: Δt = t2 – t1 = 70 – 30 = 40 оС, Vt(1) – скорость реакции при температуре t1; Vt(2) ‒ скорость реакции при температуре t2; γ – температурный коэффициент, который показывает, как изменится скорость реакции при изменении температуры на 10 оС.
Следовательно, скорость реакции Vt(2) при температуре 70º С больше скорости реакции Vt(1) при температуре 30° С в 16 раз. Пример 3. Константа равновесия гомогенной системы СО (г) + Н2О(г) = СО2 (г) + Н2(г) при 850 С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Vпр = k1·[СО] [Н2О]; Vобр = k2·[СО2] [Н2];
В условии задачи даны исходные концентрации, тогда как в выражение КР входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]р = Х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также Х моль/л. По столько же молей (Х моль/л), СО и Н2О расходуется для образования по Х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ равны [СО2]р = [Н2]р = Х моль/л; [СО]р = (3 – Х) моль/л; [Н2О]р = (2 – Х) моль/л; Зная константу равновесия, находим значение Х, а затем исходные концентрации всех веществ:
Таким образом, искомые равновесные концентрации равны: [СО2]р = 1,2 моль/л; [Н2]р = 1,2 моль/л; [СО]р = (3 – 1,2) = 1,8 моль/л; [Н2О]р = (2 – 1,2) = 0,8 моль/л;
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
РСl5(г) = РСl3(г) + Сl2(г) ∆Н = + 92,59 кДж
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения PCl5? Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье:
а) так как реакция разложения РСl5 эндотермическая (∆Н >0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации‒РСl3 или Cl2.
Контрольные задания согласно варианта из приложения А (таблица А.1) 121. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2 равна 5·10‒4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и скорость, когда разложится 50% N2O. Ответ: 1,8·10‒2; 4,5·10‒3. 122. Напишите выражение для константы равновесия гетерогенной системы СО2 (г) + С (кр) ↔ 2СО (г). Как изменится скорость прямой реакции — образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО? 123. Напишите выражение для константы равновесия гетерогенной системы С (кр) + Н2О (г) ↔ СО (г) + Н2 (г). Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции — образования водяных паров? 124. Равновесие гомогенной системы 4НСl(г) + О2(г) ↔ 2Н2О(г) + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ: [Н2О]р = 0,14 моль/л; [Cl2]р = 0,14 моль/л; [HCI]p = 0,20 моль/л; [О2]р = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [HCI]иcx = 0,48 моль/л; [О2]исх =0,39 моль/л. 125. Вычислите константу равновесия для гомогенной системы CO(г) + H2O(г) ↔ CO2(г) + H2(г) если равновесные концентрации реагирующих веществ: [СО]р = 0,004 моль/л; [Н2О]р = 0,064 моль/л; [CО2]р = 0,016 моль/л; [Н2]р = 0,016 моль/л. Чему равны исходные концентрации воды и СО? Oтвет: К =1; [Н2О]исх = 0.08моль/л; [СО]исх = 0,02 моль/л. 126. Константа равновесия гомогенной системы CO(г) + H2O(г) ↔ CO2(г) + H2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО]исх = 0,10 моль/л; [Н2О]исх = 0,40 моль/л. Ответ: [CО2]р = [Н2]р = 0,08 моль/л; [СО]р = 0,02 моль/л; [Н2О]р = 0,32 моль/л. 127. Константа равновесия гомогенной системы N2 + 3H2 ↔ 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: [N2 ]р = 8 моль/л; [N2 ]исх = 8,04 моль/л. 128. При некоторой температуре равновесие гомогенной системы 2NО+ О2 ↔ 2NО2 установилось при следующих концентрациях реагирующих веществ: [NO]р = 0,2 моль/л; [О2]р = 0,1 моль/л; [NО2]р = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NО и О2. Ответ: К = 2,5; [NO]исх = 0,3 моль/л; [О2]исх = 0,15 моль/л. 129. Почему при изменении давления смещается равновесие системы N2 + 3H2 ↔ 2NH3 и не смешается равновесие системы N2 + О2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем. 130. Исходные концентрации [NO]исх и [С12]исх в гомогенной системе
2NO + Cl2 = 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416. 131. Окисление серы и ее оксида (IV) протекает по уравнениям: а) S(кр)+ О2 (г) = SО2(г); б) 2SО2(г)+ О2 (г) = 2SО3(г). Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза? 132. Напишите выражение для константы равновесия гомогенной системы N2 + 3H2 ↔ 2NH3 Как изменится скорость прямой реакции — образования аммиака, если увеличить концентрацию водорода в три раза? 133. Реакция идет по уравнению N2 + О2 ↔ 2NО. Концентрации исходных веществ до начала реакции были: [N2] = 0,049 моль/л; [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NО] = 0,005 моль/л. Ответ: [N2] = 0,0465 моль/л; [О2] = 0,0075 моль/л. 134. Реакция идет по уравнению N2 + 3H2 ↔ 2NH3. Концентрации участвующих в ней веществ были: [N2] = 0,80 моль/л.; [Н2 ] = 1,5 моль/л.; [NН3 ] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л. Ответ: [NН3] = 0,70 моль/л; [Н2] = 0,60 моль/л. 135. Реакция идет по уравнению. Н2 + I2 ↔ 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2] = 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2] = 0,03 моль/л. Ответ: 3,2·10‒4; 1,92·10‒4. 136. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120º до 80°С. Температурный коэффициент скорости реакции равен 3. 137. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60ºС, если температурный коэффициент скорости данной реакции равен 2? 138. В гомогенной системе СO + Cl2 = СOCl2 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/л; [Сl2] = 0,3 моль/л; [СОСl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации Cl2 и СО. Ответ: К = 20; [Сl2]исх =1.5 моль/л; [СО]иcx = 1,4 моль/л. 139. В гомогенной системе А + 2В ↔ С равновесные концентрации реагирующих газов равны: [A] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 250; [А]исх = 0,276 моль/л; [В]исх = 0,552 моль/л. 140. В гомогенной газовой системе А + В ↔ С + D равновесие установилось при концентрациях: [В] = 0,05 моль/л и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А]исх = 0,22 моль/л; [В]исх = 0,07 моль/л.
ТЕМА 8: Способы выражения концентрации раствора
Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя. Пример 1. Вычислите: а) процентную (С%); б) молярную (СМ); в) эквивалентную (Сн); г) моляльную (Сm) концентрации раствора НзРО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр Т этого раствора? Решение. а) Массовая процентная концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 + 282 =300 г.
C %=
где: m – масса растворенного вещества, г; m1 – масса раствора, г.
C%=
б) Мольно‒объемная концентрация, или молярность (СМ), показывает число молей растворенного вещества, содержащегося в 1 л раствора. Масса 1 л раствора 1031 г. Массу кислоты в литре раствора находим из соотношения
CM =
где: m и М – соответственно масса растворенного вещества и его мольная масса; V(p-pa)= где r(р‒ра) – плотность раствора CM= в) Эквивалентная концентрация, или нормальность, показывает число эквивалентов растворенного вещества, содержащегося в 1 л раствора.
C н =
где: m и mэ – соответственно масса растворенного вещества и его эквивалентная масса. Эквивалентная масса Н3РО4 = М/3 = 97,99/3 = 32,66 г/моль,
Cн=
г) мольно‒массовая концентрация, или моляльность (Сm), показывает число молей растворенного вещества, содержащихся в 1000 г растворителя.
С m =
где: m и М – соответственно масса растворенного вещества и его мольная масса; m1 – масса растворителя. М (Н3РО4) = 97,99 г/моль
Сm= д) Титром раствора называется число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то
Т = Зная нормальность раствора и эквивалентную массу (mэ) растворенного вещества, титр легко найти по формуле
Т =
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н. раствора щелочи. Чему равна нормальность кислоты? Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных эквивалентных концентрациях (нормальностях): объемы растворов реагирующих веществ обратно пропорциональны их концентрациям, т.е.
Vкислоты·CН(кислоты) = Vщелочи·CH(щелочи).
Определим нормальность раствора кислоты:
Отсюда Cн(кислоты) = Пример 3. К 1 л 10%-го раствора КОН (ρ=1,092 г/см3) прибавили 0,5 л 5%‒‒го раствора КОН (ρ=1,045 г/см3).Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора. Решение. Масса одного литра 10%-ного раствора КОН 1092 г. В этом растворе содержится 1092·10/100 = 109,2 г КОН. Масса 0,5 л 5%-ного раствора 1045·0,5 = 522,5 г. В этом растворе содержится 522,5·5/100 =26,125 г КОН.
В общем объеме полученного раствора (2 л) содержание КОН составляет 109,2 + 26,125 = 135,325 г. Отсюда молярность этого раствора СМ =135,325/(2·56,1) = 1,2 М. где 56,1 г/моль — мольная масса КОН. Пример 4. Какой объем 96%-ной кислоты плотностью 1,84 г/см3 потребуется для приготовления 3 л 0,4 н. раствора? Решение. Эквивалентная масса Н2SO4 = М/2 = 98,08/2 = 49,04 г/моль. Для приготовления 3 л 0,4 н. раствора требуется 49,04·0,4·3 = 58,848 г H2SО4. Масса 1 см3 96%‒ной кислоты 1,84 г. В этом растворе содержится 1,84·96/100 = 1,766 г Н2SO4. Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848/1,766 = 33,32 см3 этой кислоты.
Контрольные задания согласно варианта из приложения А (таблица А.1) 141.Какой объем 10%-ного раствора карбоната натрия (пл. 1,105 г/см3) требуется для приготовления 5 л 2%-го раствора (ρ=1,02 г/см3)? Ответ: 923,1 см3. 142. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора Н2SO4. Чему равны нормальность и титр раствора Н2SO4? Ответ: 0,023 н.; 1.127·10‒3 г/см3. 143. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ: 26,6 см3. 144. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты. Ответ: 0,5 н. 145. Какая масса НNО3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Каков титр раствора NaOH? Ответ: 0,882 г, 0,016г/см3. 146. Какую массу NаNО3 нужно растворить в 400 г воды, чтобы приготовить 20%‒ный раствор? Ответ: 100 г. 147. Смешали 300 г 20%‒го раствора, и 500 г 40%‒го раствора NaCI. Чему равна процентная концентрация полученного раствора? Ответ: 32,5%. 148. Смешали 247 г 62%‒го и 145 г 18%‒го раствора серной кислоты. Какова процентная концентрация полученного раствора? Ответ: 45,72%. 149. Из 700 г 60%‒го раствора серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? Ответ: 84%. 150. Из 10 кг 20%‒го раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора? Ответ: 16,7%. 151. Вычислите молярную и эквивалентную концентрации 20%‒ного раствора хлорида кальция плотностью 1,178 г/см3. Ответ: 2,1 М; 4,2 н. 152. Чему равна нормальность 30%‒ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию, полученного раствора. Ответ: 9,96 н.; 6,3%. 153. К 3 л 10%‒ного раствора НNО3 плотностью 1,054 г/см3 прибавили 5 л 2%‒го раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрацию полученного раствора; объем которого равен 8 л. Ответ: 5,0%; 0,82 М. 154. Вычислите эквивалентную и моляльную концентрации 20,8%‒го раствора НNО3. плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Ответ: 3,70 н.; 4,17м; 931,8 г. 155. Вычислите молярную, эквивалентную и моляльную концентрации 16%‒ного раствора хлорида алюминия плотностью 1,149 г/см3. Ответ: 1,38 М; 4,14 н.; 1,43м. 156. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора Н2SO4. прибавить 125 см3 0,2 н. раствора КОН? Ответ: 0,14 г КОН. 157. Для осаждения в виде AgCI всего серебра, содержащегося в 100 см3 раствора AgNO3, потребовалось 50 см3 0,2 н. раствора НС1. Какова нормальность раствора AgNO3? Какая масса AgCI выпала в осадок? Ответ: 0,1 н.; 1,433 г. 158. Какой объем 20,01%‒го раствора НС1 (пл. 1,100 г/см3) требуется для приготовления 1 л 10,17%‒го раствора (пл. 1,050 г/см3)? Ответ: 485,38 см3. 159. Смешали 10 см3 10%‒ного раствора НNОз (пл. 1,056 г/см3) и 100см3 30%‒ного раствора НNО3 (пл. 1,184 г/см3). Вычислите процентную концентрацию полученного раствора. Ответ: 28,38%. 160. Какой объем 50%‒го раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6%‒го раствора (пл. 1,048 г/см3)? Ответ: 245,5 см3.
ТЕМА 9: Свойства растворов неэлектролитов и электролитов Пример 1. Вычислите температуры кристаллизации и кипения 2%-го водного раствора глюкозы С6Н12О6. Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (∆t) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением
∆t=
где: К – криоскопическая или эбуллиоскопическая константа; град m и М – соответственно масса растворенного вещества и его мольная масса; г и г/моль m1 – масса растворителя, г.
Понижение температуры кристаллизации 2%‒ного раствора С6Н12О6 находим из формулы:
∆tкр=
Вода кристаллизуется при 0°С, следовательно, температура кристаллизации раствора tкр = 0‒ Δtкр = 0 ‒ 0.21 = ‒0,21°С. Из формулы (1) находим и повышение температуры кипения 2%‒ного раствора:
Δtкип =
Вода кипит при 100 °С, следовательно, температура кипения этого раствора tкип = 100 + Δtкип = 100+ 0,06=100,06 С. Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529° С. Температура кипения сероуглерода 46,3°С. Вычислите эбуллиоскопическую константу сероуглерода. Решение. Повышение температуры кипения Δtкип = 46,529 ‒ 46,3 = 0,229°. Мольная масса бензойной кислоты 122 г/моль. Из формулы
∆tкип= находим эбуллиоскопическую константу:
К =
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при ‒ 0,279 °С. Вычислить мольную массу глицерина. Решение. Температура кристаллизации чистой воды 0°С, следовательно, понижение температуры кристаллизации Δtкр = 0‒(‒0,279) = 0,279° Вычисляем мольную массу глицерина из формулы:
∆tкр=
М=
Пример 4. Вычислите процентную концентрацию водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна ‒ 0,465 °С. Решение. Температура кристаллизации чистой воды 0°С, следовательно, Δtкр = 0 ‒ (‒0,465) = 0,465 °С. Мольная масса мочевины 60 г/моль. Находим массу (г) растворенного вещества, приходящуюся на 1000 г воды из формулы:
Δtкр =
m =
Общая масса раствора, содержащего 15 г мочевины, составляет 1000 + 15 = 1015 г. Процентное содержание мочевины в данном растворе находим из соотношения
С% = где: m – масса растворенного вещества, г; m1 – масса раствора, г.
С% =
Пример 5. Определите осмотическое давление при 18,5°С раствора, в 5 дм3 которого содержится 62,4 г CuSO4∙5Н2О. Кажущаяся степень диссоциации соли в растворе равна 0,38. Решение. CuSO4 ‒ сильный электролит. Осмотическое давление в растворе электролита рассчитываем по формуле
Росм = iCМRT,
где: i – изотонический коэффициент; CМ – молярная концентрация; R – универсальная газовая постоянная; T – температура, Т = 273 +18,5 = 291,5 К. Изотонический коэффициент (i)определяем из формулы кажущейся степени диссоциации (α):
α =
где: n – число ионов, на которые диссоциирует молекула электролита. CuSO4 диссоциирует на два иона: CuSO4 ↔ Cu2+ + SO42‒ (n = 2) Рассчитаем изотонический коэффициент: 0,38 = (i – 1) / (2 –1); i = 1,38. Определим молярную концентрацию:
СМ =
Масса CuSO4 в 62,4 г CuSO4∙5Н2О составляет: М(CuSO4∙5Н2О) = 160 + 5 ∙ 18 = 250 г/моль
250 г CuSO4∙5Н2О содержит 160 г CuSO4 62,4 г CuSO4∙5Н2О содержит m CuSO4
m CuSO4 = СМ =
Росм = iCМRT = 1,38∙0,05∙8,314∙291,5 = 167,2 Па Контрольные задания согласно варианта из приложения А (таблица А.1) 161. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна ‒ 0,558 °С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°С. Ответ: 442 г/моль. 162. Осмотическое давление 0,125 М раствора KBr равно 5,63∙105 Па при 25°С. Определите величину кажущейся степени диссоциации соли. Ответ: 82%. 163. Чему равны рН и рОН 1 н раствора НСN, если ее константа диссоциации Кдис = 4,9∙10‒10? Ответ: рН = 4,6; рОН = 9,4. 164. Кажущаяся степень диссоциации 0,12 М раствора AgNO3 равна 60 %. Определите концентрацию ионов Ag+ и NO3‒ в моль/дм3 и г/дм3.Ответ: 0,072 моль/дм3; 4,46 г/дм3; 7,78 г/дм3. 165. Вычислите процентную концентрацию водного раствора глюкозы С6Н12О6, зная, что этот раствор кипит при 100,26°С. Эбуллиоскопическая константа воды 0,52°. Ответ: 8,25%. 166. Раствор, содержащий 0,60 г Na2SO4 в 720 г воды начинает кристаллизоваться при температуре –0,028°С. Чему равно осмотическое давление в этих же условиях, если ρ = 1 г/см3? Ответ: 34,74 Па. 167. Чему равна температура кристаллизации раствора, который содержит 84,9 г NаNO3 в 1000 г воды? Давление насыщенного пара над этим раствором составляет 2268 Па, а давление водяного пара при той же температуре 2338 Па. Ответ: ‒3,16ºС. 168. Найдите моляльность, нормальность и молярность 15%‒ного (по массе) раствора Н2SO4 (ρ = 1,10 г/мл). Ответ: 1,80 моль/кг; 3,37 н; 1,68 моль/л. 169. Рассчитайте относительное понижение давления насыщенного пара над раствором, содержащем 0,1 моль Na2SO4 в 900 г воды при 70°С. Кажущаяся степень диссоциации в этом растворе равна 80%. Давление насыщенного водяного пара при этой же температуре равно 31157 Па. Ответ: 0,0052 Па. 170. Вычислите процентную концентрацию водного раствора метанола СН3ОН, температура кристаллизации которого ‒2,79°С. Криоскопическая константа воды 1,86°С. Ответ: 4,58%. 171. Определите сильный или слабый электролит уксусная кислота, если раствор, содержащий 0,571 г кислоты в 100 г воды, замерзает при ‒ 0,181°С. Ответ: 2,2%. 172. Вычислите процентную концентрацию водного раствора сахара С12Н22О11, зная, что температура кристаллизации раствора ‒0,93°С. Криоскопическая константа воды 1,86о. Ответ: 14,6%. 173. Давление насыщенного пара над раствором, который содержит 66,6 г СаСl2 в 90 г воды при 90°С равно 56690 Па. Чему равна степень диссоциации соли, если давление водяного пара води при этой же температуре равно 70101 Па? Ответ: 39 %. 174. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,714 °С. Температура кипения бензола 80,2 °С. Вычислите эбуллиоскопическую константу бензола. Ответ: 2,57 ºС. 175. Изотонический коэффициент водного раствора хлоридной кислоты (ωHCl = 6,8%) равен 1,66. Определите температуру кристаллизации этого раствора. Ответ: ‒ 6,17 ºС. 176. Вычислите мольную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при ‒0,279 °С. Криоскопическая константа воды 1,86 °С. Ответ: 60 г/моль. 177. Вычислите температуру кипения 5%‒го раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2°С. Эбуллиоскопическая константа его 2,57°С. Ответ: 81,25°С. 178 Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при ‒ 0,465 ºС. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86 ºС. Ответ: 342 г/моль. 179. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718°С. Температура кристаллизации уксусной кислоты 16,65 ºС. Ответ: 3,9°С. 180. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81ºС. Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая константа бензола 2,57ºС. Ответ: 8.
ТЕМА 10: Ионно‒молекулярные (ионные) реакции обмена
При решении задач этого раздела необходимо пользоваться таблицей растворимости солей и оснований в воде и таблицей констант и степеней диссоциации слабых электролитов. Ионно‒молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме.
В ионно‒молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно‒молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения Пример 1. Написать ионно‒молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) НСl и NaOH; б) Рb(NО3)2 и Na2S; в) NaClO и HNO3; г) К2СО3 и H2SO4; д) СН3СООН и NaOH. Решение. Запишем уравнения взаимодействия указанных веществ в молекулярном виде: а) НСl + NaOH = NaСl + Н2O б) Рb(NО3)2 + Na2S = РbS + 2NaNО3 в) NaClO + HNO3 = NaNO3 + HCIO г) К2СО3 + H2SO4 = К2 SO4 + H2О + СО2 д) СН3СООН + NaOH = СН3СООNa + Н2O Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов (Н2O, HClO), осадка (РbS), газа (СО2). В реакции (д) два слабых электролита, но так как реакции идут в сторону большего связывания ионов и вода — более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства a) Na+ и Сl‒; б) Na+ и NO3‒; в) Na+ и NO3‒; г) К+ и SО42‒; д) Na+, получим ионно‒молекулярные уравнения соответствующих реакций:
а) Н+ + ОН‒ = Н2O б) Рb2+ + S2‒ = РbS в) ClO‒ + H+ = HClO г) СО32‒ + 2H+ = H2О + СО2 д) СН3СООН + OH‒ = СН3СОО‒ + Н2O
Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно‒молекулярные уравнения:
а) SО32‒ + 2H+ = SО2 + Н2O б) Рb2+ + СrО42‒ = РbСrО4 в) НСО3‒ + ОH‒ = СО32‒ + H2О г) ZnОН+ + H+ = Zn2+ + H2О
В левой части данных ионно‒молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов. Следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например:
а) Nа2SО3 + 2HСl = 2NаСl + SО2 + Н2O б) Рb(NО3)2 + К2СrО4 = РbСrО4 + 2КNО3 в) КНСО3 + КОH = К2СО3 + H2О г) ZnОНСl + HСl = ZnСl2 + H2О
Контрольные задания согласно варианта из приложения А (таблица А.1) 181. Составьте молекулярные уравнения реакций, которые выражаются ионно‒молекулярными уравнениями: а). СаСО3 + 2H+ = Са2+ + H2О + СО2 б). Аl(ОН)3 + ОН‒ = АlО2‒ + 2H2О в). Pb2+ + 2I‒ = PbI2 182. Составьте молекулярные и ионно‒молекулярные уравнения реакций взаимодействия в растворах между: а) Ве(ОН)2 и NaOH; б) Cu(OH)2 и HNO3; в) ZnOHNO3 и HNO3. 183. Составьте молекулярные и ионно‒молекулярные уравнения реакций взаимодействия в растворах между: а) Nа3РО4 и СаСl2; б) К2СО3 и BaСl2; в) Zn(OH)2 и КОН. 184. Составьте молекулярные уравнения реакций, которые выражаются ионно‒молекулярными уравнениями: а). Fе(ОН)3 + 3Н+ = Fе3+ + 3Н2О б) Cd2+ + 2OH‒ = Cd(OH)2 в). Н+ + NО2‒ = HNО2 185. Составьте молекулярные и ионно‒молекулярные уравнения реакций взаимодействия в растворах между: a) CdS и НСl; б) Сг(ОН)3 и NaOH, в) Ва(ОН)2 и СоСl2. 186. Составьте молекулярные уравнения реакций, которые выражаются ионно‒молекулярными уравнениями: а) Zn2+ + Н2S = ZnS + 2Н+ б) НСО3‒ + Н+ = Н2О + СО2 в) Ag+ + Сl‒ = AgСl 187. Составьте молекулярные и ионно‒молекулярные уравнения реакций взаимодействия в растворах между: a) H2SO4 и Ва(ОН)2; б) FеСl3 и NH4ОH; в) CH3COОNa и HCI. 188. Составьте молекулярные и ионно‒молекулярные уравнения реакций взаимодействия в растворах между: а) FеСl3 и КОН; б) NiSО4 и (NH4)2S; в) МgСО3 и HNО3. 189. Составьте молекулярные уравнения реакций, которые выражаются ионно‒молекулярными уравнениями: а). Ве(ОН)2 + 2ОН‒ = ВеО22‒ + 2Н2О б). CH3COО‒ + H+ = CH3COОH в). Ва2+ + SО42‒ = ВаSО4 190. Какое из веществ: NaCI, NiSО4, Ве(ОН)2, КНСО3 ‒ взаимодействует с раствором гидроксида натрия. Запишите молекулярные и ионно‒молекулярные уравнения этих реакций. 191. Составьте молекулярные и ионно‒молекулярные уравнения реакций взаимодействия в растворах между: а) NаНСО3 и NaOH; б) К2SiО3 и HСl; в) BaСl2 и Na2SО4. 192. Составьте молекулярные и ионно‒молекулярные уравнения реакций взаимодействия в растворах между: a) K2S и НСl; б) FeSО4 и (NН4)2S; в) Сr(ОН)3 и КОН. 193. Составьте по три молекулярных уравнения реакций, которые выражаются ионно‒молекулярными уравнениями: а) Мg2+ + СО32‒ = МgСО3; б) Н+ + ОН‒ = Н2O 194. Какое из веществ: Аl(ОН)3; H2SО4; Ba(OH)2 ‒ будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно‒молекулярными уравнениями. 195. Составьте молекулярные и ионно‒молекулярные уравнения реакций взаимодействия в растворах между: а) КНСО3 и Н2SО4; б) Zn(OH
|
|||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.143.239 (0.313 с.) |
 298(H2O)= ‒228,59 кДж/моль, а ∆G
298(H2O)= ‒228,59 кДж/моль, а ∆G  =
=  = 27
= 27  = 9
= 9 ,
,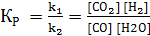 ;
;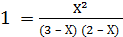 ; Х = 1,2 моль/л.
; Х = 1,2 моль/л. ,
, =6%
=6% ,
, =
= 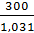 =291,
=291, =0,63 M.
=0,63 M.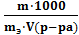 ,
, =1,89 н.
=1,89 н.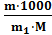 ,
,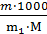 =
=  =0,65 кг.
=0,65 кг. = 0,06186 г/см3.
= 0,06186 г/см3.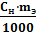
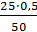 = 0,25 н.
= 0,25 н. ,
, =
= 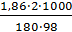 = 0,21°С.
= 0,21°С. = 0,06°С.
= 0,06°С. =
= 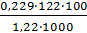 = 2,29°С
= 2,29°С =
=  = 92 г/моль.
= 92 г/моль.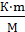 ;
;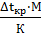 =
=  = 15 г.
= 15 г.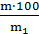 ,
,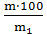 =
=  = 1,48%
= 1,48%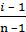
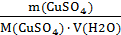
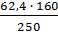 = 39,94 (г)
= 39,94 (г)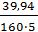 = 0,05 моль/дм3
= 0,05 моль/дм3


