
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 18: жесткость воды и методы ее устранения
Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Мg2+, содержащихся в 1 л воды (мэкв/л). Один миллиэквивалент жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Мg2+. Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2. Решение. В 1 л воды содержится 202,5/500 = 0,405 г Са(НСО3)2, что составляет 0,405: 81 == 0,005 эквивалентных масс или 5 мэкв/л [81 г/моль ‒ эквивалентная масса Са(НСО3)2]. Следовательно, жесткость воды 5 мэкв. Пример 2. Сколько граммов CaSO4, содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 мэкв? Решение. Мольная масса CaSO4 равна 136,14 г/моль; эквивалентная масса равна 136,14/2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 мэкв содержится 4 · 1000 = 4000 мэкв, или 4000 · 68,07 = 272280 мг = 272,280 г CaSO4. Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 мэкв/л? Решение. В 500 л воды содержится 500 · 5 = 2500 мэкв солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132500 мг = 132,5 г соды (53 г/моль ‒ эквивалентная масса Na2СО3). Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора HCI. Решение. Вычисляем нормальность раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, т.е. нормальность, через х, составляем пропорцию:
Таким образом, в 1 л исследуемой воды содержится 0,005 · 1000 = 5 мэкв гидрокарбоната кальция или 5 мэкв Са2+‒ионов. Карбонатная жесткость воды 5 мэкв. Приведенные примеры решают, применяя формулу
Ж =
где m ‒ масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг; Э ‒ эквивалентная масса этого вещества; V – объем воды, л. Решение примера 1. Ж =
Решение примера 2. Из формулы Ж=
Контрольные задания согласно варианта из приложения А (таблица А.1) 341. Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5 мэкв. Какая масса гидрокарбоната магния содержится в 200 л этой воды? Ответ: 51,1 г. 342. К 1 м3 жесткой воды прибавили 132,5 г карбоната натрия. Насколько понизилась жесткость? Ответ: на 2,5 мэкв/л.
343. Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия? Ответ: 8 мэкв/л. 344. Какая масса CaSО4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 мэкв/л? Ответ: 108,9 г. 345. Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 мэкв/л. Какая масса гидрокарбоната кальция содержится в 500 л воды? Ответ: 364,5 г. 346. Какие ионы надо удалить из природной воды, чтобы сделать ее мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций. Какую массу Са(ОН)2 надо прибавить к 2,5 л воды, чтобы устранить ее жесткость, равную 4,43 мэкв/л? Ответ: 0,406 г. 347. Какую массу карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 мэкв/л? Ответ: 21,2 г. 348. К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. Насколько понизилась карбонатная жесткость? Ответ: на 3,5 мэкв/л. 349. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция? Ответ: 6,5 мэкв/л. 350. Какую массу гидроксида кальция надо прибавить к 275 л воды чтобы устранить ее карбонатную жесткость, равную 5,5 мэкв/л? Ответ: 55,96 г. 351. Какую массу Na3PO4, надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 мэкв/л? Ответ: 136,6 г. 352. Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния? Ответ: 2 мэкв/л. 353. Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 0,08н раствора HCl. Ответ: 6 мэкв/л., 354. В 1 л воды содержится ионов магния 36,47 мг и ионов кальция 50,1мг. Чему равна жесткость этой воды? Ответ: 5,5 мэкв/л. 355. Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 мэкв/л. Ответ: 63,6 г. 356. Вода, содержащая только сульфат магния, имеет жесткость 7 мэкв. Какая масса сульфата магния содержится в 300 л этой воды? Ответ: 126,3 г.
357. Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбонате магния и 61,2 сульфата кальция. Ответ: 3,2 мэкв/л. 358. В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды? Ответ: 0,83 мэкв/л. 359.Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 мэкв. Какой объем 0,1 н раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды? Ответ: 3 см3. 360. В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. Ответ: 2,33 мэкв/л.
ТЕМА 19: р ‒ Элементы (… ns 2 np 1‒6) Контрольные задания согласно варианта из приложения А (таблица А.1) 361. В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения: а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой. 362. Почему фосфористая кислота способна к реакциям самоокисления — самовосстановления (диспропорционирования)? На основании электронных уравнений составьте уравнение процесса разложения H3PO3, учитывая, что при этом фосфор приобретает низшую и высшую степени окисления. 363. В каком газообразном соединении фосфор проявляет свою низшую степень окисления? Напишите уравнения реакций: а) получения этого соединения при взаимодействии фосфида кальция с хлоридной (соляной) кислотой; б) горения его в кислороде. 364. Какую степень окисления проявляют мышьяк, сурьма и висмут? Какая степень окисления является более характерной для каждого из них? Составьте электронные и молекулярные уравнения реакций: а) мышьяка с концентрированной азотной кислотой; б) висмута с концентрированной серной кислотой. 365. Как изменяются окислительные свойства галогенов при переходе от фтора к йоду и восстановительные свойства их отрицательно заряженных ионов? Почему? Составьте электронные и молекулярные уравнения реакций: а) С12 + I2 + H2O =; б) KI + Вr2 =. Укажите окислитель и восстановитель. 366. Составьте электронные и молекулярное уравнения реакции, происходящей при пропускании хлора через горячий раствор гидроксида калия. К какому типу окислительно‒восстановительных процессов относится данная реакция? 367. Какие реакции нужно провести для осуществления следующих превращений: NaCl → HCl → Cl2 → KСlO3 Уравнения окислительно‒восстановительных реакций составьте на основании электронных уравнений. 368. К раствору, содержащему SbCl3 и BiCl3, добавили избыток раствора гидроксида калия. Напишите молекулярные и ионно‒молекулярные уравнения происходящих реакций. Какое вещество находится в осадке? 369. Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия хлоридной (соляной) и разбавленной серной кислот? Что является окислителем в первом случае, что — в двух других? Приведите примеры. 370. Напишите формулы и назовите кислородные кислоты хлора, укажите степень окисления хлора в каждой из них. Какая из кислот более сильный окислитель? На основании электронных уравнений закончите уравнение реакции: KI + NaOCl + H2SO4 → I2 +... Хлор приобретает низшую степень окисления. 371. Какие реакции нужно провести, имея азот и воду, чтобы получить нитрат аммония? Составьте уравнения соответствующих реакций.
372. Какую степень окисления может проявлять кремний в своих соединениях? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: Mg2Si → SiH4 → SiO2 → K2SiO3 → H2SiO3 При каком превращении происходит окислительно‒восстановительная реакция? 373. Какое применение находит кремний? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: SiO2 → Si → K2SiO3 → H2SiO3 Окислительно‒восстановительные реакции напишите на основании электронных уравнений. 374. Как получают диоксид углерода в промышленности и в лаборатории? Напишите уравнения соответствующих реакций и реакций, с помощью которых можно осуществить следующие превращения: NaHCO3 → CO2 → CaCO3 → Ca(HCO3)2 375. Какие из солей угольной кислоты имеют наибольшее промышленное применение? Как получить соду, исходя из металлического натрия, хлоридной (соляной) кислоты, мрамора и воды? Почему в растворе соды лакмус приобретает синий цвет? Ответ подтвердите составлением уравнений соответствующих реакций. 376. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Al → Al2(SO4)3 → Na[Al(OH)4] → Al(NO3)3 377. Составьте электронные и молекулярные уравнения реакций: а) алюминия с раствором щелочи; б) бора с концентрированной азотной кислотой. 378. Какой процесс называется алюминотермией? Составьте электронные и молекулярные уравнения реакции, на которой основано применение термита (смесь Аl и Fe3O4). 379. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: B → H3BO3 → Na2B4O7 → H3BO3 Уравнение окислительно‒восстановительной реакции составьте на основании электронных уравнений. 380. Какая степень окисления наиболее характерна для олова и какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой. 381. Чем можно объяснить восстановительные свойства соединений олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций: a) SnCl2 с HgCl2; б) РЬО2 с НС1 конц. 382. Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно‒основные и окислительно‒восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно‒молекулярные уравнения реакций взаимодействия раствора гидрoксида натрия: а) с оловом; б) с гидроксидом свинца (II).
383. Какие соединения называются карбидами и силицидами? Напишите уравнения реакций: а) карбида алюминия с водой; б) силицида магния с хлороводородной (соляной) кислотой. Являются ли эти реакции окислительно‒восстановительными? Почему? 384. На основании электронных уравнений составьте уравнение реакции фосфора с азотной кислотой, учитывая, что фосфор приобретает высшую, а aзот ‒ степень окисления + 4. 385. Почему атомы большинства р‒элементов способны к реакциям диспропорционироваиия (самоокисления-самовосстановления)? На основании электронных уравнений напишите уравнение реакции растворения серы в концентрированном растворе щелочи. Один из продуктов содержит серу в степени окисления +4. 386. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций H2SO3: а) с сероводородом; б) с хлором. 387. Как проявляет себя сероводород в окислительно‒восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом. 388. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций НNO2: а) с бромной водой; б) с HI. 389. Почему диоксид азота способен к реакциям самоокисления — самовосстановления (диспропорционирования)? На основании электронных уравнений напишете уравнение реакции растворения N02 в гидроксиде натрия. 390. Какие свойства в окислительно‒восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной — с медью. Укажите окислитель и восстановитель.
|
||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 176; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.182.45 (0.03 с.) |
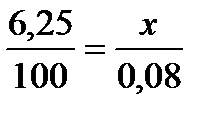 ,
,  =0,005н.
=0,005н. ,
,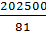 · 500 = 5 мэкв/л (81 г/моль ‒ эквивалентная масса Са(НСО3)2, равная половине его мольной массы).
· 500 = 5 мэкв/л (81 г/моль ‒ эквивалентная масса Са(НСО3)2, равная половине его мольной массы).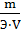 , т = 4 · 68,07 · 1000 = 272280 мг =272,280 г CaSO4.
, т = 4 · 68,07 · 1000 = 272280 мг =272,280 г CaSO4.


