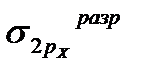Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ТЕМА 4: Химическая связь и строение молекул. Конденсированное состояние вещества.
Пример 1. Какую валентность, обусловленную неспаренными электронами (спин‒валентность), может проявлять фосфор в нормальном и возбужденном (*) состояниях? Решение. Распределение электронов внешнего энергетического уровня фосфора …3s2 3р3 (учитывая правило Хунда, 3s2 3рX 3рУ 3рZ) по квантовым ячейкам имеет вид:
Атомы фосфора имеют свободные d‒орбитали, поэтому возможен переход одного 3s‒электрона в Зd‒состояние. Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти.
Пример 2. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp‒, sp2‒, sp3‒ гибридизации орбиталей атома А? Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только «чистых» АО, но и «смешанных», так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей (q) равно числу исходных. Ответ на поставленный вопрос отражен в табл. 3.
Таблица 3 – Гибридизация орбиталей и пространственная конфигурация молекул.
Пример 3. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2, большую прочность связей в молекулярных ионах F2+ и О2+, чем, соответственно, в молекулах F2 и О2; меньшую прочность связи в ионе N2+, чем в молекуле N2; существование молекулярного иона Не2+ и неустойчивость молекулы Не2; и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомных, соответствует более высокая энергия, чем атомным орбиталям. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр.) электронами. Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σсв1s<σразр1s<σсв2s<σразр2s<σсв2рx<πсв2ру=πсв2рz<πразр2ру=πразр2рz<σразр2рx
Энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода дана в учебнике «Общая химия» Н.Л.Глинка. Следует отметить, что при образовании молекул В2, С2 и N2 энергия связывающей σ2рх,‒орбитали больше энергии связывающих π2pу‒ и π2рz‒орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих π2pу‒ и π2рz‒орбитапей больше энергии связывающей σ2рх‒орбитали. Это нужно учитывать при изображении энергетических схем («Общая химия» Н.Л.Глинка) соответствующих молекул.
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
Рисунок 1 – Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода. Контрольные задания согласно варианта из приложения А (таблица А.1) 61. Нарисуйте энергетическую схему образования молекулы Не2 и молекулярного иона Не2+ по методу молекулярных орбиталей. Как метод МО объясняет устойчивость иона Не2+ и невозможность существования молекулы Не2? 62. Какую химическую связь называют водородной? Между молекулами каких веществ она образуется? Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги? 63. Какую химическую связь называют ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы. 64. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях СН4, СН3ОН, НСООН, СО2. 65. Какие силы молекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы и какова их природа? 66. Нарисуйте энергетическую схему образования молекулярного иона Н2‒ и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему? 67. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей (ВС) объясняет симметричную треугольную форму молекулы ВF3? 68. Нарисуйте энергетическую схему образования молекулы О2 по методу молекулярных орбиталей (МО). Как метод МО объясняет парамагнитные свойства молекулы кислорода? 69. Нарисуйте энергетическую схему образования молекул F2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле? 70. Нарисуйте энергетическую схему образования молекулы N2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле? 71. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды? 72. Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов, определите, какая из связей: HI, ICℓ, BrF — наиболее полярна. 73. Какой способ образования ковалентной связи называют донорно‒акцепторным? Какие химические связи имеются в ионах NH4+ и BF4‒. Укажите донор и акцептор.
74. Как метод валентных связей (ВС) объясняет линейное строение молекулы BeC12 и тетраэдрическое СН4? 75. Какую ковалентную связь называют σ‒связью и какую π‒связью? Разберите на примере строения молекулы азота. 76. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами? 77. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденных состояниях? Чему равна валентность серы, обусловленная неспаренными электронами? 78. Что называют электрическим моментом диполя? Какая из молекул НС1, НВг, HI имеет наибольший момент диполя? Почему? 79. Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Кристаллы каких веществ: алмаз, хлорид натрия, диоксид углерода, цинк — имеют указанные структуры? 80. Как метод валентных связей (ВС) объясняет угловое строение молекул H2S и линейное молекулы СО2?
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 96; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.32.116 (0.011 с.) |