
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация воды. Водородный показатель.
Чистая вода слабо проводит эл-й ток в результате низкой степени ее диссоциации, т.е, она является слабым электролитом
[H+] ∙ [ОН-] Кд = ----------------, [H2O] Величина ее в с.у. близка к 10-10. В результате столь малой величины Кд, концентрацию недиссоциированных молекул воды м. считать постоянной, она равна 55,56 моль/л. Эту концентрацию м включить в константу равновесия, полученная в результате величина называется ионным произведением воды и пишут К H 2 O = [ H +].[ OH -] ионное произведение воды – произведение концентраций катионов Н+ на концентрацию гидроксид-анионов ОН-. При 250 С в чистой воде концентрации ионов равны:
[H+] = [ОН-] = 10-7 моль/л В общем случае, когда конц-ции протонов = конц-ции гидроксид анионов, в водном р-ре, он называется нейтральным. Если больше первая – р-р кислый, если больше вторая – щелочной. С учетом приведенных конц-ций для чистой воды -14 К H2O = 10 Для воды и разбавленных водных р-ров при комнатной т-ре ионное произведение воды – величина постоянная, равная 10-14 Зная ионное произведение воды и концентрацию добавленной к-ты или основания, м рассчитать, соответственно, конц-цию гидроксианионов или протонов в р-ре, исходя из следующих формул: -14 К H2O 10 [H+] = -------- = ------------ [ОН-] [основания] -14 К H2O 10 [ОН-] = -------- = ------------ [H+] [кислоты]
Пользоваться на практике концентрациями ионов, являющимися очень малыми величинами, неудобно, поэтому был предложен т.н. водородный показатель воды - рН Водородный показатель равен десятичному логарифму концентрации протонов, взятому с противоположным знаком: рН= - lg [Н+], аналогично
рОН = - lg [ОН-], Правило: «Сумма рН и рОН в разбавленных р-рах и в чистой воде =14» рН + рОН = 14 Величина водородного показателя равна: -7 - в нейтральном р-ре [Н+] = 10 моль / л, рН = 7
-7 - в кислом р-ре [Н+] > 10 моль / л, рН < 7
-7 - в щелочном р-ре [Н+] < 10 моль / л, рН > 7
Видно, что величина водородного показателя определяет кислотность р-ра. Определение рН р-ров на практике осуществляется при помощи индикаторов – лакмус – кислой – красный, в нейтральной – свой, фиолетовый, в щелочной - синий метиловый оранжевый – в кислой – красный, в нейтральной – свой, оранжевый, в щелочной - желтый фенолфталеин – в кислой – бесцветный в нейтральной – бесцветный, в щелочной – малиновый. Кроме этого существуют универсальные приборы, позволяющие определить рН с точностью до 0,1 и выше в интервале рН от 1 до 14.
Значения рН различных биожидкостей и тканей организма
|
|||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 91; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.33.107 (0.005 с.) |

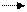 Н2О Н+ + ОН-, константа ее диссоциации м.б. выражена следующим образом:
Н2О Н+ + ОН-, константа ее диссоциации м.б. выражена следующим образом:


