
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислоты, основания и соли с точки зрения теории электролитической диссоциации.
2-
Кислоты представляют собой жидкости (Н2SO4, HNO3) или твердые вещества (H3PO4). Большинство кислот хорошо растворимы в воде, р-ры их имеют кислый вкус, окрашивают индикаторы – лакмус – в красный цвет, метиловый оранжевый – в красный, фенолфталеин – в бесцветный Гидроксиды – электролиты, при Д которых в качестве аниона образуются только ионы ОН-
Сильные многокислотные основания дис-ют ступенчато: по первой ступени необратимо, а по остальным – обратимо.
2+
Амфотерные гидроксиды - электролиты, при Д которых образуются ионы H+ и OH –, т.е. дис-щиеся по типу кислоты и основания, к ним относятся Al(OH)3, Zn(OH)2, Fe(OH)3, Cr(OH)3, Be(OH)2, Sn(OH)4, Pb(OH)2 и др. Явление амфотерности объясняется тем, что в молекуле прочность связи между металлом и кислородом незначительно отличается от прочности связи между О и Н. В р-ре амфолита существует сложное равновесие, в котором участвуют продукты Д как кислот, так и оснований: + 2- 2+ -
По типу к-ты по типу основания Гидроксиды представляют собой твердые вещества, растворимые в воде, изменяют окраску индикаторов – лакмус – в синий, метиловый оранжевый – в желтый, фенолфталеин – в малиновый.
Na2SO4 2Na+ + SO4 2- ОснОвные соли (гидроксосоли) – продукт неполного замещения гидроксогруппы в молекуле многокислотного основания. Они дис-ют ступенчато, причем Д по II ступени незначительная
2+
Кислые соли – (гидросоли) – продукт неполного замещения протонов Н в молекуле многоосновной кислоты: .
(KOH H2CO3)
Двойные соли – соли, образованные катионами различных металлов и анионом одной кислоты. Диссо-т они по одной ступени: KAl(SO4)2 = K+ + Al3+ + 2SO42_ Смешанные соли – соли, образованные катионом одного металла и анионами различных кислот. Дис-т тоже по 1 ступени: CaOCl2 = Ca2+ + Cl- + ClO- Соли – чаще всего твердые кристаллические вещества, бесцветные (K2CO3, NaCl), окрашенные (MgCl2, HgS, CrCl3) по растворимости в воде м.б: -Хорошо растворимые КNO3, Na2SO4 -Малорастворимые СaSO4 -Практически нерастворимые ВaSO4
|
|||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 132; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.27.244 (0.005 с.) |

 Кислоты – это электролиты, при Д которых в качестве катионов образуются только протоны водорода. HCl H+ + Cl- по числу катионов Н, образующихся при Д 1 молекулы кислоты, определяют ее основность (одноосновные HCl, двухосновные Н2SO4, трехосновные H3PO4). Сильные многоосновные кислоты диссоциируют ступенчато: по первой ступени необратимо, а по остальным – обратимо.
Кислоты – это электролиты, при Д которых в качестве катионов образуются только протоны водорода. HCl H+ + Cl- по числу катионов Н, образующихся при Д 1 молекулы кислоты, определяют ее основность (одноосновные HCl, двухосновные Н2SO4, трехосновные H3PO4). Сильные многоосновные кислоты диссоциируют ступенчато: по первой ступени необратимо, а по остальным – обратимо. I Н2SO4 H+ + НSO4 –
I Н2SO4 H+ + НSO4 –
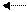 II НSO4 - H+ + SO4
II НSO4 - H+ + SO4 NaOH Na+ + OH- по числу гидроксогрупп, образующихся при Д 1-й молекулы гидроксида, определяют его кислотность: однокислотные - NaOH, КОН, 2кислотные – Са(OH)2, Mn(OH)2, Mg(OH)2, 3кислотные - Fe(OH)3, Cr(OH)3.
NaOH Na+ + OH- по числу гидроксогрупп, образующихся при Д 1-й молекулы гидроксида, определяют его кислотность: однокислотные - NaOH, КОН, 2кислотные – Са(OH)2, Mn(OH)2, Mg(OH)2, 3кислотные - Fe(OH)3, Cr(OH)3. I Са(OH)2 СаOH+ + OH –
I Са(OH)2 СаOH+ + OH –


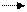 2H + ZnO2 Zn(OH)2 Zn + 2 OH
2H + ZnO2 Zn(OH)2 Zn + 2 OH
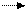 Соли - электролиты, при Д которых образуются катионы металла и анионы кислотного остатка. Средние соли – продукт полной нейтрализации кислоты и основания, т.е. их м представить как электролиты, при Д которых образуются катионы, отличные от Н+ и анионы, отличные от ОН-, они дис-ют в одну сторону, необратимо.
Соли - электролиты, при Д которых образуются катионы металла и анионы кислотного остатка. Средние соли – продукт полной нейтрализации кислоты и основания, т.е. их м представить как электролиты, при Д которых образуются катионы, отличные от Н+ и анионы, отличные от ОН-, они дис-ют в одну сторону, необратимо. I СuOHCl СuOH+ + Cl –
I СuOHCl СuOH+ + Cl –
 I KHCO3 K+ + HCO3 -
I KHCO3 K+ + HCO3 -


