
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамические расчеты основных реакций
При фторировании исходной руды бифторидом аммония возможно взаимодействие как непосредственно браннерита, так и основных компонентов руды и примесей. Рассчитаем термодинамику возможных реакций, для упрощения расчетов принимая, что теплоемкость веществ остается постоянной во всем диапазоне температур 298-373 К. Термодинамические расчеты осложняются тем, что для ряда веществ отсутствуют (либо приводятся лишь приблизительные) термодинамические характеристики. Расчет термодинамики химических реакций проводился по следствию из закона Гесса.
где
Термодинамические расчеты представлены в таблице 5.
Таблица 5– Возможные реакции взаимодействия основных компонентов руды с БФА
Таблица 6 – Результаты термодинамических расчетов
Взаимодействие оксидов урана с бифторидом аммония, наиболее вероятно, протекает по следующим реакциям: Таблица 7 – Возможные реакции взаимодействия соединений урана с БФА
Таблица 8 – Результаты термодинамических расчетов
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 135; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.151.141 (0.005 с.) |
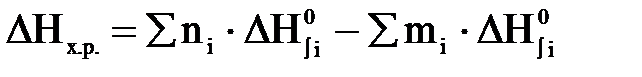 ;
;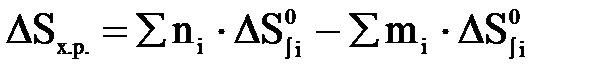
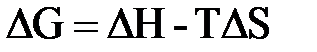
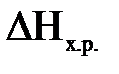 – стандартная энтальпия образования веществ
– стандартная энтальпия образования веществ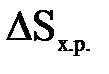 – стандартная энтропия образования веществ
– стандартная энтропия образования веществ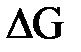 – энергия Гиббса
– энергия Гиббса


