Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закономірності протікання сорбційних процесів
Рівновага визначає: - початок, рушійну сила сорбції; - базовий проскок, який визначається рівнем регенерації іоніту в останній рівноважній зоні; - засіб контролю – повна регенерація. Кінетика визначає: - протікання процесу, сили протидії; - зону іонного обміну, яка може перевищувати висоту завантаження іоніту. Як наслідок, деякі іони проходять крізь шар іоніту без взаємодії з іонітом; - неправильну конструкція фільтру або перешкоджання дифузії Динаміка визначає: - на відміну від статики не ситуації, а процеси; - різноманітні зміни станів, швидкості таких змін, зміни швидкості тощо. Статика (рівновага) сорбційного процесу В процесі сорбції між розчином та сорбентом відбувається перерозподіл компонентів і поступово встановлюється сорбційна рівновага, за якої концентрації всіх компонентів будуть постійними. Рівноважне розподілення компонентів (у вигляді іонів) підпорядковується ЗДМ як для звичайних електролітів з визначенням певної для даних умов константи рівноваги
Кс – коефіцієнт вибірковості для обміну одного іону на інший (н-д, H-Na) – константа рівноваги з ЗДМ. Цей коефіцієнт різний для кожної пари іонів, тому що селективність (вибірковість) сорбенту до іону визначається розміром його гідратної оболонки. Чим більше іон, тим більше повинно розширитися зерно сорбенту, аби його розмістити[3]. Розширенню заважають міжмолекулярні зв'язки. Більший іон потребує більшої сили для проникнення в сорбент. Ступінь міжмолекулярних зв'язків в сорбенті неоднорідна, тому обмінний іон шукає в сорбенті найбільш сприятливу ділянку. Всі обмінні реакції стають менш активними в процесі завершення. Н-д, при 8 % ступені міжмолекулярних зв'язків: Кс для пар H-Na = 1,5, H-K = 2,5, H-Mg = 2,5, H-Ca =3,9 Залежність між рівноважними концентраціями сорбуємих компонентів в сорбенті та розчині визначається рівняннями статики (відмінними від ЗДМ) або рівняннями ізотермсорбції при постійній температурі. Особливість рівнянь ізотерм – відсутність параметрів, від яких залежить кінетика процесу (параметри дифузії). Сорбційну рівновагу зручно графічно зображувати у вигляді квадрату, по сторонам якого відкладені частки або відсотки компонентів в розчині та сорбенті – криві рівноваги або ізотерми сорбції.
Ізотерма сорбції - залежність складу сорбенту від складу зовнішнього розчину при р,Т=Const (звідси назва): На осі ординат, значення на якій змінюється від 0 до 1, відкладають значення еквівалентних часток (тому 1 – перевага використання) іону в сорбенті, на осі абсцис – те ж для розчину. У цьому випадку ізотерма не залежить від засобу вираження концентрації. Отримують ізотерми обміну експериментально, вимірюючи концентрації в розчині та розраховуючи концентрації в сорбенті. Ізотерма обміну м.б. отримана для окремого іону чи декількох конкуруючих іонів. Ізотерми бувають трьох основних видів: лінійні, опуклі, ввігнуті в залежності від характеру руху концентраційних точок, геометрії шару сорбенту, параметрів дифузії тощо. Лінійна ізотерма – концентраційні точки рухаються з однаковою швидкістю – так званий стаціонарний фронт без деформації; у випадку опуклої ізотерми – відбувається поступове загострення фронту; при ввігнутій – фронт сорбції розмивається. Кінетика сорбційного процесу Головна задача вивчення кінетики сорбційного процесу - знаходження ступеня перетворення сорбенту з початкової іонної форми (н-д, Н) у кінцеву форму (Na) як функції часу. В початковий момент 0 сорбент містить Н+-іони, розчин – Na+-іони. В момент 1 – частина іонів Na обмінюється з Н сорбенту, в момент 2 – ще більша частина іонів міняється місцями. В момент часу 3 – в сорбенті нема іонів Н+ для обміну – розчин проходить сорбент без змін. Процес обміну іонів є чисто дифузійним: з сорбенту, який містить на початку процесу тільки іони 1, останні дифундують в розчин, який містить тільки іони 2, які в свою чергу дифундують в сорбент. Взаємодифузія іонів 1 та 2 призводить до встановлення рівноваги між сорбентом та розчином. За теорією Нернста при розгляданні процесу дифузії іонів до поверхні прийнято вводити поняття ефективного нерухомого дифузійного шару (плівка Нернста)[4], в якому існує перенос речовини винятково за рахунок дифузії; поза цим шаром відбувається постійне перемішування і концентрація постійна. Численні досліди показали, що товщина дифузійного шару – плівки - залежить від характеру перемішування розчину (турбулентне, ламінарне):
За даними Гельферіха: δ=10-2÷10-3 см.
1 та 5, 2 та 4 стадії мають дифузійний характер (дифузійний перенос речовини, обумовлений вирівнюванням його концентрації в початковій неоднорідній системі; закони Фіка); 3-я стадія характеризує чисто хімічну кінетику (швидкість хімічної реакції). Броунівський рух та дифузія [5] Повздовжня дифузія - звичайний турбулентний процес переносу речовини уздовж шару сорбенту – не впливає на загальну швидкість процесу. Зовнішня дифузія (стадії 1 і 5) - дифузія речовини до зерна сорбенту крізь плівку, що оточує зерно, швидкість сорбції в якій визначається товщиною плівки. У випадку внутрішньодифузійної кінетики (стадії 2 і 4), тобто дифузія речовини всередині зерна, швидкість визначається специфікою структури та діаметром зерна сорбенту. Дифузія в сорбенті завжди повільніша ніж у розчині в зв'язку наявністю бар'єрів, створених матрицею сорбенту. Коли швидкості взаємодифузії будуть приблизно рівними, кінетика є змішаною. Швидкість багатостадійного процесу визначається швидкістю самої повільної стадії. Для реалізації акту сорбції необхідно підвести сорбуєму речовину з розчину до активної групи сорбенту, а після сорбції ця речовина повинна продифундувати вглиб, для того щоб звільнити поверхню для нових часток сорбуємої речовини. Сам акт сорбції можна вважати миттєвим. За звичних умов, тобто при помірному перемішуванні для середне- і сильно набухаю чого сорбенту, дифузія через плівку - плівкова дифузія (дифузія іонів по розчину до поверхні зерна та через нерухому граничну плівку рідини у поверхні зерна) є самою повільною стадією для розчинів з концентрацією 0,001 н або нижче. При концентрації розчину вище 0,1н такою стадією є дифузія іонів в зерні – гелева кінетика). В розчинах 0,001-0,1 н в якості лімітуючих процесів можуть проявлятися як дифузія крізь нерухому плівку, так і дифузія в зерні. Динаміка сорбційного процесу Теорія динаміки сорбції вивчається для систем, в яких одна фаза (н-д, розчин) рухається, інша фаза (сорбент) - нерухома. Завдяки різній спроможності компонентів до перерозподілу між фазами, різні компоненти розчину сорбуються (поглинаються) різними шарами сорбенту, як наслідок з'являється можливість їх розділення. Н-д, через шар сорбенту пропускають розчин з іонами А,В. Внаслідок різних властивостей іонів, вони можуть розділитись в шарі сорбенту.
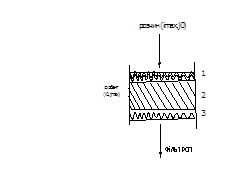
Динамічний дослід та розділення компонентів А та В в шарі сорбенту Механізм динамічної сорбції. Якщо сорбція відбувається в динамічних умовах, розчин, що обробляється, проходить крізь шар сорбенту. На початку розчин та сорбент мають в складі різні іони. Починається пропускання розчину крізь сорбент. При цьому в верхньому шарі сорбенту розчин містить найбільшу концентрацію іонів, які будуть поглинатися (i=max), а сорбент – найменшу(i=0). З часом сорбент в цій частині вичерпується і процес сорбції зрушиться далі вздовж шару. Очевидно, що концентрації видаляємих компонентів будуть різні в різні моменти часу і на різних ділянках шару сорбенту. Для наочності в сорбенті можна виділити 3 ділянки: відпрацьована (1), робоча (2) та ще не працююча (3). В різні моменти часу – картина різна.
В певний момент часу зона початкової концентрації видаляємих компонентів досягне нижньої межі шару та відбувається проскок. Це є сигналом про закінчення процесу сорбції (відключення на регенерацію). До цього часу ємність сорбенту відпрацьована не повністю; на ступінь її використання впливає ширина робочої ділянки. Розподілення концентрацій на цій ділянці називається фронтом фільтрування або концентраційним фронтом.
Протікання через шар сорбенту нерівномірне (три ділянки в сорбенті) При лабораторних дослідженнях динаміки можна визначати: 1) ефективність застосування різних сорбентів при однакових динамічних умовах 2) мінімальний час контакту, необхідний для забезпечення заданої якості фільтрату 3) втрати натиску при різних висотах шару сорбенту та швидкості потоку 4) норми витрати води на відмивку та розпушування сорбенту 5) кількість сорбенту, яка визначає продуктивність установки по регенерації 6) необхідну ступінь очищення вихідного розчину чи води 7) вплив на сорбцію напрямку потоку оброблюваної води та регенерату відносно сорбенту Переваги та недоліки динамічного методу проведення сорбційних процесів в порівнянні зі статичним методом Перехід від статичного до динамічного методу дає такі переваги: 1) можливість кількісно видаляти компоненти з вихідного розчину (води) (зміщення рівноваги) 2) повне видалення продуктів реакції потоком розчину. Саме тому в динамічних умовах відбувається іонообмінне зм'якшення, знесолення води, уловлювання цінних відходів з збросних вод тощо 3) можливість глибокої очистки розчину від домішок внаслідок послідовного контакту розчину зі свіжими невідпрацьованими шарами сорбенту, 4) практично повне використання ємності сорбенту. Недоліками динамічного методу при певних умовах є 1) недосягання рівноваги (тобто неповне використання ємності сорбенту) 2) проходження розчину без змін крізь сорбент, який ще не відпрацьований 3) можливість проскоку підвищеної концентрації іону у фільтрат. 4) необхідність встановлення більше одного апарату одного призначення (в технології процес не можна зупиняти).
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 189; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.200.180 (0.011 с.) |
 :
: 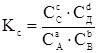 .
.  ;
; 
 .
. , n=0,3-0,7.
, n=0,3-0,7. Зерно сорбенту з плівкою
Зерно сорбенту з плівкою
 Зерно з плівкою та стадії сорбційного процесу
Зерно з плівкою та стадії сорбційного процесу