
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Суть процесу іонного обміну (і/о). Умови протікання. Рівняння і/о. Визначення іонітів.
“Речовини не взаємодіють, якщо не знаходяться в рідкому або розчиненому стані”. Одне з явищ, не підпорядковане цьому правилу хіміків - і/о. В даному випадку тверда речовина – іоніт - реагує з розчином і поглинає з нього одні іони в обмін на інші. В самому загальному змістіі/о - процес обміну (перерозподілу) іонами між різноманітними електролітами, простими і за участю складних молекул або структурних сполук, агрегованих і колоїдних часток. З і/о пов'язані процеси за участю мил, ПАР, барвників, біополімерів, нуклеїнових кислот та інш. В більш вузькому розумінніі/о - обмін іонами, що утворюються при дисоціації електролітів, між фазами гетерогенної системи (min2), одна з яких – розчин, що обробляється, а інша - тверда - має особливі властивості і називається іонітом. І/о має деякі подібності з адсорбцією: також як і при адсорбції, при і/о тверде тіло поглинає розчинену речовину - механізм і стадії збігаються (1. потенціалутворюючі іони 2. утворення іонної атмосфери 3. обмін протиіонами з розчином). Розходження в тому, що і/о представляє собою стехіометричне заміщення: в обмін на кожний еквівалент одного іона, який поглинається з розчину, іоніт віддає в розчин один еквівалент іншого іону з зарядом того ж знака. При молекулярній адсорбції (см. вище) адсорбент поглинає речовину, не виділяючи в розчин ніякої іншої речовини (наприклад, активоване вугілля). Хоча розходження і здається чітким, на практиці часто важко провести розрізнення. Неправильно називати і/о - хімічним процесом, а адсорбцію - фізичним. В процесі і/о хімічні сили грають іноді меншу роль, ніж при адсорбції. Цим можна пояснити, наприклад, що теплові ефекти і/о реакцій незначні (4000 Дж/моль). Розподіл іонів і молекул в процесі і/о можна уподібнити процесу взаємного змішування двох електролітів. При цьому іоніт розглядається як висококонцентрований поліелектроліт, а матриця іоніту з фіксованими (закріпленими) іонами - як полііон, який має підвищений хімічний зв'язок до визначених протиіонів, що дозволяє їм скласти окрему фазу системи. Відмінність від простого змішування електролітів у тому, що іоніт обмінюється з розчином тільки протиіонами в пропорційній кількості, в той час як фіксовані іони залишаються в іоніті.
Кислоти, основи і солі є електролітами. Аналогічно іоніти теж називають електролітами, точніше – поліелектролітамі, підкреслюючи приставкою “полі” численність іонів, утворюваних однією частинкою іоніту при дисоціації у воді. Механізм і/о Основною причиною процесу обміну протиіонами між іонітом і розчином є різниця концентрацій протиіонів. Протиіони іоніту прагнуть в розчин, оскільки на початку контакту цих іонів в розчині немає. Проте переходу в розчин іонів іоніту протидіє необхідність збереження електронейтральності. Інші іони того ж знаку з розчину прагнуть проникнути у фазу іоніту, оскільки спочатку концентрація цих іонів у фазі іоніту була рівна нулю. Цей стан приводить до вирівнювання концентрацій, тобто до обміну іонів при непорушності принципу електронейтральності. І/о можливий завдяки наявністю в каркасі іоніту активних (полярних) груп з позитивним чи негативними зарядом, які забезпечують реакційну здатність іонітів. Активна група пов’язана іонною силою з рухомими іонами, здатними до обміну. Активні групи мають гідрофільний характер. Сухий іоніт при контакті з водою набухає; при цьому відбувається дисоціація активної групи на рухомі та малорухомі іони, іонні сили між якими послаблюються. При контакті набухлого іоніту з водним розчином електроліту відбувається подальша іонізація активної групи та саме процес і/о.
Як для будь-якого хімічного процесу, для реакцій і/о може бути записане рівняння хімічної реакції. Для цього треба знати хімічні формули речовин, що беруть участь в обміні. Основні труднощі при цьому - опис хімічної формулою речовини, що утворює фазу іоніту. Припускають, що іоніт в цілому можна розглядати як об'єднання однакових по властивостях, усереднених високомолекулярних фрагментів, що містять один тип закріплених іонів - фіксовані (зневажаючи неоднорідність фази іоніту) - позначають його R і приписують йому заряд ZR. Також в іоніті є протиіони - рухомі іони А з зарядом ZA спроможні до обміну. Формула іоніту Гетерогенний і/о протиіону А з зарядом ZА (з іоніту) на іон В з зарядом ZВ (з розчину) описується рівнянням:
В технології водопідготовки для видалення визначених іонів із води застосовуються два процеси: катіонування - видалення катіонів і аніонування - видалення аніонів. В залежності від обмінного іону процеси називають Н - катіонування, Н-катіонітний фільтр, ОН-аніонування, ОН – аніонітний фільтр, відповідні солеві форми.
Регенерацію Na+ - катіонітних фільтрів проводять 6 – 8% водним розчином куховарської солі (NaCl) Регенерація Н+ - катіонітних фільтрів (у системі Н+ - Na+) здійснюється 1,5 – 2 % водним розчином H2SO4 (найдешевша); більш концентровані розчини можуть привести до гіпсування завантаження фільтрів унаслідок відкладення кристалів CaSО4. Можна застосувати 3-5 % розчини НСl (коштовна). Попередження випадання гіпсу - дозування до 300 г/м3 гексаметафосфату натрію або попередньо розчином солі, далі соляною кислотою Аніонітні фільтри регенерують розбавленими 5-8 % розчинами основ. Окремо АЕС (HNO3). Якщо обмін у системі іоніт-розчин протікає за участю декількох, наприклад, n-сортів протиіонів, то для його опису достатньо (n-1) незалежних стехіометричних рівнянь, аналогічних попереднім.
Умови ефективного застосування і/о у водопідготовці: 1) якість поступаючої на і/о фільтри попередньо очищеної води: · вода не повинна містити більше 1-3 мг/л зважених речовин (взважені речовини оточують зерно іоніту, проникають всередину, блокують обмінні центри, збільшують втрати тиск та зменшують продуктивність фільтрів) · 500-600 мг/л загальний солевміст · жорсткість не більше 5…6 мг-екв/дм3 · кольоровість не більше 30 град. · мутність (SiO2) 2-5 мг/л · 6-10 мг/л органічних речовин (1,5-2,5 мгО2/дм3) · вміст заліза перед Na-фільтрами не більше 0,3(0,1) мг/л, перед Н-фільтрами - не більше 0,5(0,3) мг/л (колоїдна форма заліза діє як зважені речовини, розчинене залізо при зм'якшенні краще поглинається ніж кальцій та магній та гірше видаляється при регенерації, гумати – поглинаються аніонітними фільтрами та погано відмиваються) · вміст марганцю не більше 0,1 мг/л · температура води повинна бути до 30-60 оС. 2) постійно високий перепад концентрацій в розчині та іоніті 3) правильно підібрана швидкість пропускання розчину (ХВО 10...30 м/год, БЗУ – до 100 м/год – різні концентрації домішок у природній воді та конденсаті) 4) добре розподілення обробленого розчину – велика поверхня розділу 5) висока якість іонітів з заданими властивостями 6) іоніт повинен на початку набухнути. Для цього його занурюють попередньо в спеціальний розчин (дистильовану воду або розчин NaCl), в якому витримують на протязі певного часу.
Н-д, метод очищення води – зворотний осмос має такі переваги порівняно з і/о: - видаляє не тільки солі жорсткості, але всі іони і недисоційовані молекули - видаляє розчинені органічні речовини - не вимагає великої кількості хім. реагентів - мінімальна участь обслуговуючого персоналу, мінімальна вірогідність збоїв, що викликаються «людським чинником» - екологічність, відсутність великої кількості кислотних і лужних стоків. Оценочное сравнение методов обессоливания по трем уровням: минимальный (Мин.), максимальный (Макс.) и средний (Ср.)
Закономірності процесу і/о 1) еквівалентність, тобто дотриманням певних масових співвідношень між реагуючими речовинами (стехіометричних співвідношень), 2) оборотність, тобто реакція іонного обміну є обратимою; 3) переважна адсорбція одних іонів в порівнянні з іншими, тобто селективність.
Фактори, які впливають на протікання і/о: 1) властивості води - роль рН. В загальному випадку зі зростанням рН обмінна ємність катіонітів зростає, а аніонітів прямолінійно знижується; - властивості обмінних іоні в (валентний радіус, об’єм, ступінь гідратації). При низьких концентраціях та звичайній температурі повнота обміну зростає зі збільшенням валентності обмінного іону. При низьких концентраціях, звичайній температурі та постійній валентності повнота обміну зростає зі збільшенням атомного номера обмінного іону; - залежність від розбавляння. При обміні рівновалентних іонів обмінна здатність не змінюється з розбавлянням. При обміні різновалентних іонів поглинання іонів з більшою валентністю збільшується по мірі розбавляння розчину, а з меншою валентністю – зменшується. 2) структура іонітів (проникність, розмір зерен). Форма та доступність пустих об’ємів всередині зерна впливає на рухомість іонів. 3) зовнішні фактори - вплив температури незначний на встановлення іонообмінної рівноваги. - зовнішній тиск практично не впливає на протікання та швидкість іонного обміну - вплив часу проявляється у витраті часу на протікання елементарних реакцій.
Іоніти - це спеціальні технологічні матеріали, речовини або сукупність речовин, що мають такі властивості: 1) утворюють окрему нерозчинну фазу гетерогенної системи, яка складається мінімум з двох різновидів іонів. Нерозчинність іонітів обумовлена громіздкістю структури певних іонів одного знаку заряду, що складають тверду фазу іоніту; 2) хоча б одна з утворюючих цю фазу речовин здатна дисоціювати на іони; 3) дисоціація іонітів ступінчаста та характеризується утворенням іонної атмосфери, яка складається з рухомих іонів одного знаку, які оточують протилежно заряджену тверду фазу. На властивості іонної атмосфери впливає концентрація зовнішнього розчину: в дистиляті вона неміцно пов’язана з зерном іоніту, поступово ущільнюючись навколо твердої фази при зростанні концентрації розчину. 4) іоніти здатні до гідролізу та набухання: катіоніти 5) принаймні, одна з різновидів іонів в іоніті міститься тільки у фазі іоніту, не може її покинути і перейти межу поділу фаз. Ці іони називають фіксованими або закріпленими на матриці чи каркасі іонами функціональних груп (потенціалутворюючі іони). У сильних катіонітів група –SO3, у слабких група -СОО; Якщо введені в матрицю іоногенні групи мають структуру і функцію основ (-N; =NH; -NH2; -NR3+ і т.п.), то такий іоніт називають аніонітом
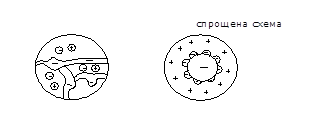
6) фаза іоніту є електронейтральною та в умовах рівноваги не містить вільного електричного заряду; 7) за зазначеною в п.6 причині, поряд із фіксованими іонами іоніт містить еквівалентну їм по заряду кількість іонів протилежного знаку - протиіонів або обмінних іонів (іони дифузійного шару). Протиіони переходять з іоніту в розчин крізь межу поділу фаз в обмін на еквівалентну кількість іонів того ж знаку заряду; 8) при поглинанні електроліту з розчину разом з протиіонами в іоніт проникає еквівалентна кількість рухомих іонів того ж знаку, що і заряд фіксованих іонів. Їх називають коіонами. 9) Найважливішою властивістю іонітів слід вважати їх здатність до регенерації, тобто до перетворення в початкову форму тих же зерен завантаження фільтру після поглинання ними солей з води, що очищається, в результаті промивки відпрацьованих іонітів приблизно 5 – 6% - мі розчинами кислот (для катіонітов) або лугів (для аніонітов). Саме ця властивість дозволяє багато разів, навіть протягом декількох років, використовувати завантаження іонітів. Кількість природних втрат при перевантаженнях і розпушуваннях іонітів складає від 3 до 10% річних. 10) всередині іонітів діють хімічні зв’язки (на відміну від поверхневих сил тяжіння) 11) іоніти характеризуються пористою структурою та великою внутрішньою поверхнею. Іоніт для наочності (якісно!) можна уявити у вигляді губки, у порах якої циркулюють протиіони. Якщо губка занурена в розчин, то протиіони можуть перейти в розчин, але для дотримання електричної нейтральності замість них з розчину повинні потрапити інші іони, що компенсують заряд. Схема структури катіоніту Спрощена схема
твердий багатоатомний каркас, пов’язані з каркасом нерухомі іони активних груп обмежено рухомі іони активних груп, здатні до обміну Тривимірна просторова сітка іоніту представляє собою неактивну матрицю, із якою пов'язані полярні групи. Останні і забезпечують реакційну спроможність іоніту. При контакті іоніту з водою відбувається гідратація полярних груп, і як результат - набухання. Проникнення води у фазу іоніту викликає дисоціацію полярних груп. Завдяки цьому рухомі іони одержують можливість переміщення від однієї групи до іншої у всьому обсязі.
З погляду термодинаміки іоніти – це частково закриті системи, що обмінюються з зовнішнім середовищем лише деякими зі своїх складових. З погляду фізичної хімії іоніти – полівалентні високомолекулярні з’єднання трьохмірної структури, особливий клас електролітів. Катіоніти можна вважати твердими, нерозчинними у воді полівалентними кислотами (або їх солями), а аніоніти - твердими нерозчинними у воді полівалентними лугами (основами). З погляду хімії полімерів іоніти - полімерні електроліти, частіше усього є зшитими студенями з тривкою структурою. Параметри, що впливають на утворення студнів – концентрація колоїдів, температура, зміст розчинника, явище синерезису. Н-д, SiO2- неорганічний іоніт, висушений студінь; також желатина, каучук, глини.
Основне завдання технології – пошук достатньо дешевих та ефективних іонітів. Типи іонітів Класифікація іонітів проводиться за різними показниками Виробники не завжди вказують хімічну структуру іонітів, тому при виборі для певної мети необхідно виключити припущення, що іоніти ідентичні через загальні характеристики. Розподіл іонітів проводять за такими ознаками:
за природою матриці (основи) - на мінеральні та органічні (природного і штучного походження); 1) за зовнішньою формою та ступенем дисперсності - на порошкоподібні, зернисті (правильної і неправильної форми), гранульовані, формовані і волокнисті; 2) за гранулометричним складом – на іоніти звичайного складу та моносферні. 3) за складом матриці – стирольні та акрилові 4) за методом одержання (полімерній основі) - на полімерізаційні і поліконденсаційні; 5) за структурою матриці - на гелеві і пористі; 6) в залежності від знака заряду протиіонів розрізняють монофункціональні іоніти (катіоніти, аніоніти) та поліфункціональні іоніти (амфоліти); 7) по природі протиіонів - розрізняють різні іонні форми іонітів; 8) за типом функціональних груп - на сильно-, середньо- та слабкоіонізовані; 9) за галуззю застосування – на іоніти промислової категорії та ядерного класу 10) за напрямком регенерації – іоніти для прямотоку та протитоку 11) за специфічністю дії – на органопоглиначі, інертні полімери.
1) За природою матриці (хімічною основою) іоніти поділяють на мінеральні та органічні, які можуть бути природними і штучно (синтетично) отриманими. До природних мінеральних катіонітів відносять різноманітні кристалічні силікати: піски, цеоліти, глинисті матеріали (каолініт, монтморилоніт, вермикуліт), польові шпати та інш. Єдиним природним мінеральним аніонітом, що застосовується в практиці, є апатит. Найбільш цікавими з природних матеріалів є цеоліти (інша назва “ молекулярні сита ” – в зв'язку з розгалуженою системою каналів) - алюмосилікати лужних і лужноземельних металів, в родовищах вміст власне цеолітів складає 80-90 %. Зараз відомо близько 600 цеолітів (близько 50 природних), що часто не мають природних аналогів. Загальна формула цеолітів: Індекс Ме відноситься до лужних або лужноземельних металів Na, K, Ca, рідше Sr, Ba, Mg з валентністю відповідного катіона, н-д анальцим
Звичайно цеоліти безбарвні або білого кольору. Блиск скляний. Розрізняють цеоліти, що характеризуються мікропорами малих (0,3-0,45 нм, А), середніх (0,55 нм, пентасили), великих (0,75 нм, фожазіти, b - 0,64-0,76 нм) і екстравеликих (>0,8 нм, морденіт) розмірів. Недавно синтезовані мезопористі цеоліти: VPI-5 - 1,2 нм і MCM-41 - 1,2-1,5 нм. Загальним для цеолітів є те, що вони мають правильну просторову 3-х мірну сітчасту структуру з порівняно великими відстанями між вузлами решітки (до 0,7 нм). Вони складаються з тетраедрів, утворених з атома кременя і 4 атомів кисню. Фрагмент плаского зрізу решітки: частина іонів 4-х валентного Si заміщена іонами 3-х валентного Al).
Одна надлишкова негативна валентність відшкодовується рухливими обмінними катіонами, які розміщуються в порожнинах і каналах та при контакті з розчином можуть перейти в нього. Наприклад: якщо в каркасі є утримувані іони Na+, то вони спроможні до обміну на Ca2+, що використовувалося раніше для зм'якшення води.
Фрагмент плоского зрізу кристалічної решітки (AlO3 замінює SiO4). Тетраедрична структура.
Деякі цеоліти виявляють високу селективність до іону цезію і використовуються в атомній промисловості як поглиначі радіоактивного цезію (кліноптилоліт); деякі, наприклад, цеоліт 4А застосовується замість поліфосфатів у миючих речовинах, насамперед через свою селективність до іонів, мілкодисперсності і більш сприятливі для навколишнього середовища. Цеоліти характеризуються 1) здатністю ефективно і селективно видаляти різні іони з розчинів 2) забезпечувати їх концентрування 3) значною сорбційною здатністю за парами води 4) зберіганням досить високої активності за цілевим компонентам при високих температурах (до 150-250 оС) 5) одночасною біологічною активністю, кислототривкістю і унікальним поєднанням пролонгуючих адсорбційних, катіонообмінних, каталітичних і детоксикаційних властивостей. Але в порівнянні з іншими промисловими адсорбентами мають відносно невеликий об’єм адсорбційних полостей, внаслідок чого характеризуються невеликими величинами адсорбції (ємності). Ці властивості дозволили широко і ефективно застосовувати цеоліти в сільському господарстві, промисловості, медицині, екології і інших сферах діяльності людини. Родовища природних цеолітів вперше відкриті в 60-х роках в США і Японії, де споживається більш 2-х мільйонів тонн в рік різноманітної цеолітової продукції. Ресурси цеолітової сировини в Росії оцінюються мільярдами тонн, а споживається не більш 250 тисяч тонн в рік, в основному, в сільському господарстві. У Красноярському краю на Сахаптинському родовищі готуються до промислової розробки 5 млн. тонн цеолітового сировини клінопгилоліт-гейландітового складу. Приблизно 40 років тому в промислових лабораторіях США, СРСР і Великобританії були одержані синтетичні цеоліти: А, X і У, а потім пентасили (ZSM-5, ультрасил) і багато інших. Тут позначення А, X і У - умовні марки фірми Лінді, ZSM-5 - цеоліт (Z) фірми Соконі (S) Мобіл (M) 5-й модифікації, а ультрасил - марка ГрозНІІ. Кожне позначення відповідає певному типу кристалічної структури.
“Відбілюючі землі” – природні сорбенти – горні породи: відбіліюючі глини, діатоміт, опока, трепел, боксити. Застосовують в якості поглиначів жирів, масел, смол та інших забруднюючих та шкідливих домішок при очищенні води, нафти, масел, вин, соків. На сучасних станціях з водоочистки активно застосовують кварц та альбітофір. Кварц має низькі сорбційні властивості по відношенню до важких металів, а альбітофір характеризується дуже складним та непостійним складом. Процес вилучення домішок на кварці протікає за схемою: домішка осаджувалась спочатку на поверхні кварцу потім – на раніше осаджену домішку, тобто поверхня кварцу відігравала роль механічного фільтру, утримуючи осад, що пояснює невеликі значення сорбційної ємності. Природні кальцій-магнієві мінерали силікатних та карбонатних порід мають значну близькість до катіонів важких металів, низьку собівартість, розвинуту поверхню та широке поширення в природі. Фазовий склад природних мінеральних іонітів
До штучних мінеральних іонітів відносять нерозчинні неорганічні з'єднання, що мають іонообмінні властивості: оксиди і гідроксиди Al, Zn, Fe,Ti та інш., сульфіди Me2S, фосфати та інш. нерозчинні солі, бітумні сорбенти. Сюди ж відноситься група синтезованих силікагелів, цеолітів і пермутитів. Найбільш цікавий для зм'якшення води – фосфат цирконію ZrPO4 в силу підвищеної кислотності функціональних груп, термічної, радіаційної та хімічної стійкості, селективності до Cs, Be, Pb, U та інш. Складнощі – в отриманні гранульованого матеріалу з добрими кінетичними властивостями. Сучасний матеріал - напівсинтетичний мікропористий сорбент (ПСМС) на основі монтморіллоніту та основних солей алюмінію (коагулянту сульфату алюмінію). Розвинута поверхня, мікро- та мезопори в структурі робить його перспективним для видалення речовин з невеликою молекулярною масою (фенол, діоксини) та молекул або органічних іонів з великою масою (барвники).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 324; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.104.29 (0.104 с.) |

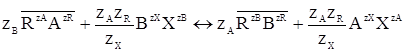






 - у фільтраті утворюються розчинні основи, а тверда фаза катіоніту збагачується іонами водню; аніоніти
- у фільтраті утворюються розчинні основи, а тверда фаза катіоніту збагачується іонами водню; аніоніти  - у фільтраті утворюється деяка кількість кислоти. Ступінь гідролізу залежить від концентрації обмінних іонів, їх основності чи кислотності, кислотності чи основності радикалу R;
- у фільтраті утворюється деяка кількість кислоти. Ступінь гідролізу залежить від концентрації обмінних іонів, їх основності чи кислотності, кислотності чи основності радикалу R;

 Х Х
Х Х




 ,
,  .[Alx+2ySizO2x+4y+2z]·nH2O, де M и D - одно- и двовалентні катіони відповідно.
.[Alx+2ySizO2x+4y+2z]·nH2O, де M и D - одно- и двовалентні катіони відповідно. ; шабазит
; шабазит  .
.






