Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Укладач: Дорож О.А., доцент кафедри ТВПСтр 1 из 16Следующая ⇒
Конспект лекцій з курсу “Теорія сорбційних та мембранних процесів на електростанціях” для студентів спеціальностей 7.05060104, 8.05060104 Технологія теплоносіїв та палива на теплових електростанціях - 7.05060302, 8.05060302 Технологія теплоносіїв та поводження з радіоактивними відходами на атомних електростанціях
Укладач: Дорож О.А., доцент кафедри ТВП Зміст Введення........................................................................................................................................ 3 Програма курсу. Основні розділи. Література................................................................... 3 Порівняння іонного обміну та зворотного осмосу:............................................................ 4 Розділ 1. Теоретичні основи та застосування сорбційних та мембранних процесів на електростанціях 8 1.1. Загальні поняття про сорбцію та сорбційні процеси.................................................. 8 1.2. Механізм сорбції.............................................................................................................. 11 1.3 Закономірності протікання сорбційних процесів....................................................... 13 1.4 Концентраційний фронт та вихідна крива як характеристики сорбційного процесу 17 1.5 Сорбційні апарати. Класифікація та принципи функціонування.......................... 19 1.6 Теорія та практика мембранних процесів................................................................... 22 Розділ 2. Фізико-хімічні основи іонного обміну. Сучасні іонообмінні матеріали (іоніти), які використовуються у водопідготовці.............................................................................................. 23 2.1. Загальні поняття про іонний обмін та іоніти............................................................. 23 2.2 Типи іонітів........................................................................................................................ 30 2.3 Реакції і/о з врахуванням типу іоніту........................................................................... 47 2.4 Фізико-хімічні і технологічні властивості іонітів....................................................... 50 2.5. Промислове використання іонітів. Екологічний аспект і/о.................................... 65 2.6 Проблеми експлуатації та очищення забруднених іонітів........................................ 71 2.7 Основні вимоги до іонітів на АЕС, особливості експлуатації та знешкодження. 77 Розділ 3. Основи мембранних процесів........................................................................................ 85 Зворотний осмос та ультрафільтрація мають подібності (матеріал мембран) та відмінності (діаметр пор в мембранах, тому різний механізм процесів). Осмос............................................................... 85
Осмотическое давление.............................................................................................................. 86
Введення. Мембранні процеси
Розділ 1. Теоретичні основи та застосування сорбційних та мембранних процесів на електростанціях Загальні поняття про сорбцію та сорбційні процеси. Механізм сорбції. Сорбційні процеси є основою ряду технологічних процесів: і/обм. очищення води (РТ), деаерація (ГР), декарбонізація (ГТ), рекарбонізація (РГ), винесення речовини з пари (ГТ), тощо. З численних варіантів апаратно-технологічного оформлення в умовах ЕС сорбційні процеси частіше реалізуються в умовах спрямованого переміщення фаз щодо одна одної (динамічне пропускання обробляємої рідкої суміші (розчину) крізь нерухомий шар твердої фази (сорбент).
Частка твердої фази, на якій відбулася адсорбція іонів з розчину 1) іони дифузійного шару біля поверхні 2) іони дифузійного шару всередині рідини
Для цих умов схематично механізм сорбції часток з розчину електроліту можна розглянути як адсорбцію окремих іонів, що відбувається на межі розподілу «розчин - поверхня твердої фази». Важливою та необхідною характеристикою є здатність обох фаз до дисоціації (тобто розкладання на іони). Просторово процес взаємодії починається з контакту двох фаз та молекулярної або хімічної взаємодії на межі поділу фаз. Атоми, молекули або іони, які знаходяться на межі, завдяки ненасиченості їх міжмолекулярних або хімічних зв'язків мають підвищену активність. При адсорбції іонів одного знаку, поверхня приймає заряд цих іонів, а розчин біля неї - протилежний за знаком внаслідок надлишку іонів, протилежних за знаком сорбованим іонам. Це створює різницю потенціалів між розчином і поверхнею і, як наслідок, обумовлює тяжіння поверхнею іонів протилежного знаку заряду з розчину. При цьому на іони, що знаходяться в розчині, діють такі сили: 1) сила електростатичного тяжіння з боку твердої фази, 2) дифузійні сили, під дією яких ці іони можуть рівномірно розподілятися по всьому об'ємі розчину. Дія цих сил призводить до утворення навколо твердої фази дифузійного шару іонів або іонної атмосфери, в якому концентрація іонів закономірно зменшується з віддаленням від поверхні твердої фази до меж розчину.
Іони дифузійного шару, що мають запас кінетичної енергії, можуть вириватися з іонної атмосфери і переходити в розчин, з якого у свою чергу внаслідок дифузії можуть надходити іони того ж знаку заряду в еквівалентних кількостях (зберігання принципу електронейтральності). Процес взаємодії фаз гетерогенної системи закінчується встановленням певного рівноважного розподілення обмінних іонів між фазами. Висновок. З вищенаведеного, механізм процесу адсорбції можна характеризувати трьома складовими моментами: 1. виникнення заряду в твердій фазі внаслідок появи на ній потенціалутворюючих іонів. Потенціалутворюючі іони з'являються на поверхні внаслідок процесу дисоціації полярних молекул твердої фази, н-д, під дією води і кріпляться до так званої матриці сорбенту 2. утворення іонної атмосфери з протилежно заряджених іонів біля твердої фази 3. заміна іонів, які утворюють іонну атмосферу, іонами того ж знаку з розчину. Іони, сорбовані поверхнею (на мал. +) називають потенціалутворюючими (фіксованими або анкерними іонами); іони, що утворюють іонну атмосферу (на мал. -) називають іонами дифузійного шару. В зв'язку з тим, що іони дифузійного шару протилежні за знаком фіксованим іонам, їх зазвичай називають протиіонами (-); іони в розчині, однойменні з зарядом фіксованих іонів називають коіонами (+). В залежності від характеру появи потенціалутворюючих іонів на поверхні твердої фази, при внесенні її в розчин м.б. різний ефект. 1) Спочатку тверду фазу, яка здатна адсорбувати потенціалутворюючі іони (+) вносять в розчин з + та – іонами. Процес адсорбції потенціалутворюючих іонів R+H+=(RH)+. Позитивно заряджена тверда фаза з + іонами буде притягувати – іони дифузійного шару (RH)++Cl-=(RH+/Cl-). Як наслідок – зменшення концентрації Н та Cl в розчині – молекулярна адсорбція. При наявності в розчині інших аніонів внаслідок дифузії відбудеться заміна. 2) Якщо в розчин електроліту внести тверду фазу, яка дисоціює з віддачею іонів тільки одного знаку заряду, в перший момент буде спостерігатись утворення іонної атмосфери з цих дисоціюючих іонів. Внаслідок дифузії відбудеться заміщення іонів дифузійного шару іонами з розчину. Н-д, тверда фаза – важкорозчинна кислота і при внесенні її в розчин утворюється дифузійний шар іонів Н+. Якщо катіони в розчині Na, то вони замістять іони Н. У водопідготовці виключне застосування мають саме процеси заміщення іонів дифузійного шару твердої фази іонами з розчину – прийнято називати такий процес сорбцією (а не молекулярною адсорбцією). Для процесу сорбції іонів з розчину в сорбент можна виділити та практично спостерігати три стадії: 1) доставка витиснювальних іонів з розчину на поверхню сорбенту 2) проникнення витиснювальних іонів всередину сорбенту 3) хімічна взаємодія іонів розчину з іонами сорбенту. Іноді говорять про 4 та 5 стадії: 4) пересування витисняємого іону з середини від точки обміну до поверхні сорбенту 5) переміщення витісняємого іону від поверхні сорбенту в розчин. Всі стадії протікають послідовно, з різними швидкостями та одночасно в різних місцях сорбенту.
Звертає увагу, що стадії 1 і 5, 2 і 4 є одно типовими (дифузійні), тобто передають різноманітне по напрямку, але не за характером пересування іонів, тому іноді обмежуються описом перших або останніх трьох стадій. 1-3 – робочий процес, 4-5 – регенерація. Пристінний ефект Неоднорідність структури зернистого шару обумовлює і неоднорідність в розподіленні швидкостей рідини. Протікання через зернистий шар представляє собою змішану задачу: потік рідини і обтікає зерна шару і проходить в каналах між ними. І локальні і інтегральні характеристики, пов'язані з пристіночними зонами (тобто областями, які лежать на відстані 1-2 діаметру зерна від стінки апарату) показали, що найбільш рихла структура формується біля стінки. Геометрія зернистого шару біля стінок апарату. Перераховані характеристики геометрії зернистого шару відносяться до середньої частини фільтруючого апарату, у якому дотримується умова однорідності. Експериментальні дослідження свідчать про те, що для шарів зернистого матеріалу, які примикають до стінки апарату, умова однорідності порушується, а порозність шару, розташованого в безпосередній близькості від стінки, приблизно в 1,3÷1,6 рази перевищує порозність всередині апарату. Збільшення частки вільного перерізу біля стінок приводить до створення нерівномірного поля швидкостей по перерізу апарату. Площа пристінних ділянок зростає пропорційно діаметру апарата, а його загальна площа пропорційна квадрату діаметра, як наслідок, вплив стінки можна зменшити збільшенням відношення: діаметр апарату/діаметр зерна. Розрахунок та досвід показують, що якщо діаметр апарату в 30÷50 разів більше діаметра зерна, то вплив пристінного ефекту на динаміку сорбційного досліду мінімальний. Загальні технологічні характеристики апаратів Апарати з щільним шаром сорбенту дозволяють реалізовувати високі навантаження, обробляти воду з високою концентрацією домішок, регулювати об’єм сорбенту регулюванням об'єму обробляє мого розчину. Апарати з розрідженим шаром дозволяють переробляти пульпи, легше інтенсифікувати процес масопереносу, лімітуємий зовнішньою дифузією, розріджений шар легше транспортується як в самому апараті, так і в ланцюжку апаратів. Недолік – важко організувати рівномірну подачу та вигрузку смоли, транспортування, рівномірне розподілення фаз за перерізом, невелика продуктивність, СВО.
Найбільш поширене фільтрування зверху вниз – дозволяє при відповідному тиску розчину досягати великих швидкостей фільтрування. Обмеження швидкості пов'язане з зростанням енергозатрат, руйнуванням смоли, зменшенням її РОЄ.
Регенерація сорбенту відбувається прямоточно чи протиточно. Експлуатація катіонітних фільтрів в режимі параллельнотока має ряд серйозних недоліків: - багатосходинковість у разі потреби глибокого зм'якшення води (до жорсткості 0,01 мг-екв/дм3); - значна витрата реагентів на регенерацію, яка перевищує стехіометрію в 2–3 рази; - утворення мінералізованих стічних вод, що становлять 10–30 % від продуктивності установки і що мають солевміст 3–10 г/л.
Протиточні технології: 1) з блокуванням потоком повітря або води 2) з робочим циклом у висхідному потоці (киплячий шар) Протиточна технологія в порівнянні з прямоточною дозволяє (переваги): · скоротити (в порівнянні з прямотоком) число встановлених фільтрів, арматури та трубопроводів в 2–2,5 рази; · знизити витрату хімічних реагентів на регенерацію іонітів в 1,5–2,5 рази; · зменшити потребу у воді на власні потреби ВПУ (нема спушування) та кількість скидних вод в 2–4 рази, зменшити собівартість очищеної води до 40 %; · зменшити вимоги до зміни швидкості фільтрування (нечутливість до коливань); · збільшити тривалість фільтроциклів іонітних фільтрів (оптимальне використання об'єму фільтру); · покращити якість знесоленої (зм'якшеної) води за рахунок використання високоякісних монодисперсних іонітів; · здійснюватися самоочищенню іоніту; · додатково видаляти зважені речовини. Назви систем: DOWEX UPCORE, Проблеми протитоку: – інтенсивність подачі регенераційного розчину та відмивочної води не повинна перевищувати 8...10 м/год для запобігання взважування іоніту в фільтрі. Це збільшує тривалість регенерації. Недолік компенсується кращим використанням регенераційного розчину та більш глибокою регенерацією шарів іоніту, які останніми контактують з освітлюваною водою, тобто визначають глибину її зм'якшення; – ускладнення конструкції фільтру (наявність додаткової розподільчої системи або інертного шару) – необхідність встановлення додаткових ємностей для регенерації, уловлювачів іонітів.
Типи іонітів Класифікація іонітів проводиться за різними показниками Виробники не завжди вказують хімічну структуру іонітів, тому при виборі для певної мети необхідно виключити припущення, що іоніти ідентичні через загальні характеристики. Розподіл іонітів проводять за такими ознаками:
за природою матриці (основи) - на мінеральні та органічні (природного і штучного походження); 1) за зовнішньою формою та ступенем дисперсності - на порошкоподібні, зернисті (правильної і неправильної форми), гранульовані, формовані і волокнисті; 2) за гранулометричним складом – на іоніти звичайного складу та моносферні. 3) за складом матриці – стирольні та акрилові
4) за методом одержання (полімерній основі) - на полімерізаційні і поліконденсаційні; 5) за структурою матриці - на гелеві і пористі; 6) в залежності від знака заряду протиіонів розрізняють монофункціональні іоніти (катіоніти, аніоніти) та поліфункціональні іоніти (амфоліти); 7) по природі протиіонів - розрізняють різні іонні форми іонітів; 8) за типом функціональних груп - на сильно-, середньо- та слабкоіонізовані; 9) за галуззю застосування – на іоніти промислової категорії та ядерного класу 10) за напрямком регенерації – іоніти для прямотоку та протитоку 11) за специфічністю дії – на органопоглиначі, інертні полімери.
1) За природою матриці (хімічною основою) іоніти поділяють на мінеральні та органічні, які можуть бути природними і штучно (синтетично) отриманими. До природних мінеральних катіонітів відносять різноманітні кристалічні силікати: піски, цеоліти, глинисті матеріали (каолініт, монтморилоніт, вермикуліт), польові шпати та інш. Єдиним природним мінеральним аніонітом, що застосовується в практиці, є апатит. Найбільш цікавими з природних матеріалів є цеоліти (інша назва “ молекулярні сита ” – в зв'язку з розгалуженою системою каналів) - алюмосилікати лужних і лужноземельних металів, в родовищах вміст власне цеолітів складає 80-90 %. Зараз відомо близько 600 цеолітів (близько 50 природних), що часто не мають природних аналогів. Загальна формула цеолітів: Індекс Ме відноситься до лужних або лужноземельних металів Na, K, Ca, рідше Sr, Ba, Mg з валентністю відповідного катіона, н-д анальцим
Звичайно цеоліти безбарвні або білого кольору. Блиск скляний. Розрізняють цеоліти, що характеризуються мікропорами малих (0,3-0,45 нм, А), середніх (0,55 нм, пентасили), великих (0,75 нм, фожазіти, b - 0,64-0,76 нм) і екстравеликих (>0,8 нм, морденіт) розмірів. Недавно синтезовані мезопористі цеоліти: VPI-5 - 1,2 нм і MCM-41 - 1,2-1,5 нм. Загальним для цеолітів є те, що вони мають правильну просторову 3-х мірну сітчасту структуру з порівняно великими відстанями між вузлами решітки (до 0,7 нм). Вони складаються з тетраедрів, утворених з атома кременя і 4 атомів кисню. Фрагмент плаского зрізу решітки: частина іонів 4-х валентного Si заміщена іонами 3-х валентного Al).
Одна надлишкова негативна валентність відшкодовується рухливими обмінними катіонами, які розміщуються в порожнинах і каналах та при контакті з розчином можуть перейти в нього. Наприклад: якщо в каркасі є утримувані іони Na+, то вони спроможні до обміну на Ca2+, що використовувалося раніше для зм'якшення води.
Фрагмент плоского зрізу кристалічної решітки (AlO3 замінює SiO4). Тетраедрична структура.
Деякі цеоліти виявляють високу селективність до іону цезію і використовуються в атомній промисловості як поглиначі радіоактивного цезію (кліноптилоліт); деякі, наприклад, цеоліт 4А застосовується замість поліфосфатів у миючих речовинах, насамперед через свою селективність до іонів, мілкодисперсності і більш сприятливі для навколишнього середовища. Цеоліти характеризуються 1) здатністю ефективно і селективно видаляти різні іони з розчинів 2) забезпечувати їх концентрування 3) значною сорбційною здатністю за парами води 4) зберіганням досить високої активності за цілевим компонентам при високих температурах (до 150-250 оС) 5) одночасною біологічною активністю, кислототривкістю і унікальним поєднанням пролонгуючих адсорбційних, катіонообмінних, каталітичних і детоксикаційних властивостей. Але в порівнянні з іншими промисловими адсорбентами мають відносно невеликий об’єм адсорбційних полостей, внаслідок чого характеризуються невеликими величинами адсорбції (ємності). Ці властивості дозволили широко і ефективно застосовувати цеоліти в сільському господарстві, промисловості, медицині, екології і інших сферах діяльності людини. Родовища природних цеолітів вперше відкриті в 60-х роках в США і Японії, де споживається більш 2-х мільйонів тонн в рік різноманітної цеолітової продукції. Ресурси цеолітової сировини в Росії оцінюються мільярдами тонн, а споживається не більш 250 тисяч тонн в рік, в основному, в сільському господарстві. У Красноярському краю на Сахаптинському родовищі готуються до промислової розробки 5 млн. тонн цеолітового сировини клінопгилоліт-гейландітового складу. Приблизно 40 років тому в промислових лабораторіях США, СРСР і Великобританії були одержані синтетичні цеоліти: А, X і У, а потім пентасили (ZSM-5, ультрасил) і багато інших. Тут позначення А, X і У - умовні марки фірми Лінді, ZSM-5 - цеоліт (Z) фірми Соконі (S) Мобіл (M) 5-й модифікації, а ультрасил - марка ГрозНІІ. Кожне позначення відповідає певному типу кристалічної структури.
“Відбілюючі землі” – природні сорбенти – горні породи: відбіліюючі глини, діатоміт, опока, трепел, боксити. Застосовують в якості поглиначів жирів, масел, смол та інших забруднюючих та шкідливих домішок при очищенні води, нафти, масел, вин, соків. На сучасних станціях з водоочистки активно застосовують кварц та альбітофір. Кварц має низькі сорбційні властивості по відношенню до важких металів, а альбітофір характеризується дуже складним та непостійним складом. Процес вилучення домішок на кварці протікає за схемою: домішка осаджувалась спочатку на поверхні кварцу потім – на раніше осаджену домішку, тобто поверхня кварцу відігравала роль механічного фільтру, утримуючи осад, що пояснює невеликі значення сорбційної ємності. Природні кальцій-магнієві мінерали силікатних та карбонатних порід мають значну близькість до катіонів важких металів, низьку собівартість, розвинуту поверхню та широке поширення в природі. Фазовий склад природних мінеральних іонітів
До штучних мінеральних іонітів відносять нерозчинні неорганічні з'єднання, що мають іонообмінні властивості: оксиди і гідроксиди Al, Zn, Fe,Ti та інш., сульфіди Me2S, фосфати та інш. нерозчинні солі, бітумні сорбенти. Сюди ж відноситься група синтезованих силікагелів, цеолітів і пермутитів. Найбільш цікавий для зм'якшення води – фосфат цирконію ZrPO4 в силу підвищеної кислотності функціональних груп, термічної, радіаційної та хімічної стійкості, селективності до Cs, Be, Pb, U та інш. Складнощі – в отриманні гранульованого матеріалу з добрими кінетичними властивостями. Сучасний матеріал - напівсинтетичний мікропористий сорбент (ПСМС) на основі монтморіллоніту та основних солей алюмінію (коагулянту сульфату алюмінію). Розвинута поверхня, мікро- та мезопори в структурі робить його перспективним для видалення речовин з невеликою молекулярною масою (фенол, діоксини) та молекул або органічних іонів з великою масою (барвники). Пористость Поры активных углей и других сорбентов подразделяются на:супермикропоры (r эфф < 0,6–0,7 нм); микропоры (0,6–0,7 нм < r эфф < 1,5–1,6 нм); мезопоры (1,5–1,6 < r эфф < 100–200 нм); макропоры (r эфф > 100–200 нм). Эффективный (эквивалентный) радиус поры r эфф равен удвоенному отношению площади нормального сечения поры к ее периметру. Значение удельной поверхности пор у лучших марок активных углей может достигать 1800–2200 м2 на г угля. адсорбционную способность АУ определяют, в основном, поры радиусом 0,5–1,6 нм, соизмеримым с радиусами адсорбируемых молекул. Поры радиусом менее 0,5 нм практически недоступны для молекул органических примесей, задержание которых – основная цель использования активного угля. Суммарный объем пор радиусом 0,5–1,6 нм равен приблизительно 0,15–0,50 см3/г.
Структуры активированных материалов: а – карбонизированная древесина; б – активированный каменный уголь; в – активированная скорлупа кокоса
Кокос – дуже твердий, ємкість за нафтою та органікою в 5 разів вище ніж у БАУ. Підвищення температури 30...90 оС, порошкоподібний, утворює пластівці, шлам стає легшим та флотується у освітлювачі. Регенерація – термічна реактивація. Більш широке поширення одержали універсальні органічні іоніти на синтетичній високополімерній основі. Самим великим класом є іонообмінні смоли. Іонообмінна смола є високополімером, що містить іоногенні групи, спроможні до реакцій і/о. Макромолекула такого іоніту складається з гнучких полімерних вуглеводневих[6] ланцюгів, скріплених поперечними зв'язками – „містками”. Тобто макромолекула - трьохмірна вуглеводна сітка, в окремих вузлах якої закріплені заряджені фіксовані іони, разом з протиіонами, що їх нейтралізують. З ланкою П лінійного ланцюга полімерної основи або ланкою Q агента, що зшиває (скріплює) ці ланцюги, пов'язаний фіксований катіон Ф, а рухомий аніон А - спроможний до заміщення будь-яким іншим аніоном.
Фрагмент структури аніонообмінної смоли: Подібну структуру можна уявити для катіонообмінної смоли (аніони будуть нейтралізовані спроможними до обміну катіонами)
2) За зовнішньою формою та степенем дисперсності Розмір часток іоніту є поступкою між швидкістю реакції обміну (яка більша для іоніту з невеличкими зернами) і швидкістю потоку розчину (великі частки зменшують гідравлічні втрати). Промислові і експериментальні зразки іонітів випускають переважно у вигляді сферичних гранул і зерен. Розміри від 0,3 до 2мм, більші - для спеціальних цілей. Виготовляють у вигляді і/обм. таблеток і трубок. Здрібнювання звичайних зерен або спеціальним синтезу одержують іоніти з розміром <0,1 мм (порошкоподібні). Крупнозернисті іоніти призначені для використання у фільтрах з шаром значної висоти 1-3 м, порошкоподібні – висотою 3-10 мм, тому використовують фільтри різних конструкцій: насипні та намивні. Застосування порошкоподібних смол – Ленінградська АЕС та Ігналінська АЕС. Нові намивні фільтри – на перфоровані трубки всередині фільтру намивають шар порошкоподібних іонітів, а зверху намивають шар целюлози для захисту від заліза., витрата до 800 т/год, втрати тиску 0,2 атм, швидкість фільтрування 2 м/год. В останні роки широке поширення знаходять і/обм. мембрани у вигляді еластичних листів товщиною 0,1…1 мм (електродіаліз). Для надання стійкості їх армують сіткою або спеціальною тканиною. Іонітні мембрани можуть бути вибірково проникливими тільки для протиіонів і практично непроникливі для коіонів. Електронна фотографія робочого шару мембрани
І/обм. волокна - найменша їх товщина складає декілька десятків мікрометрів) обумовлює їх високі кінетичні характеристики (очищення газів). Особливий клас і/обм. матеріалів - рідкі іоніти - розчини алкілфосфорних і карбонових кислот[7] (катіоніти) і аміни[8] в неполярних розчинниках - бензолі, керосині (аніоніти). 3) За гранулометричним складом – на іоніти звичайного складу та моносферні. Розмір часток іоніту впливає на перепад тиску у фільтрі: зі зменшенням часток перепад тиску в шарі збільшується. Подрібнення іоніту призводить до зростання опору шару та нерівномірному розподіленню потоку води по перерізу фільтра. Фракційний склад х арактеризується гранулометричним складом, який відображає процентний вміст часток заданого інтервалу розмірів. Оскільки реальні зернисті шари представляють собою суміш зерен різної крупності, то їх прийнято характеризувати гранулометричним складом у вигляді кривих розподілення часток завантаження за розмірами, що дозволяє визначити максимальний, мінімальний та еквівалентний діаметри зерен, значення яких впливають на вибір режиму промивки фільтруючого шару.
Типовий розподіл розмірів часток у звичайному іоніті описують розподіленням Гауса [9]. В зв'язку з тим, що об'єм фракції - це логарифмічна функція кількості зерен, то розподіл розмірів зерен також представляється прямою лінією у відповідних координатах і визначається: 1) середній діаметр - комірка сита, крізь яку проходять 50 % зерен 2) ефективний розмір - сито крізь яке проходить 90 % - найчастіше до 0,5 мм 3) коефіцієнт однорідності КО – відношення розміру сита, яке пропустило 40 % до розміру сита, яке пропустило 90 %. Чим ближче КО до 1, тим більше вузька крива Гауса, тим менше діапазон розмірів часток.
Гранулометричний аналіз Моносферні іоніти Позначення MonoPlus, UPS, Amberjet Полімеризація - реакція об'єднання молекул без виділення побічних продуктів. При виробництві і/о смол полімеризація звичайно відбувається при припиненні процесу. Мономірні краплі формуються у воді та при завершенні процесу стають твердими сферичними зернами. Традиційний метод: мономери вводяться в реактор-мішалку з рідиною - відбувається статичне формування полімерних крапельок (так зв. „перлинна” полімеризація. Формуються великі і малі гранули. Новий метод: динамічне формування крапельок - гранули смоли «ежектуються» через калібровані сопла труб (решітку, яка вібрує), розмір гранул однорідний. Зерна не злипаються поки піднімаються вверх в скляних колонах, твердіють. Потім видаляють мілкі частки та направляють на фунціоналізацію.
Переваги моносферних іонітів
Але застосовувати їх треба лише у випадках, коли це: – технологічно доцільно (зокрема, смоли такого типу, на відміну від звичайних, не видаляють колоїдні частки) – економічно доцільно (коштовні).
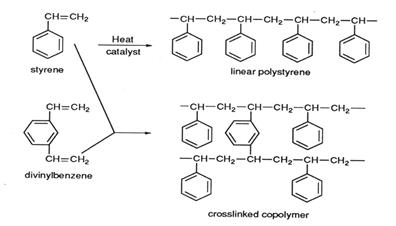
4) В залежності від складу матриці розрізняють іоніти стирольні та акрилові. Технічне значення в синтезі мають смоли, які мають в своєму складі Останні припускають можливість заміщення в них атомів водню різноманітними функціональними групами. Сам бензол не виявляє тенденції до таких реакцій, тому на практиці використовують похідні бензолу, що містять у бічних ланцюгах органічні радикальні групи, що вступають у ці реакції. Особливе значення для цих цілей набув вуглеводень стирол С6Н5СН=СН2: Стиролдівінілбензол – безкольорова рідина, в присутності стабілізатору допускається слабо-жовте забарвлення. Має специфічний запах.
Молекули стиролу, чіпляючись один за одного, утворюють лінійні молекули полістиролу (з’єднання n-молекул зі збільшеною в n разів молекулярною масою:
Полістирол – полімер ненасиченого вуглеводню – стиролу. Стирол отримують з продуктів сухої перегонки камінного вугілля або синтетичним шляхом з етилену та бензолу. Легко полімеризується при нагріванні або у водній емульсії в присутності каталізатору. Розчинний в бензолі, толуолі, частково – в ацетоні, нерозчинний у воді та мінеральних та розчинних маслах, стійкий до кислот, основ, хлору та озону. Використовують полістирол для отримання спіненого полістиролу (тип ПСВ-С для виготовлення упаковки), удароміцний (тип УПМ, УПС – технічні вироби, корпуси, тара), полістирол загального призначення (тип ПСМ, ПСС). Вони мають певні недоліки: значна довжина, маленька товщина, слабкий зв'язок, велика здатність до руйнації. Реакції утворення з лінійних молекул тривимірної просторової ланцюгової структури - сітки - називають зшиванням, отвердінням, вулканізацією (у технології гуми - нагрів каучуку із сіркою). Речовини, які спеціально вводяться в реакційну суміш для зшивання довголанцюгових молекул називають мостикоутворювачами або зшивкою. Їх молекули також повинні містити більш ніж два активних зв'язки. Широко використовується при синтезі і/обм. полімерів зшивка – дивинілбензол (ДВБ) СН=СН2С6Н4СН=СН2: При полімеризації стиролу з ДВБ утвориться полімер. Окрема ланка його має вигляд:
Кожна молекула ДВБ як місток з'єднує два сусідні лінійних ланцюги (клітинками виділені мономірні ділянки стиролу і ДВБ). Ступінь зшивання іоніту визначається не лише вмістом ДВБ, тому що внаслідок введення функціональних груп можуть утворюватись додаткові поперечні зв'язки. Ступінь зшивання деякою мірою впливає на колір іонітів. Оптимальний вміст ДВБ звичайних гелевих іонітів 8 % - якщо менше іоніт стає м'якшим та може перейти в гель. Результуючий полімер стає структурованим і цілком нерозчинним. Полістирол
Поліакрил
Карбоксильні катіоніти синтезують шляхом сополімеризації з зшиваючим мономером, який несе карбоксильну або іншу функціональну групу, за рахунок якої в подальшому отримують карбоксильну групу. Зшиваючий агент – ДВБ – не містить іоногенних груп. Фіксовані іони (обмінні центри) карбоксильних катіонітів розташовані на лінійних полімерних ланцюжках, в які досить рідко (звичайно в зв’язку з низьким вмістом) впроваджені неіоногенні ділянки зшиваючого агенту, які порушують рівномірність розташування іоногенних груп в матриці іонітів, але не змінюють загальну картину складу ближнього оточення. По-перше, вміст зшиваючого агенту в промислових іонітах, які правило, не перевищує 10 %, тобто неіоногенна ділянка в кожному ланцюжку чередується, по меншій мірі, не менше ніж з 5 регулярно розташованими іоногенними групами. По-друге, впровадження зшиваючого агенту забезпечує зближення обмінних центрів зв’язаних ланцюжків, що компенсує відсутність функціональних груп в зшиваючому агенті. Тобто можна уявити, що кожний обмінний центр має по меншій мірі два сусідніх центри
Матриці і/обм. смол можуть бути отримані і полімеризацією акрилату, метакрилат у та іншими, кожний із який може бути міжмолекулярно пов'язаний із ДВБ. Таким чином одержують сучасні поліакрилові смоли, використовуючи припинену полімеризацію і каталіз. Акрилові смоли – полімери ефірів акрилової та метакрилової кислот. Сировина для виготовлення метилметакрилату – синильна кислота HCN, ацетон CH3COCH3 та метиловий спирт CH3OH. Акрилові смоли – безкольорові.
Матриця з метакрилату + ланка ДВБ
Порівняння стирольних та акрилових іонітів
5) В залежності від методу одержання і/обм. смоли підрозділяються на полімеризаційні і поліконденсаційні. При штучному одержанні органічних іонітів основна задача синтезу зводиться до: 1) створення молекул речовин, практично нерозчинних у воді; 2) введенню в ці молекули функціональних груп. Є декілька шляхів для того, але в основному це здійснюється введенням функціональних груп у молекулу нерозчинної у воді органічної речовини або одержання такої речовини з введеними у процесі синтезу функціональними групами. За першим шляхом синтезу отримані різноманітні марки сульфовугілля (СУ). (Для цього фракціоноване вугілля обробляють сірчаною кислотою - відбувається процес гуміфікації з утворенням карбоксильних груп і сульфування з утворенням сульфогруп - СУ містить два різновиди груп – переваги використання). (Гуміфікація - процес перетворення продуктів розкладання органічних залишків у гумус при участі вологи та О2).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 150; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.40.207 (0.157 с.) |



 ,
,  .[Alx+2ySizO2x+4y+2z]·nH2O, де M и D - одно- и двовалентні катіони відповідно.
.[Alx+2ySizO2x+4y+2z]·nH2O, де M и D - одно- и двовалентні катіони відповідно. ; шабазит
; шабазит  .
.












 .
.