
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спин-спиновое взаимодействие⇐ ПредыдущаяСтр 15 из 15
Спин-спиновое взаимодействие вызывает расщепление линий химических сдвигов. Оно обусловлено тем, что ядерные спины стремятся ориентировать спины электронов, те в свою очередь ориентируют спины электронов других ядер, а через них спины этих ядер.
Для подсчета числа сигналов спин-спинового взаимодействия пользуются формулой
2nJ + 1, где n - число протонов в соседней группе J = 1/2 CH3OH CH3 │ n = 1 2nJ + 1 = 2 OH │ n = 3 2nJ + 1 = 4
-ОН - СН3
6.6 ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС (ЭПР)
Открыт в 1944 году в Казани советским ученым Е.К.Завойским. Также как у ядер при наложении магнитного поля происходит расщепление энергетических уровней электрона. При наложении добавочного радиочастотного поля можно заставить электроны переходить с одного уровня на другой и при этом будет поглощаться энергия радиочастотного поля, которую можно зарегистрировать.
Спектр ЭПР можно представить в виде графика зависимости интенсивности от напряженности наложенного поля, но обычно спектры ЭПР представляются в виде производных кривых, т.е. графиков зависимости первой производной кривых поглощения от напряженности магнитного поля. Такой способ дает возможность получить гораздо большую чувствительность в случае широких линий.
6.7 СПЕКТРОСКОПИЯ Спектральные методы широко используются при исследованиях структуры и энергетических уровней молекул. Спектральные методы наиболее информированы. Полученные с их помощью значения молекулярных констант широко используются при статистико-термодинамических расчетах констант равновесия и теплофизических свойств газов. Эти методы нашли также повсеместное применение в химическом анализе. Электромагнитный спектр простирается от области жесткого gизлучения с очень короткой длиной волны до длинных радиоволн. Частота электромагнитных колебаний связана с длиной волны света n = с/l, где с - скорость света 2,997924×1010 см/c Размерность частоты │n │ = с-1
В спектроскопии принято называть частотой также волновое число w (n), показывающее сколько длин волн умещается на 1 см. Размерность│w│=см-1
Схема спектра
Видимая область 700 620 580 530 470 440 420 нм красный оранжевый желтый зеленый голубой синий фиолетовый
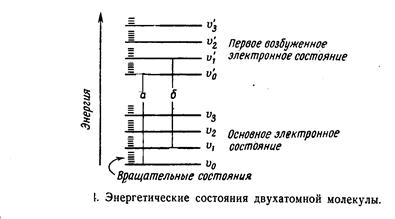
Каждая из областей спектра связана с определенными видами внутримолекулярных движений, процессами в атомах и ядрах. Все виды внутримолекулярных движений взаимосвязаны. Однако для каждой из них существует определенный набор допустимых значений энергии. При переходе с одного энергетического уровня на другой молекула поглощает или испускает квант света - фотон. Переходы с нижнего уровня на верхний порождают спектр поглощения, с верхнего на нижний - спектр испускания. Наиболее высоки кванты энергии, поглощенные или испускаемые при электронных переходах, затем следуют колебательные кванты и, наконец, самые малые, вращательные. Поэтому электронный переход обычно сопровождается колебательными и вращательными переходами.
6.8 ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ
Молекулы газообразных веществ постоянно совершают свободное вращательное движение вокруг осей симметрии. Кинетическая энергия молекул будет определяться их моментом инерции I = m r2 где m = mА,mВ - массы атомов, а1,а2 - атомные веса m0 - масса атома кислорода Молекулы не могут вращаться с произвольными угловыми скоростями, излучать или поглощать энергию произвольной величины. Вращательное движение молекулы описывается волновым уравнением Шредингера Н y = Еврy Решение этого уравнения дает значение энергии Евр как функцию вращательного квантового числа и момента инерции молекулы.
Евр = где i = 0,1,2,3 - вращательное квантовое число Изменение энергии при квантовом переходе с i1 на i2 = =1 DE = h2/8p2I ´[i2(i2 + 1) - i1(i1 + 1)] = =h2/8p2I ´2(i + 1) учитывая соотношение DЕ = hn и DЕ = hcw получим w = DE/hc = h/4p2Ic ´(i+ 1) = B (i + 1)
В - вращательная постоянная w1 = B(i + 1) w2 = Bi Dw = w1 - w2 = B эту величину можно найти из спектра и использовать для вычисления момента инерции молекул I = h/4p2Bc Зная момент инерции можно определить длину связи между атомами в двухатомной молекуле r =
6.9 КОЛЕБАТЕЛЬНЫЕ СПЕКТРЫ
Колебательный спектр многоатомной молекулы значительно сложен. Колебания многоатомных молекул можно разделить на валентные и деформационные. При валентных колебаниях изменяются межъядерные расстояния, а при деформационных угол между направлением химических связей. Сопоставление колебательных спектров многих органических соединений, в состав которых входят одинаковые функциональные группировки (СН3,СН2,ОН,NH2 и т.д.) показало, что в этих спектрах всегда присутствуют одни и те же мало отличающиеся друг от друга частоты. Было установлено, что некоторые частоты можно отнести к колебаниям ядер атомов в определенных атомных группировках. Такие частоты называются характеристическими. Обнаружение в спектре какого-либо соединения характеристических частот позволяет определить наличие в нем определенных функциональных групп. Это лежит в основе функционального молекулярного спектрального анализа органических соединений. Инфракрасный спектр является тонкой характеристикой вещества и служит критерием для установления идентичности соединений, дает информацию о наличии или отсутствии тех или иных групп атомов.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1.Краткий курс физической химии. Под ред. С. Н. Кондратьева. – М.: Высш. школа, 1978. 312 с. 2. А.Г. Стромберг, Д. П. Семченко. Физическая химия. - М.: Высш. школа, 1973. 480 с. 3.Физическая химия. Под ред. К.С. Краснова. – М.: Высш. школа, 1982. 687 с. 4. Я. И. Герасимов и др. Курс физической химии. т.1. – М.: Химия, 1969. 592 с. 5.Краткий справочник физико-химических величин. Под ред. К.П.Мищенко. – Л.: Химия, 1983. 232 с. 6. И.В. Кудряшов Г.С. Каретников. Сборник примеров и задач по физической химии. – М.: Высш. школа, 1991. 527 с.
СОДЕРЖАНИЕ с Введение 1 Исторический очерк развития физической химии 1 Химическая термодинамика 1.1 Основные понятия и определения химической термодинамики 3 1.2 Первый закон термодинамики 5 1.3 Применение первого закона термодинамики к процессам в любых системах 5 1.4 Термохимия. Закон Гесса 6 1.5 Приближенные методы расчета теплот образования и сгорания 7 1.6 Теплоемкость. Связь теплоемкости с термодинамическими функциями 8 1.7 Зависимость теплового эффекта от температуры. Уравнения Кирхгоффа 9 1.8 Второй закон термодинамики 10 1.9 Энтропия 10 1.10 Второй закон термодинамики для обратимых и необратимых процессов 11 1.11 Изменение энтропии в различных процессах 13 1.12 Постулат Планка. Вычисление абсолютной энтропии 14 1.13 Термодинамические потенциалы 1.14 Энергия Гельмгольца (изохорно-изотермический потенциал) 15 1.15 Энергия Гиббса (изобарно-изотермический потенциал) 15 1.16 Уравнение Гиббса-Гельмгольца 16 1.17 Характеристические функции 16 1.18 Химический потенциал. Летучесть 17 1.19 Химическое равновесие. Закон действующих масс 18 1.20 Уравнение изотермы реакции 19 1.21 Зависимость константы равновесия от температуры 20 1.22 Принцип подвижного равновесия (принцип Ле-Шателье) 20
1.23 Тепловая теорема Нернста 21 1.24 Расчет химического равновесия с помощью стандартных термодинамических величин 22 Фазовые равновесия 2.1 Общие понятия 23 2.2 Условия фазового равновесия 23 2.3 Правило фаз Гиббса 24 2.4 Уравнение Клаузиуса-Клапейрона 24 2.5 Однокомпонентная система воды 26 2.6 Диаграммы состояния двухкомпонентных систем 27 2.7 Трехкомпонентные системы 28 Растворы 3.1 Общая характеристика растворов 30 3.2 Закон Рауля 31 3.3 Понижение температуры замерзания и повышение температуры кипения разбавленных растворов 32 3.4 Осмотическое давление и его законы 33 3.5 Жидкие бинарные системы. Идеальные растворы 33 3.6 Растворы с положительными и отрицательными отклонениями от закона Рауля 34 3.7 Состав паровой фазы над растворами. Законы Коновалова 35 3.8 Термодинамика концентрированных растворов. Активность 37 3.9 Растворимость газов в жидкостях. Закон Генри 38 3.10 Растворимость твердых тел в жидкостях 39 3.11 Ограниченная взаимная растворимость жидкостей 40 3.12 Распределение растворенного вещества между двумя несмешивающимися жидкостями 40 3.13 Экстракция 41 Строение атомов 4.1 Волновые свойства электронов 43 4.2 Математическое описание волнового движения 44 4.3 Уравнение Шредингера 46 4.4 Решение уравнения Шредингера 46 4.5 Квантовые числа 48 4.6 Вид атомных орбиталей 50 4.7 Распространение волнового уравнения на другие атомы 51 4.8 Атомные термы 53 Химическая связь 5.1 Ионная связь. Энергия кристаллической решетки 56 5.2 Ковалентная связь 5.3 Метод молекулярных орбиталей 57 5.4 Расчет молекулярного иона водорода 60 5.5 Применение метода МО к двухатомным молекулам 62 5.6 Теория валентных связей 63 5.7 Квантовохимические представления о координационных соединениях 66 5.8 Межмолекулярное взаимодействие 67 5.9 Водородная связь 68
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 235; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.69.152 (0.054 с.) |

















 =
=  ´
´ 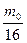
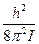 i(i+1),
i(i+1),



