
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Квантовохимические представления о координационных соединениях
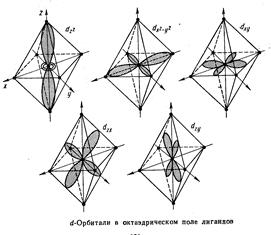
Координационными или комплексными соединениями называются соединения, содержащие центральный атом или ион и группу молекул или ионов его окружающих и связанных с ним (лигандов). Число лигандов, связанных с центральным атомом, называется координационным числом. Координационное число центрального атома обычно превышает его валентность. Высокая устойчивость многих комплексных соединений указывает, что химическая связь в них не отличается по своей природе от химической связи в обычных ионных или ковалентных соединениях. В большинстве координационных соединениях центральным является ион переходного металла Ti3+,Co3+,Fe2+, а лигандами – ионы или полярные молекулы [FeF6]4- [Fe(CN)6]4- Электростатические представления легли в основу теории комплексных соединений, так называемой теории кристаллического поля, учитывающей квантовохимические особенности строения оболочки центрального атома. В свободном атоме или ионе энергии всех d-электронов,принадлежащих к одной и той же электронной оболочке, одинаковы. Лиганды, присоединяемые к положительному иону, являются или отрицательными ионами или полярными молекулами, повернутые к комплексообразователю своим отрицательным концом. Между d-орбиталями и отрицательными лигандами действуют силы отталкивания, увеличивающие энергию d-электронов.В результате этого взаимодействия энергия d-электронов на d-орбиталях,расположенных близко к лигандам возрастает, а энергия электронов на d-орбиталях,удаленных от лигандов, уменьшается, т.е. под действием лигандов происходит расщепление энергетических уровней d-орбиталей и происходит замена d-уровня новым, расщепленным на несколько подуровней.
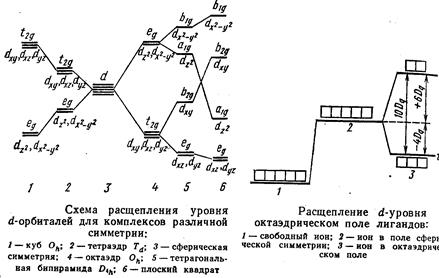
Так, например, первоначально пятикратно вырожденный d-уровень в центральном ионе переходного элемента при образовании октаэдрических комплексов расщепляется на два подуровня с более высоким значением энергии еg и три подуровня с более низким значением энергии t2g
Расщеплением кристаллического поля объясняется, почему ионы большинства комплексных соединений окрашены. Энергия переходов между t2g и eg уровнями невелика и ей отвечают частоты полос поглощения в видимой области спектра.
5.8 МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ
Ориентационное и индукционное взаимодействие Межмолекулярное взаимодействие называется ван-дер-ваальсовским взаимодействием. Энергия приблизительно равна 40 кдж; энергия химического взаимодействия - 280-300 кдж. Ориентационное взаимодействие возникает между молекулами, обладающими дипольными моментами, за счет электростатического взаимодействия между полярными частями. Энергия ориентационного взаимодействия Еор = - r – расстояние между молекулами Индукционное взаимодействие возникает вследствие поляризации молекул под действием соседних молекул. Индукционное взаимодействие слабее ориентационного. Еинд = - Дисперсионное взаимодействие У инертного газа, даже при абсолютном нуле, электроны перемещаются на орбиталях. В процессе движения электронов распределение зарядов внутри атомов становится несимметричным, в результате чего возникают мгновенные диполи. Каждый из таких диполей будет влиять своими зарядами на ориентацию подобного же мгновенного диполя, возникающего в соседнем атоме. Это явление и называется дисперсионным эффектом Едисп = - Суммарная энергия взаимодействия Епр = - n = Энергия отталкивания Еотт = Е = Епр + Еотт = -
ВОДОРОДНАЯ СВЯЗЬ
Водородная связь является промежуточной между молекулярными и химическими силами взаимодействия. Эта своеобразная связь устанавливается между водородным атомом, имеющим отличительные особенности от всех остальных атомов. Отдавая свой электрон на образование связи он остается в виде ядра(протона) без электрона, т.е. в виде частицы, диаметр которой в тысячи раз меньше диаметров остальных атомов. Кроме того, вследствие отсутствия у него электронов ион Н+ не испытывает отталкивания от электронной оболочки другого атома, а наоборот притягивается ею. Это позволяет ему ближе подходить к другим атомам, вступать во взаимодействие с их электронами и даже внедряться в их электронные оболочки. Поэтому в жидкостях водородный ион не сохраняется в виде самостоятельной частицы, а связывается с молекулами других веществ. В воде он связывается с молекулами Н2О, образуя ионы гидроксония Н3О+,с молекулами аммиака NH4+.
Водородная связь представляет собой как бы вторую побочную валентность водородного атома. Сила связи ¸ 20-30 кдж/моль Весьма важную роль водородная связь играет в структуре воды и льда Длина связи Н-О ковалентная = 0,99 А°,длина водородной связи - 1,76 А°. При плавлении льда происходит разрушение водородных связей, а при нагревании происходит расширение. Разрушение водородных связей приводит к уменьшению объема и в результате плотность воды проходит через максимум при 4°С.
6. ЭЛЕКТРИЧЕСКИЕ И МАГНИТНЫЕ СВОЙСТВА МОЛЕКУЛ ДИПОЛЬНЫЙ МОМЕНТ МОЛЕКУЛ
При несовпадении центров тяжести электрических зарядов в молекуле возникают электрические полюса - положительный и отрицательный. Такие молекулы называются полярными. Система из двух одинаковых противоположных зарядов называется диполем. За меру полярности принимается величина дипольного момента m, который представляет собой произведение заряда q на расстояние l m = q.l По порядку величины дипольный момент равен заряду электрона, умноженному на расстояние (10-10 эл.ст.ед.´ 10-8 см),что составляет 10-18 эл.ст.ед.см и равняется 1 дебаю. Если в молекуле имеется несколько полярных связей, то суммарный момент равен векторной сумме дипольных моментов отдельных связей
6.2 ПОЛЯРИЗАЦИЯ МОЛЕКУЛ. МОЛЬНАЯ РЕФРАКЦИЯ
Различные изменения, которые претерпевают молекулы под воздействием на них внешнего электрического поля, называются поляризацией. Различают ориентационную, атомную и электронную поляризации. Ориентационная поляризация представляет ориентацию полярных молекул в пространстве в соответствии с направлением внешнего электрического поля. С повышением температуры ориентационная поляризация уменьшается. Под атомной поляризацией подразумевается относительное смещение атомов, входящих в состав молекулы. Она характеризует смещение положительно заряженных ядер относительно отрицательного полюса. При электронной поляризации происходит смещение электронов относительно ядра атома. Атомная и электронная поляризации от температуры не зависят. Сумму электронной, атомной и ориентационной поляризаций называют общей или мольной поляризацией. Р = Ра + Рэ + Рор = Рор + Рд Рд = Ра + Рэ Сумму атомной и электронной называют деформационной поляризацией. При взаимодействии молекул с электромагнитными полями, в частности с видимым светом (l = 4000-8000 А),атомная и ориентационная поляризации не возникают, так как атомы не успевают перемещаться с та кой же скоростью, с которой происходят световые колебания. Электроны реагируют на колебания света. Мольная поляризация при этом равна только электронной поляризации и называется мольной рефракцией Rm = Рэ Мольная рефракция обладает аддитивными свойствами и является характерной константой данного вещества. Аддитивность рефракции используется для выяснения строения органических молекул. Rm = å n Ri,где n - число атомов Ri - инкременты мольной рефракции СН3-СН2-СООН - пропионовая кислота Rm = 3Rc + 6Rн + Rо-гидрокс + Rо-карбокс =
=3×2,418 + 6×1,10 + 1,325 + 2,211 = 17,59 см3/г-ат Опыт дает 17,68 см3/г-ат.
6.3 ОПРЕДЕЛЕНИЕ ДИПОЛЬНЫХ МОМЕНТОВ И МОЛЬНОЙ РЕФРАКЦИИ Широкое распространение получили методы определения дипольных моментов измерением диэлектрической проницаемости паров и разбавленных растворов полярных веществ в неполярных растворителях. Р = e - диэлектрическая проницаемость a - поляризуемость r - плотность e = n2 Rm = r = Для полярных молекул характерно неравенство
Для полярных молекул Дебай показал P = Для газов Если переписать уравнение Р = А + В/T, где А = 4/3pNaa B = Построив график зависимости Р от 1/Т, можно по тангенсу угла наклона прямой рассчитать дипольный момент. Для жидких и твердых веществ Растворяют вещество в неполярном растворителе и находят зависимость мольной поляризации Р12 от концентрации раствора
Р12 = Р12 = P1N1 + P2N2 P2 = Далее вычерчивают кривую зависимости поляризации от концентрации, экстраполируют кривую до бесконечного разведения раствора и определяют графически поляризацию вещества при его предельном разбавлении и заданной температур - Р¥. Вычислив Р¥ при нескольких температурах строят зависимость Р¥ = f(1/T) и по tg j вычисляют дипольный момент. Для одной температуры можно найти дипольный момент следующим образом P = Rm + Для газов m = 1,2815×10-20 √(Р - Rm)T эл.ст.ед. Для твердых и жидких веществ m = 1,2814×10-20√(Р - Rm)T эл.ст.ед.
6.4 МАГНИТНЫЕ СВОЙСТВА АТОМОВ И МОЛЕКУЛ
Мерой магнитных свойств вeщества служит магнитная восприимчивость Кm, характеризующая отношение исследуемых объектов к магнитному полю. Вещества с отрицательной восприимчивостью, т.е. такие, которые оказывают большее сопротивление магнитным силовым линиям, чем вакуум называются диамагнитными, вещества с положительной восприимчивостью называются парамагнитными, с очень высокой восприимчивостью называются ферромагнитными. В кристаллах диамагнитная восприимчивость часто оказывается анизотропной и определением главных восприимчивостей можно воспользоваться для получения информации о структуре кристалла. Этот метод применяется в основном к плоским ароматическим молекулам. Обычно магнитная восприимчивость в плоскости кольца и в направлении перпендикулярно плоскости сильно различаются. Парамагнетизм связан обычно с наличием неспаренных электронов
(NO,NO2,ClO2,O2,S2). Отсутствие парамагнетизма может служить основой для определения истинной формулы молекулы. Hg2Cl2 a не HgCl, H4P2O6 а не H2PO3, H2S2O4 а не HSO2. Неспаренный электрон имеет как спиновый, так и орбитальный угловой моменты. Спиновый угловой момент можно рассматривать как результат вращения электрона вокруг собственной оси, а орбитальный момент -как результат движения электрона вокруг атомного ядра. Сочетание этих двух эффектов приводит к возникновению магнитного момента и, следовательно, парамагнетизма. Если имеется n-неспаренных электронов, то магнитный момент выражается чисто спиновой формулой mэфф = mэфф выражается в единицах магнетона Бора (В.М.), представляющего собой естественную единицу измерения магнетизма и равного магнитному моменту электрона, вращающегося вокруг собственной оси. (В.М.) = Число неспаренных электронов 1 2 3 4 5 mэфф В.М. 1,73 2,83 3,87 4,9 5,92 Если по наблюдаемому магнитному моменту можно определить число неспаренных электронов, то иногда удается получить информацию о валентности парамагнитного атома, его стереохимии или типе связи в комплексах металлов.
6.5 ЯДЕРНЫЙ МАГНИТНЫЙ РЕЗОНАНС (ЯМР)
Ядра как и электроны обладают собственным магнитным моментом количества движения - спином. Квантовое число mJ = ±1/2.Значение mJ = + 1/2 отвечает ориентации вектора в направлении магнитного поля, а -1/2 ориентации в противоположном направлении. В отcутствии магнитного поля все ориентации ядерного момента вырождены, но при наложении поля вырождение снимается
DE = 2mH° = g h/2 H0,где m - магнитный момент g - гиромагнитное отношение H - напряженность внешнего магнитного поля Переориентация спина равнозначна переходу с одного уровня на другой и поэтому при этом энергия поглощается или выделяется в виде кванта электромагнитного излучения hn DE = hn0 = h/2pH0 n0 = g/2H0 - резонансная частота, т.е. частота при которой происходит переориентация спинов. Можно заставить ядра переходить с одного уровня на другой. Для этого необходимо, чтобы ядра нижнего уровня поглотили количество энергии с резонансной частотой. В этом случае на систему надо наложить еще радиочастотное поле. Так как энергия этого поля будет тратится, то будут появляться сигналы поглощения поля, которые могут быть усилены современной радиоаппаратурой.
Химический сдвиг Энергия резонанса зависит от электронного окружения ядра. Электроны экранируют ядро, так что напряженность поля у ядра НN отличается от напряженности приложенного поля Н0 НN = H0 (1 - s) s - постоянная экранирования Электрон прецессирует и создает добавочное поле, направленное против поля Н0 Смещение сигнала ядерного резонанса в зависимости от химического окружения, обусловленное различием в константах экранирования называется химическим сдвигом. Его измеряют в м.д. - миллионных долях приложенного поля. За О принимается сигнал (СН3)4-Si - тетраметилсилан. Здесь протоны имеют наибольшую плотность. Обычно меняется от 0 дo 10 м.д.
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 221; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.122.4 (0.046 с.) |
 где m = el - дипольный момент;
где m = el - дипольный момент; a - поляризуемость молекулы
a - поляризуемость молекулы , где n0 – частота колебания при абсолютном нуле.
, где n0 – частота колебания при абсолютном нуле.
 + 2am2 +
+ 2am2 + 
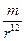 m - константа отталкивания
m - константа отталкивания
 =
=  pNaa - уравнение Клаузиуса-Моссотти
pNaa - уравнение Клаузиуса-Моссотти
 =
=  r – удельная рефракция
r – удельная рефракция )
)





 = 9,2837×10-21 эрг/гс
= 9,2837×10-21 эрг/гс






