Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Температуры кипения разбавленных растворов
Температурой замерзания чистой жидкости является та строго постоянная температура, при которой кристаллы находятся в равновесии с жидкостью, т.е. имеют такое же давление насыщенного пара, как и жидкость. Температурой кипения чистой жидкости или раствора называется та температура, при которой давление насыщенного пара становится равным внешнему давлению.
DТз = km DТз = k k =
DTk = Em DTk = E
E =
3.4 ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ И ЕГО ЗАКОНЫ
Раствор Растворитель
ЗАКОНЫ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ
1. При постоянной температуре осмотическое давление прямо пропорционально концентрации или обратно пропорционально молярному объему вещества. 2. При данной концентрации осмотическое давление пропорционально абсолютной температуре. 3. При одинаковой температуре и одинаковой концентрации разные вещества имеют одно и то же осмотическое давление. P =
ЖИДКИЕ БИНАРНЫЕ СИСТЕМЫ. ИДЕАЛЬНЫЕ РАСТВОРЫ
Рассматриваются законы равновесия между жидкой и паровой фазами систем, образованных двумя достаточно летучими и неограниченно растворимыми друг в друге компонентами. Наибольший интерес представляют диаграммы: состав- давление пара и состав-температура кипения. При заданной температуре общее давление Р раствора складывается из парциальных давлений РА и Рв компонентов Р = Pа + Рв Различают три группы растворов - идеальные, предельно разбавленные и неидеальные. Идеальным называется раствор, в котором силы взаимодействия FА.В между молекулами разных видов равны силам взаимодействия FA-A и FB-B между молекулами одного вида. Поведение идеального раствора, подобно поведению идеального газа, зависит только от концентрации компонентов и температуры. Согласно закона Рауля Pi = Рi°NiЖ Р = Ра + Рв = РА0 NAЖ+ РВ0 NBЖ= РА°NАЖ + РB0 (1 - NAЖ) = == РВ0 + NAЖ(PA0 – PB0)
Неидеальные растворы FB-B ¹ FA.B ¹FA.A Предельно разбавленные растворы - растворы, в которых концентрация растворенного вещества бесконечно мала. Pi = Pi0NiЖ Р2 = K2N2 (закон Генри)
РАСТВОРЫ С ПОЛОЖИТЕЛЬНЫМИ И ОТРИЦАТЕЛЬНЫМИ ОТКЛОНЕНИЯМИ ОТ ЗАКОНА РАУЛЯ
FB-B > FA-B < FA-A FB-B < FA-B > FA-A
СОСТАВ ПАРОВОЙ ФАЗЫ НАД РАСТВОРАМИ. ЗАКОНЫ КОНОВАЛОВА
Первый закон Коновалова. В общем случае относительное содержание данного компонента в паре отличается от относительного содержания этого компонента в равновесном с ним жидком растворе. В паре больше того компонента, добавление которого в раствор повышает общее давление пара P1 = P10 N1Ж Р2 = P2°(l-NiЖ)
Р1V = N1 n RT P2V = N2nRT =(1- N1n)RT
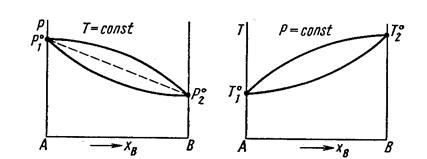
Очевидно, что составы жидкости и пара могут быть одинаковыми только при Р10 = Р20 Уравнение показывает, что для идеальной двойной системы пар будет всегда относительно богаче более летучим компонентом по сравнению с раствором, с которым он находится в равновесии. Если Р1°>Р2°(то
Nn1>N1Ж-
Второй закон Коновалова - Экстремумы на кривых общего давления пара или температуры кипения отвечают такому равновесию раствора и его насыщенного пара, при котором составы обеих фаз одинаковы.
ДИАГРАММЫ СОСТАВ – ДАВЛЕНИЕ ПАРА (ТЕМПЕРАТУРА КИПЕНИЯ) Совокупность равновесных состояний в двойной жидкой системе обычно изображается изотермической диаграммой,на которой наносятся кривые зависимости общего давления пара (температуры) как от состава жидкости, так и от состава пара.
ПЕРЕГОНКА. РЕКТИФИКАЦИЯ
Перегонка построена на различии состава жидкой смеси и равновесного с ней пара. Существует перегонка в равновесии, фракционная перегонка, ректификация. Перегонка в равновесии (однократная)
Фракционная перегонка - это такой процесс, при котором в пар переводится только часть разделяемой жидкой смеси. Ректификация
Принцип процесса ректификации сводится к следующему. Если жидкость и пар разного состава поступают на данную тарелку с разных сторон, то между ними происходит тепло и массообмен. В результате этих процессов состав пара смещается в сторону более легколетучего компонента, а состав жидкости смещается в сторону менее летучего компонента. Происходит охлаждение пара, приводящее к частичной его конденсации и нагревание жидкости, вызывающее частичное ее испарение. Таким образом, восходящий поток пара, теряя в результате контакта с жидкостью высококипящий компонент и приобретая легкокипящий компонент, обогащается им, жидкость же, стекающая по мере накопления на тарелках вниз, обогащается высококипящим компонентом. При достаточном количестве тарелок, число которых рассчитывается на определенную полноту разделения, можно полностью разделить смесь.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 274; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.39.74 (0.008 с.) |


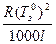
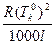








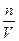 RT = cRT
RT = cRT


 =
= 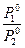 ×
× 


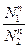 >
>