Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Решение уравнения Шредингера
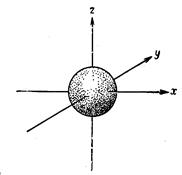
Рассмотрим теперь качественно метод, используемый для решения уравнения Шредингера для случая атома водорода. Первым шагом является упрощение решения путем преобразования уравнения от декартовых координат (оси х, у и z) к сферическим полярным координатам. При преобразовании системы координат уравнение Шредингера переходит в уравнение
( . +( Здесь m — приведенная масса ' m = где М— масса ядра, m—масса электрона. Уравнение можно разделить на более простые уравнения, каждое из которых включает только одну переменную r, q или j и может быть решено независимо. Эти уравнения имеют бесконечное множество решений; но, для того чтобы решения имели смысл для описания поведения электрона в атоме, они должны удовлетворять изложенным ниже требованиям «а» — «в». Каждое возможное решение представляет собой волновую функцию y, описывающую орбиталь — состояние атома. Для выделения пригодных решений из бесконечного общего числа их нужно отобрать те, точки, что удовлетворяют следующим условиям: а) волновая функция должна быть конечной и непрерывной т. е. она не должна обращаться в бесконечность ни при каких значениях r, q и j. б) решение должно быть однозначным, т. е. в любой данной точке амплитуда может иметь только одно значение, а не несколько; в) решения должны быть нормированы; это условие требует, чтобы взятый по всему пространству интеграл от функции (являющейся решением), возведенной в квадрат и умноженной на dt, был равен единице, т. е.
Поскольку y2dt связано с вероятностью нахождения электрона в элементе объема dt, интегрирование в уравнении просто требует, чтобы вероятность нахождения электрона где-либо в пространстве была равна единице. Для неионизованного атома имеется лишь ограниченное число решений уравнения Шрёдингера, удовлетворяющих всем сформулированным выше требованиям. Такие дозволенные решения называются собственными функциями, и каждое из них описывает состояние — орбиталь, на которой в атоме могут находиться два электрона Орбитали отличаются нижними индексами при y; каждая орбиталь однозначно определяется набором квантовых чисел n,l и m, где n соответствует основному номеру оболочки Уравнения для ynp разделяются на радиальную часть yr (зависящую от расстояния г) и угловую часть yqj (являющуюся функцией углов q и j). Полная волновая функция представляет собой просто произведение этих двух частей, т. е. y=yqjyr.Выражения для s-орбиталей не включают никакой зависимости от углов, и поэтому они обладают сферической симметрией. Число решений указывает, сколько существует орбиталей с данной энергией (т. е. в данной оболочке с одним главным квантовым числом). Для орбитали, отвечающей оболочке с n=1 (т.е. оболочке с самой низшей энергией), возможно только одно решение y1s. Для значений энергии, соответствующих n=2, имеются два очень близких энергетических уровня, соответствующих волновым функциям y2s и y2p. Есть только одно решение для y2s и три решения для y2p, соответствующие трем орбиталям y2p0,y2p+1,y2p-1. Эти три 2р-орбитали имеют все одинаковую энергию. Для описания равенства энергий трех орбиталей используется термин«триждывырожденные». Для энергий, отвечающих оболочке с п=3, имеется девять решений, соответствующих одной y3s-орбитали, трем вырожденным y3p-орбиталям и пяти вырожденным ysd-орбиталям. Решений, которые отвечали бы орбиталям y1p или y2d, нет, и таких орбиталей нет. Таким образом, выбрав в качестве модели стоячую волну, включив в волновое уравнение гипотезу де Бройля и отобрав физически приемлемые решения получившегося уравнения, можно сосчитать число возможных орбиталей в атоме водорода.
4.5 КВАНТОВЫЕ ЧИСЛА
n - главное (радиальное) l - орбитальное (азимутальное) ml = магнитное. - Существует ряд правил, которые позволяют определять возможные значения n, l и ml;. Квантовое число n может иметь любое положительное целочисленное значение, за исключением нуля. Все возможные значения l, соответствующие данному n, передаются соотношением l =п— 1 ,..., 0, где многоточие означает все целые числа, необходимые для заполнения ряда. Возможными значениями ml;, соответствующими данному l, являются ml;= +l, l—1,..., 0,.... —l+1, —l. На каждой орбитали могут находиться два электрона, которые отличаются квантовым числом спинового магнитного момента ms, равным либо +1/2,либо —1/2. Квантовые числа n,lи ml и приведенные выше правила являются следствием решения уравнения Шрёдингера.. Главное квантовое число n появляется при решении уравнения для радиальной части функции y и в первом приближении определят энергию орбитали. Главное квантовое число связано также качественно с расстоянием от ядра до наиболее вероятной области нахождения электрона. Это квантовое число соответствует оболочкам К, L, М и т. д. в модели Бора.
Квантовые числа l и mi появляются при решении уравнений для угловой части функции y и связаны соответственно с величиной и ориентацией углового момента (произведения угловой скорости на момент инерции) электрона на данной орбитали. Орбиталь с l=0 является сферической, не имеет углового момента и обозначается буквой s. Oбычно используются следующие символы: s для l==0, р для l=1, d для l = 2, f для l=3. S – sharp - резкий P – principal - главный d – diffuse – диффузный f – fundamental - основной . Спиновые квантовые числа ms, равные +1/2 или -1/2, не появляются при решении. уравнения Шрёдингера, но необходимы для того, чтобы однозначно описать состояние электронов в атоме. Это квантовое число ассоциировано со спиновым угловым моментом электрона (грубой физической моделью этого свойства может служить представление о вращении электрона вокруг своей оси). При описании орбитали обычно указывается главное квантовое число n и затем даются сокращенные обозначения орбитального квантового числа l в виде s, p, d или f, например 3p. Имеются три такие 3p-орбитали, соответствующие ml=+l, 0 и -1 Существование таких орбиталей подтверждается опытными данными, полученными из атомных спектров. Электронные переходы с одной орбитали на другую,(т. е. на уровень с другой энергией), сопровождаются поглощением (если электрон возбуждается на орбиталь с более высокой энергией) или испусканием (если электрон переходит на орбиталь с более низкой энергией) излучения, частота которого n связана с разностью энергий орбиталей выражением E=hn. Главные линии в атомных спектрах соответствуют большим разностям энергий и обусловлены электронными переходами между уровнями энергий с различными значениями n. Переходы между уровнями с одинаковыми n, но различными l (т. е. s, p, d, f), приводят к появлению тонкой структуры основных линий, так как разным значениям l соответствуют небольшие различия в энергиях. Эта тонкая структура свидетельствует о действии квантового числа l. Экспериментальным доказательством существования квантового числа m является эффект Зеемана, а именно расщепление спектральных линий в магнитном поле. Все p-орбитали с данным n вырождены, но в присутствии магнитного поля появляются небольшие отличия в энергиях, соответствующие различным квантованным ориентациям вектора углового момента орбитали относительно поля.
4.6 ВИД АТОМНЫХ ОРБИТАЛЕЙ
Важные для химика-экспериментатора сведения можно получить, рассмотрев вид различных орбиталей являющихся приемлемыми решениями уравнения Шрёдингера. Напомним, что, согласно требованиям принципа неопределенности, мы можем судить о нахождении электрона на различных орбиталях (s, p, d, f) в определенных положениях только в терминах вероятностей y2. Рассмотрим подробно s-орбитали. Уравнения для Is-, 2s- и 3s-орбиталей и аналогичные выражения для других s-орбиталей показывают, что амплитуда y не зависит от углов q и j>, которые не появляются в формулах для этих орбиталей.
Поскольку ydt не зависит от углов, s-орбитали должны обладать сферической симметрией относительно ядра. котором изображена. Такая поверхность дает представление о виде s-орбитали и является графиком зависимости r от q и j в сферических координатах
S - орбитали
р- орбитали
d - орбитали
. р-Орбитали являются трехмерными поверхностями, которые можно представить себе, рассматривая поверхности, возникающие при вращенииих двумерных изображений на 180° вокруг осей. d-Орбитали также являются трехмерными поверхностями; орбиталь dx-y располагается вдоль осей х и у, орбиталь dxy—между осями х и у, dyz—между у и z, dxz—между х и z, a dz — вдоль оси z.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 272; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.174.156 (0.015 с.) |

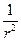 )(
)(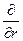 )(r2
)(r2  ) + (
) + ( )(
)( )(sinq
)(sinq  ) +
) + )(
)( ) +
) +  )y = 0
)y = 0 ,
,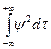 = 1
= 1