Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Номенклатура карбонових кислот
За міжнародною(систематичною або номенклатурою ІЮПАК) назви карбонових кислот походять від відповідних назв алканів, включаючи атом Карбону карбоксильної групи, із додаванням закінчення [ова] і слово [кислота]. Нумерацію атомів Карбону проводять цифрами, включаючи атом С карбосильної групи. Для карбонових кислот характерні і історичні назви. Нумерацію атомів Карбону проводять грецькими буквами(α,β,γ,δ,ε,ζ,η,θ…ω), починаючи з атома С, що стоїть поряд з атомом Карбону карбоксильної групи. НСООН - метанова кислота, мурашина кислота,форміатна кислота СН3 СООН - етанова кислота, оцтова кислота, ацетатна кислота С2Н5 СООН - пропанова кислота, пропіонова кислота С3Н7 СООН - бутанова кислота, масляна кислота С4Н9 СООН - пентанова кислота, валеріанова кислота С5Н11 СООН - гексанова кислота, капронова кислота
СН3 5 4 3 2| 1 СН3─СН─СН2-С─СООН міжнародна назва || Сl СН3 2,2-диметил-4-хлоропентанова кислота
СН3 δ γ β α| СН3─СН─СН─С ─СООН історична назва || Сl СН3 α,α-диметил-γ-хлоровалеріанова кислота
Цифри або літери (грецькі чи латинські), які стоять у назвах карбонових кислот перед замісниками називаються локантами.
Назви кислотних залишків карбонових кислот НСОО - метаноат, форміат СН3 СОО - етаноат, ацетат С2Н5 СОО - пропаноат, пропіонат С3Н7 СОО - бутаноат, маслянат, бутират Фізичні властивості карбонових кислот Перші представники карбонових кислот є рідини тому, що між молекулами існує водневий зв’язок( за рахунок поляризації карбоксильної групи), добре розчинні у воді, мають різкий запах.. Вищі карбонові кислоти – тверді воскоподібні речовини, нерозчинні у воді. З підвищенням відносної молекулярної маси розчинність карбонових кислот зменшується, а температура кипіння - підвищується. Oδ- R - С δ-O= C -OHδ+ ∙ ∙ ∙ δ-O= C -OHδ+ ∙ ∙ ∙ δ-O= C -OHδ+ ОНδ+ │ │ │ R R R
Хімічні властивості карбонових кислот Всі хімічні властивості карбонових кислот відбуваються по характеристичній (функціональній) групі - -СООН. І. Загальні властвості як кислоти (реакції по атомі Н групи СООН) 1. реакція дисоціація: СН3СООH ↔ СН3СОО- + Н+ Карбонові кислоти є слабкі електроліти (в реакціях йонного обміну записуються в молекулярному винляді), але сильніші за слабкі неорганічні кислоти.
2. реакція з металами до Н: Zn + 2СН3СООH = (СН3СОО)2 Zn + H2↑ Цинк етаноат Zn + 2СН3СООH = 2СН3СОО- + Zn2+ + H2↑ З. реакція з оксидами металів: Fe O + 2НСООH = (НСОО)2 Fе + H2O Ферум (ІІ) метаноат(форміат) 4. реакція з основами (реакція нейтралізації): Na OH + С2Н5СООН= С2Н5СОО Na + H2O Натрій пропаноат(пропіонат) Na+ + OH- + С2Н5СООН= С2Н5СОО- + Na+ + H2O 5. реакція з солями, утвореними неорг. слабкими кислотами: Na2 С O3 + 2H СООН = 2НСОО Na + H2O + СО2↑(Н2СО3) Натрій метаноат(форміат) І. Реакції по ОН карбоксильної групи. 1. реакція естерифікації (характерна для тільки органічних кислот) Це реакція карбонових кислот з спиртами (при цьому атом Н карбоксильної групи карбонової кислоти заміщується на вуглеводневий радикал спирту) і утворюється естер і вода. Каталізатором реакції етерифікації є конц. H2SO4. СН3 СООН + С2Н5 ОН → СН3 СООС2Н5 + Н2О Естер (етилетаноат або етилацетат) ІІІ. реакція заміщення атомів Н у вуглеводневому радикалі карбонової кислоти(починаючи з етанової кислоти) 1. реакція галогенування ( каталізатор – світло, як в алканах) СН3 СООН + Cl2 → СН2 СОOH + НCl 2-хлороетанова кислота | Cl IV. реакція приєднання до карбонільної групи (– С=О) карбоксильної групи кислот Реакція гідрування –(відновлення) СН3 СООН + Н2 → СН3 С(O)H + Н2О етаналь При повному відновленні карбонових кислот утворюється спирт СН3 СООН + 2 Н2 → СН3 СН2ОH + Н2О етанол Добування карбонових кислот ІІ. Загальні методи добування 1.реакція окиснення спиртів за схемою: R-OH → R-C(O)H → RCOOH C2H5 ОН + [О] → CH3- С(О)H + Н2О або CuO + Cu CH3- С(О)H + [О] → CH3- СООH + Н2О або зразу C2H5 ОН + [О] → CH3- СООH + Н2О 2. реакція окиснення алканів киснем повітря в присутності каталізатора – солей Mn. Mn2+ 2С4Н10 + 5O2 → 4CH3 СООН + 2Н2О 3. реакція натрієвих солей карбонових кислот з сильними неорганічними кислотами СН3 СООNa + Н Cl → СН3 СОOH + NaCl
Застосування карбонових кислот І. НСООН(найсильніша із всіх органічних кислот ) Метанова кислота на відміну від інших карбонових кислот містить дві характеристичні групи: альдегідну і карбоксильну
О О Н – С або НО- С ОН Н Тільки для метанової (мурашиної) кислоти характерна реакція «срібного дзеркала» і «мідного дзеркала» подібно як для альдегідів О О НО- С + Ag2O → НО- С + 2Ag↓ Н ↓ ↑ ОН СО2↑ + Н2О Карбонатна кислота!!! – Н2СО3 1. в медицині 1,25% розчин її використовується як «мурашиний спирт» (входить до складу мурашок, кропиви, хвої ялини); 2. як засіб для боротьби з кліщами бджіл; 3. для одержання естерів, які використовуються як розчинники і пахучі речовини. ІІ. СН3 СООН 1. для одержання барвників(наприклад,індиго), медикаментів(наприклад, аспірину), естерів, ацетатного волокна, гербіцидів.; 2. 3-9% розчин оцтової кислоти – оцет - використовується як смаковий і консервуючий засіб, 70-80% розчин – оцтова есенція. Представники різних класів карбонових кислот І. Вищі насичені одноосновні карбонові кислоти (нерозчинні у воді!) - С15Н31СООН - пальмітинова кислота! - С17Н35СООН - стеаринова кислота! Найбільш характерною реакцією для них є реакція нейтралізації, внаслідок якої утворюються солі, які називають милами. С15Н31СООН + NaOH → С15Н31СООNa + H2O Натрій пальміат
С17Н35СООН + NaOH → С17Н35СООNa + H2O Натрій стеарат Мило – це тільки натрієві або калієві солі вищих карбонових кислот. Мило поділяється: 1. тверде; 2. рідке. Тверде мило – це натрієві солі: С15Н31СООNa, С17Н35СООNa Рідке мило – це калієві солі: С15Н31СООК, С17Н35СООК. ІІ. Ненасичені карбонові кислоти СН2=СН-СООН -пропенова кислота або акрилова кислота С17Н33СООН – олеїнова кислота (вища ненасичена кислота)! С17Н31СООН - лінолева кислота (вища ненасичена кислота) С17Н29СООН - ліноленова кислота (вища ненасичена кислота) ІІІ. Двоосновні карбонові кислоти ( містять дві СООН групи) НООС-СООН етандіова кислота, щавелева кислота Солі щавелевої кислоти називаються оксалатами. ІV. Окси кислоти (містять дві групи ОН і СООН) СН3-СН-СООН 2-оксипропанова кислота, молочна кислота. │ ОН Солі молочної кислоти називаються лактатами. V. Ароматичні кислоти. С6Н5СООН - бензойна кислота, бензоатна кислота
Естери Естери – це похідні від карбонових кислот, в яких атом Н карбоксильної групи СООН заміщений на вуглеводневий радикал. Загальна формула естерів: RCOOR′ де R – H, CH3, C2H5 і т.д., а R′ - тільки CH3, C2H5 і т.д. СnH2nO2 де: n = 1,2,3,4 і т.д. Одержують естери реакцією еcтерифікації карбонових кислот із спиртами в присутності конц. H2SO4: RCOOН + R′ ОН → RCOOR′ +Н2О СН3СООН + С2Н5 ОН → СН3СООС2Н5 + Н2О Назви естерів походять від назв радикалів спиртів і назви кислотного залишку карбонових кислот. RCOOR′ 2 ← 1 СН3СООС2Н5 - етилетаноат, етилацетат, етиловий естер оцтової кислоти НСООСН3 - метилметаноат, метилформіат, метиловий естер мурашиної кислоти. Естери є міжкласовими ізомерами до карбонових кислот: НСООСН3 - метилметаноат - С2Н4О2 СН3СООН – етанова кислота- С2Н4О2
За фізичними властивостями естери – це рідини, які мають квітково-фруктовий запах, легші від води. Наприклад: - бутиловий естер масляної кислоти – запах ананасів; - бутиловий естер мурашиної кислоти – запах вишень; - етиловий естер масляної кислоти – запах абрикосів
Хімічні властивості естерів Реакція гідролізу А). водний гідроліз або гідроліз:
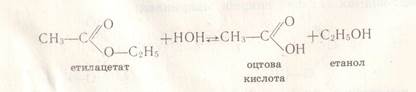
Це взаємодія естерів з водою внаслідок чого утворюється кислота і спирт. Реакція оборотна. СН3СООС2Н5 + Н2О ↔ СН3СООН + С2Н5 ОН
Б) лужний гідроліз або омилення: Це взаємодія естерів з лугами і при цьому утворюється сіль карбонової кислоти і спирт. Реакція необоротна. СН3СООС2Н5 + NaОH → СН3СООNa + С2Н5 ОН 2. реакція горіння. СН3СООС2Н5 + 5О2 → 4СО2 + 4Н2О С4Н8О2
Застосування естерів 1. як запашні речовини речовини при виробництві напоїв, цукерок (фруктові есенції), у парфумерії; 2. як розчинники лаків (рідина для зняття лаку з нігтів - етилацетат).
Жири (ліпіди)
Жири – це естери на основі тільки триатомного спирту гліцеролу і вищих насичених і ненасичених карбонових кислот. СН2 ОН С15Н31СООН - пальмітинова кислота (насичена)! | С17Н35СООН - стеаринова кислота (насичена)! СН ОН С17Н33СООН - олеїнова кислота (ненасичена)! | C17H31COOH - лінолева кислота (ненасичена) СН2 ОН C17H29COOH - ліноленова кислота (ненасичена)
Гліцерин, гліцерол Одержують жири реакцією естерифікації тільки гліцерину і вищих карбонових кислот (три молекули!)
СН2 ОН CH2OOC- R │ │ СН ОН + 3RCOOH → СН ОOC- R + 3Н2O │ │ СН2 ОН СН2 ОOC- R Загальна формула жирів (тригліцеридів – інша назва жирів): CH2OOC- R │ СН ОOC- R де R= С15Н31, С17Н35, С17Н33 │ СН2 ОOC- R
|
|||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 748; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.69.151 (0.049 с.) |